DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: adultos con sospecha o certeza de sepsis.
- Alcance: reconocimiento y manejo inicial de pacientes con sepsis.
Autores
Expertos clínicos:
- Ricardo Carpio Guzmán
- Enrique Luis Paz Rojas
- Manuel Esteban Apolaya Rosell
- Manuel Ruperto Benavente Apaza
- Martín Wilfredo Chincha Liro
- Shalim Juan Rodriguez Giraldo
- Eduardo Alexis Ruiz Garate
- Sandra Solis Torres
Metodólogos:
- Jorge Huaringa Marcelo
- Kevin Pacheco Barrios
- Alvaro Renzo Taype Rondán
Coordinador:
- Raúl Alonso Timaná Ruiz
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
Flujograma del reconocimiento y manejo inicial de sepsis
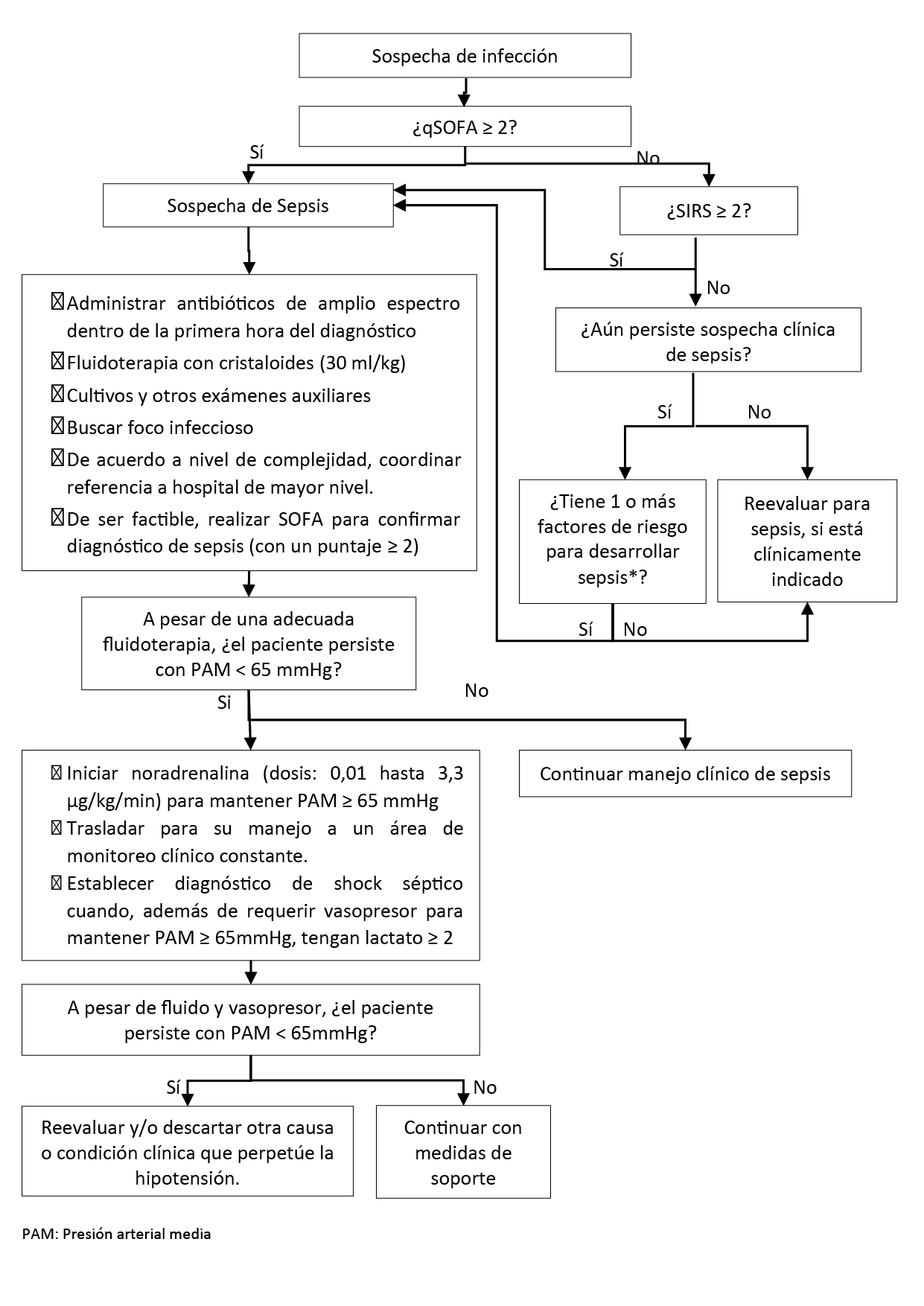
vacio
vacio
1. Evaluación inicial
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Durante la evaluación inicial de los pacientes con sospecha de infección, sugerimos usar el índice qSOFA (con punto de corte ≥ 2 puntos) para identificar a los pacientes con mayor riesgo de muerte y peor pronóstico. (Recomendación débil a favor, certeza muy baja de la evidencia)
Recomendación 2:
En aquellos pacientes con sospecha de infección que obtengan un índice de qSOFA < 2 puntos, sugerimos utilizar el índice SIRS (con punto de corte ≥ 2 puntos) para identificar a los pacientes con mayor riesgo de muerte y peor pronóstico (Recomendación débil a favor, certeza muy baja de la evidencia)
BPC 1:
En pacientes con sospecha de infección y puntaje qSOFA ≥ 2 o SIRS ≥ 2, establecer la sospecha de sepsis e iniciar manejo protocolizado de sepsis.
BPC 2:
En pacientes con puntajes < 2 en qSOFA y < 2 en SIRS, en los que el médico tratante aún mantenga una sospecha clínica de sepsis, evaluar factores de riesgo para sepsis. Si el paciente presenta uno o más factores de riesgo para sepsis, establecer la sospecha de sepsis e iniciar manejo protocolizado de sepsis.
BPC 3:
En pacientes con sospecha o certeza de infección que tengan puntajes < 2 en qSOFA y < 2 en SIRS, en los que el médico tratante no mantenga una sospecha clínica de sepsis, re-evaluar para sepsis cuando esté clínicamente indicado.
BPC 4:
Tener en cuenta que los pacientes con sepsis pueden presentar manifestaciones clínicas inespecíficas y pueden no tener un foco infeccioso aparente.
BPC 5:
En pacientes con sospecha de sepsis, solicitar los siguientes exámenes según disponibilidad:
- Gases arteriales y electrolitos
- Glucosa
- Lactato
- Hemocultivos y cultivos de otros focos según indicación clínica
- Hemograma completo
- Urea y creatinina
- Tiempo de Protrombina (TP), Tiempo de Tromboplastina Parcial activada (TTPa)
- Bilirrubina total y fraccionada
- Examen completo de orina
- Radiografía de tórax
BPC 6:
En pacientes con sospecha de infección, que presenten un puntaje ≥ 2 en el índice SOFA o un aumento de ≥ 2 puntos de su puntaje basal en el índice SOFA, se establecerá el diagnóstico de sepsis.
2. Terapia antibiótica empírica
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con sospecha o certeza de sepsis, recomendamos iniciar la terapia antibiótica endovenosa antes de la primera hora de establecida la sospecha. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BPC 1:
Deberá realizarse al menos dos hemocultivos y cultivos de otros focos infecciosos probables. Sin embargo, esto no debe retrasar el inicio de la terapia antibiótica.
BPC 2:
La terapia antibiótica empírica administrada deberá cubrir a los agentes microbianos más probables causantes de la sepsis; esto en función al foco probable de infección, probabilidad de resistencia bacteriana y el criterio clínico.
3. Fluido para resucitación inicial
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con sospecha o certeza de sepsis o shock séptico, recomendamos usar solución salina normal para la resucitación inicial y la reposición del volumen intravascular. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
En la resucitación inicial de los pacientes con sospecha de sepsis, realizar un reto de fluidos con solución salina normal de manera inmediata, a una dosis máxima de 30 ml/kg, dentro de las primeras 3 horas de iniciado el manejo. Para dicha resucitación, se tomará en cuenta las condiciones clínicas pre-existentes en el paciente.
BPC 2:
Luego de la resucitación inicial, el requerimiento de fluidos adicional deberá ser guiado en función a: funciones vitales, diuresis, saturación de oxígeno, examen clínico, medio interno y monitoreo hemodinámico no invasivo e invasivo; según disponibilidad y criterio clínico.
4. Lactato sérico
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con sospecha o certeza de sepsis, sugerimos dosar el lactato sérico. (Recomendación débil a favor, certeza muy baja de la evidencia)
BPC 1:
Los pacientes con sepsis y con lactato ≥ 2mmol/L tienen mayor riesgo de muerte, por lo cual se debe considerar su transferencia a un área de monitoreo clínico constante.
BPC 2:
Los pacientes con sepsis que requieren vasopresor para mantener PAM ≥ 65mmHg y tengan un lactato sérico ≥ 2mmol/L serán catalogados como shock séptico.
5. Vasopresor
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con sospecha o certeza de sepsis en quienes esté indicado el uso de vasopresores, recomendamos usar noradrenalina como vasopresor de primera elección. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BCP 1:
En pacientes con sospecha o certeza de sepsis, que a pesar de una adecuada fluidoterapia persistan con presión arterial media < 65mmHg, recomendamos iniciar tratamiento con vasopresor.
BCP 2:
Considerar la transferencia de los pacientes en los que se inicie vasopresores a un área de monitoreo clínico constante.
BPC 3:
La noradrenalina deberá ser administrada idealmente por vía endovenosa central.
BPC 4:
La dosis recomendada de noradrenalina en sepsis debe ser entre 0,01 y 3,3 µg/kg/min, y debe ser titulada según la presión arterial media objetivo.
BPC 5:
En los pacientes que persistan con presión arterial media < 65mmHg a pesar de una adecuada fluidoterapia y tratamiento con vasopresor, se deberá descartar otra causa o condición clínica que perpetúe la hipotensión.
6. Presión arterial media objetivo
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con ERC en estadio 1 al 3 y dislipidemia, sugerimos no brindar estatinas solo para prevenir la progresión de la ERC.(Recomendación débil a favor, certeza muy baja de la evidencia)
BPC 1:
En pacientes con sospecha o certeza de sepsis que usen tratamiento vasopresor, evitar mantener una presión arterial media ≥ 80 mmHg.
BPC 2:
Considerar que ciertos subgrupos, como los hipertensos crónicos, podrían beneficiarse de mantener una presión arterial media objetivo más alta (≥ 80 mmHg).
BPC 3:
En los pacientes con sospecha o certeza de sepsis en los que se usen vasopresores, realizar monitoreo constante de la presión arterial media.
Referencias bibliográficas
- Romagnani P, Remuzzi G, Glassock R, Levin A, Jager KJ, Tonelli M, et al. Chronic kidney disease. Nature reviews Disease primers. 2017;3:17088.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter. S. 2013;3:1-150.
- Saran R, Robinson B, Abbott KC, Agodoa LY, Albertus P, Ayanian J, et al. US renal data system 2016 annual data report: epidemiology of kidney disease in the United States. American journal of kidney diseases. 2017;69(3):A7-A8.
- Xie Y, Bowe B, Mokdad AH, Xian H, Yan Y, Li T, et al. Analysis of the Global Burden of Disease study highlights the global, regional, and national trends of chronic kidney disease epidemiology from 1990 to 2016. Kidney international. 2018;94(3):567-81.
- Francis ER, Kuo C-C, Bernabe-Ortiz A, Nessel L, Gilman RH, Checkley W, et al. Burden of chronic kidney disease in resource-limited settings from Peru: a population-based study. BMC nephrology. 2015;16(1):114.
- Herrera-Añazco P, Atamari-Anahui N, Flores-Benites V. Número de nefrólogos, servicios de hemodiálisis y tendencia de la prevalencia de enfermedad renal crónica en el Ministerio de Salud de Perú. Revista Peruana de Medicina Experimental y Salud Pública. 2019;36:62-7.
- Llanos RQ, Ramírez RR, Palacios MT, Flores CF, Borda-Olivas A, Castillo RA, et al. Encuesta de Salud en un sistema sanitario peruano (ENSSA): diseño, metodología y resultados generales. Revista de saúde pública. 2019;53:33.
- Carrillo-Larco RM, Bernabé-Ortiz A. Mortality from chronic kidney disease in Peru: national trends 2003-2015. 2018.
- Bravo-Zuniga J, Galvez-Inga J, Carrillo-Onofre P, Chavez-Gomez R, Castro-Monteverde P. Early detection of chronic renal disease: coordinated work between primary and specialized care in an ambulatory renal network of Peru. Jornal brasileiro de nefrologia : ‘orgao oficial de Sociedades Brasileira e Latino-Americana de Nefrologia. 2019;41(2):176-84.
- Chen TK, Knicely DH, Grams ME. Chronic Kidney Disease Diagnosis and Management: A Review. Jama. 2019;322(13):1294-304.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ (Clinical research ed). 2008;336(7650):924-6.
- Balshem H, Helfand M, Schünemann HJ, Oxman AD, Kunz R, Brozek J, et al. GRADE guidelines: 3. Rating the quality of evidence. Journal of clinical epidemiology. 2011;64(4):401-6.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Gheewala PA, Zaidi STR, Jose MD, Bereznicki L, Peterson GM, Castelino RL. Effectiveness of targeted screening for chronic kidney disease in the community setting: a systematic review. Journal of nephrology. 2018;31(1):27-36.
- Qaseem A, Hopkins RH, Sweet DE, Starkey M, Shekelle P. Screening, monitoring, and treatment of stage 1 to 3 chronic kidney disease: A clinical practice guideline from the American College of Physicians. Annals of internal medicine. 2013;159(12):835-47.
- Komenda P, Ferguson TW, Macdonald K, Rigatto C, Koolage C, Sood MM, et al. Cost-effectiveness of primary screening for CKD: a systematic review. American journal of kidney diseases : the official journal of the National Kidney Foundation. 2014;63(5):789-97.
- Weckmann GFC, Stracke S, Haase A, Spallek J, Ludwig F, Angelow A, et al. Diagnosis and management of non-dialysis chronic kidney disease in ambulatory care: a systematic review of clinical practice guidelines. BMC nephrology. 2018;19(1):258.
- Lunyera J, Mohottige D, Von Isenburg M, Jeuland M, Patel UD, Stanifer JW. CKD of Uncertain Etiology: A Systematic Review. Clinical journal of the American Society of Nephrology : CJASN. 2016;11(3):379-85.
- Valcke M, Levasseur M-E, da Silva AS, Wesseling C. Pesticide exposures and chronic kidney disease of unknown etiology: an epidemiologic review. Environmental Health. 2017;16(1):49.
- Department of Veterans Affairs (VA) and The Department of Defense (DoD). VA/DoD Clinical Practice Guideline for the management of Chronic Kidney Disease in Primary Care. 2014.
- National Institute for Health and Clinical Excellence (Great Britain). Chronic kidney disease: Early identification and management of chronic kidney disease in adults in primary and secondary care. London: NICE. 2015.
- Eriksen B, Ingebretsen O. The progression of chronic kidney disease: a 10-year population-based study of the effects of gender and age. Kidney international. 2006;69(2):375-82.
- Perrone RD, Madias NE, Levey AS. Serum creatinine as an index of renal function: new insights into old concepts. Clinical chemistry. 1992;38(10):1933-53.
- Ferguson TW, Komenda P, Tangri N. Cystatin C as a biomarker for estimating glomerular filtration rate. Current opinion in nephrology and hypertension. 2015;24(3):295-300.
- Levey A. A simplified equation to predict glomerular filtration rate from serum creatinine. J Am Soc Nephrol. 2000;11:A0828.
- Levey AS, Coresh J, Greene T, Marsh J, Stevens LA, Kusek JW, et al. Expressing the Modification of Diet in Renal Disease Study equation for estimating glomerular filtration rate with standardized serum creatinine values. Clinical chemistry. 2007;53(4):766-72.
- Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF, Feldman HI, et al. A new equation to estimate glomerular filtration rate. Annals of internal medicine. 2009;150(9):604-12.
- Veronese FV, Gomes EC, Chanan J, Carraro MA, Camargo EG, Soares AA, et al. Performance of CKD-EPI equation to estimate glomerular filtration rate as compared to MDRD equation in South Brazilian individuals in each stage of renal function. Clinical chemistry and laboratory medicine. 2014;52(12):1747-54.
- Lopes MB, Araújo LQ, Passos MT, Nishida SK, Kirsztajn GM, Cendoroglo MS, et al. Estimation of glomerular filtration rate from serum creatinine and cystatin C in octogenarians and nonagenarians. BMC nephrology. 2013;14(1):265.
- Camargo E, Soares A, Detanico A, Weinert L, Veronese F, Gomes E, et al. The Chronic Kidney Disease Epidemiology Collaboration (CKD‐EPI) equation is less accurate in patients with Type 2 diabetes when compared with healthy individuals. Diabetic medicine. 2011;28(1):90-5.
- David‐Neto E, Triboni AHK, Ramos F, Agena F, Galante NZ, Altona M, et al. Evaluation of MDRD 4, CKD‐EPI, BIS‐1, and modified Cockcroft–Gault equations to estimate glomerular filtration rate in the elderly renal‐transplanted recipients. Clinical transplantation. 2016;30(12):1558-63.
- Silveiro SP, Araújo GN, Ferreira MN, Souza FD, Yamaguchi HM, Camargo EG. Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) equation pronouncedly underestimates glomerular filtration rate in type 2 diabetes. Diabetes care. 2011;34(11):2353-5.
- Arreola-Guerra JM, Rincón-Pedrero R, Cruz-Rivera C, Belmont-Pérez T, Correa-Rotter R, Niño-Cruz JA. Performance of MDRD-IDMS and CKD-EPI equations in Mexican individuals with normal renal function. Nefrología (English Edition). 2014;34(5):591-8.
- Liu WS, Chung YT, Yang CY, Lin CC, Tsai KH, Yang WC, et al. Serum creatinine determined by Jaffe, enzymatic method, and isotope dilution‐liquid chromatography‐mass spectrometry in patients under hemodialysis. Journal of clinical laboratory analysis. 2012;26(3):206-14.
- Cheuiche AV, Soares AA, Camargo EG, Weinert LS, Camargo JL, Silveiro SP. Comparison between IDMS-traceable Jaffe and enzymatic creatinine assays for estimation of glomerular filtration rate by the CKD-EPI equation in healthy and diabetic subjects. Clinical biochemistry. 2013;46(15):1423-9.
- Küme T, Sağlam B, Ergon C, Sisman AR. Evaluation and comparison of Abbott Jaffe and enzymatic creatinine methods: Could the old method meet the new requirements? Journal of clinical laboratory analysis. 2018;32(1):e22168.
- Piéroni L, Bargnoux A-S, Cristol J-P, Cavalier E, Delanaye P. Did creatinine standardization give benefits to the evaluation of glomerular filtration rate? Ejifcc. 2017;28(4):251.
- Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI. Petitorio Nacional de Patología Clínica y Anatomía Patológica. EsSalud. Peru [Available from: http://www.essalud.gob.pe/ietsi/PETITORIO_DE_PATOLOGIA_CLINICA_Y_ANATOMIA_PATOLOGICA/.
- Coresh J, Heerspink HJL, Sang Y, Matsushita K, Arnlov J, Astor BC, et al. Change in albuminuria and subsequent risk of end-stage kidney disease: an individual participant-level consortium meta-analysis of observational studies. The lancet Diabetes & endocrinology. 2019;7(2):115-27.
- Wu H-Y, Huang J-W, Peng Y-S, Hung K-Y, Wu K-D, Lai M-S, et al. Microalbuminuria screening for detecting chronic kidney disease in the general population: a systematic review. Renal failure. 2013;35(5):607-14.
- Wu H-Y, Peng Y-S, Chiang C-K, Huang J-W, Hung K-Y, Wu K-D, et al. Diagnostic performance of random urine samples using albumin concentration vs ratio of albumin to creatinine for microalbuminuria screening in patients with diabetes mellitus: a systematic review and meta-analysis. JAMA internal medicine. 2014;174(7):1108-15.
- Price CP, Newall RG, Boyd JC. Use of protein: creatinine ratio measurements on random urine samples for prediction of significant proteinuria: a systematic review. Clinical chemistry. 2005;51(9):1577-86.
- Medina‐Rosas J, Yap KS, Anderson M, Su J, Touma Z. Utility of Urinary Protein‐Creatinine Ratio and Protein Content in a 24‐Hour Urine Collection in Systemic Lupus Erythematosus: A Systematic Review and Meta‐Analysis. Arthritis care & research. 2016;68(9):1310-9.
- McTaggart MP, Price CP, Pinnock RG, Stevens PE, Newall RG, Lamb EJ. The diagnostic accuracy of a urine albumin-creatinine ratio point-of-care test for detection of albuminuria in primary care. American journal of kidney diseases. 2012;60(5):787-94.
- Pathania M, Rathaur VK, Yadav N, Jayara A, Chaturvedi A. Quantitative Micro-albuminuria Assessment from ‘Random Voided Urinary Albumin: Creatinine Ratio’Versus ‘24 hours Urinary Albumin Concentration’for Screening of Diabetic Nephropathy. Journal of clinical and diagnostic research: JCDR. 2013;7(12):2828.
- Hasanato RM. Diagnostic efficacy of random albumin creatinine ratio for detection of micro and macro-albuminuria in type 2 diabetes mellitus. Saudi medical journal. 2016;37(3):268.
- Carter JL, Tomson CR, Stevens PE, Lamb EJ. Does urinary tract infection cause proteinuria or microalbuminuria? A systematic review. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association. 2006;21(11):3031-7.
- Kitada M, Ogura Y, Monno I, Koya D. A Low-Protein Diet for Diabetic Kidney Disease: Its Effect and Molecular Mechanism, an Approach from Animal Studies. Nutrients. 2018;10(5).
- Hahn D, Hodson EM, Fouque D. Low protein diets for non-diabetic adults with chronic kidney disease. Cochrane Database Syst Rev. 2018;10:CD001892.
- Fouque D, Mitch WE. Low-protein diets in chronic kidney disease: are we finally reaching a consensus? Nephrology Dialysis Transplantation. 2015;30(1):6-8.
- Shah BV, Patel ZM. Role of low protein diet in management of different stages of chronic kidney disease – practical aspects. BMC nephrology. 2016;17(1):156.
- Yan B, Su X, Xu B, Qiao X, Wang L. Effect of diet protein restriction on progression of chronic kidney disease: A systematic review and meta-analysis. PLoS One. 2018;13(11):e0206134.
- Rhee CM, Ahmadi SF, Kovesdy CP, Kalantar-Zadeh K. Low-protein diet for conservative management of chronic kidney disease: a systematic review and meta-analysis of controlled trials. J Cachexia Sarcopenia Muscle. 2018;9(2):235-45.
- Cheryl A HA. Nutrition education in the care of patients with chronic kidney disease and end-stage renal disease. Seminars in Dialysis. 2018;1(7).
- Mafra D LV. A practical approach to a low protein diet in Brazil. BMC nephrology. 2016;17(105).
- Kovesdy C KJ, Kalantar K. Management of protein-energy wasting in non-dialysis-dependent chronic kidney disease: reconciling low protein intake with nutritional therapy. The American Journal of Clinical Nutrition. 2013;90(6):1163–77.
- Huang M-C, Chen M-E, Hung H-C, Chen H-C, Chang W-T, Lee C-H, et al. Inadequate energy and excess protein intakes may be associated with worsening renal function in chronic kidney disease. Journal of Renal Nutrition. 2008;18(2):187-94.
- Kamper AL, Strandgaard S. Long-Term Effects of High-Protein Diets on Renal Function. Annual review of nutrition. 2017;37:347-69.
- Organization WH, University UN. Protein and amino acid requirements in human nutrition: World Health Organization; 2007.
- Garofalo C, Borrelli S, Provenzano M, De Stefano T, Vita C, Chiodini P, et al. Dietary Salt Restriction in Chronic Kidney Disease: A Meta-Analysis of Randomized Clinical Trials. Nutrients. 2018;10(6).
- Grupo de trabajo de la Guía de Práctica Clínica sobre la Detección y el Manejo de la Enfermedad Renal Crónica. Guía de Práctica Clínica sobre la Detección y el Manejo de la Enfermedad Renal Crónica. Ministerio de Sanidad, Servicios Sociales e Igualdad. Instituto Aragonés de Ciencias de la Salud; 2016. Guías de Práctica Clínica en el SNS.
- Rughooputh MS, Zeng R, Yao Y. Protein Diet Restriction Slows Chronic Kidney Disease Progression in Non-Diabetic and in Type 1 Diabetic Patients, but Not in Type 2 Diabetic Patients: A Meta-Analysis of Randomized Controlled Trials Using Glomerular Filtration Rate as a Surrogate. PLoS One. 2015;10(12):e0145505.
- Zhu HG, Jiang ZS, Gong PY, Zhang DM, Zou ZW, Qian Z, et al. Efficacy of low-protein diet for diabetic nephropathy: a systematic review of randomized controlled trials. Lipids Health Dis. 2018;17(1):141.
- Kalaitzidis RG, Elisaf MS. Treatment of hypertension in chronic kidney disease. Current hypertension reports. 2018;20(8):64.
- Henry TY. Progression of chronic renal failure. Archives of internal medicine. 2003;163(12):1417-29.
- Sharma P, Blackburn RC, Parke CL, McCullough K, Marks A, Black C. Angiotensin‐converting enzyme inhibitors and angiotensin receptor blockers for adults with early (stage 1 to 3) non‐diabetic chronic kidney disease. Cochrane Database of Systematic Reviews. 2011(10).
- Fink HA, Ishani A, Taylor BC, Greer NL, MacDonald R, Rossini D, et al. Screening for, monitoring, and treatment of chronic kidney disease stages 1 to 3: a systematic review for the US Preventive Services Task Force and for an American College of Physicians Clinical Practice Guideline. Annals of internal medicine. 2012;156(8):570-81.
- Geng D-f, Sun W-f, Yang L, En G, Wang J-f. Antiproteinuric effect of angiotensin receptor blockers in normotensive patients with proteinuria: A meta-analysis of randomized controlled trials. Journal of the Renin-Angiotensin-Aldosterone System. 2014;15(1):44-51.
- Wang K, Hu J, Luo T, Wang Y, Yang S, Qing H, et al. Effects of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers on all-cause mortality and renal outcomes in patients with diabetes and albuminuria: a systematic review and meta-analysis. Kidney and Blood Pressure Research. 2018;43(3):768-79.
- Mishima E, Haruna Y, Arima H. Renin-angiotensin system inhibitors in hypertensive adults with non-diabetic CKD with or without proteinuria: a systematic review and meta-analysis of randomized trials. Hypertension Research. 2019;42(4):469-82.
- Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). European heart journal. 2020;41(1):111-88.
- Wong MG, Perkovic V. Knowing what we do not know: statin therapy in advanced chronic kidney disease. The lancet Diabetes & endocrinology. 2016;4(10):801-3.
- Douglas K, O’Malley PG, Jackson JL. Meta-analysis: the effect of statins on albuminuria. Annals of internal medicine. 2006;145(2):117-24.
- Sandhu S, Wiebe N, Fried LF, Tonelli M. Statins for improving renal outcomes: a meta-analysis. Journal of the American Society of Nephrology. 2006;17(7).
- Herrington W, Emberson J, Mihaylova B, Blackwell L, Reith C, Haynes R, et al. Impact of renal function on the effects of LDL cholesterol lowering with statin-based regimens: a meta-analysis of individual participant data from 28 randomised trials. Lancet Diabetes and Endocrinology. 2016;4(10).
- Su X, Zhang L, Lv J, Wang J, Hou W, Xie X, et al. Effect of statins on kidney disease outcomes: a systematic review and meta-analysis. American Journal of Kidney Diseases. 2016;67(6):881-92.
- Zhang Z, Wu P, Zhang J, Wang S, Zhang G. The effect of statins on microalbuminuria, proteinuria, progression of kidney function, and all-cause mortality in patients with non-end stage chronic kidney disease: A meta-analysis. Pharmacological research. 2016;105:74-83.
- Qin X, Dong H, Fang K, Lu F. The effect of statins on renal outcomes in patients with diabetic kidney disease: A systematic review and meta-analysis. Diabetes/metabolism research and reviews. 2017;33(6).
- He Y, Li X, Gasevic D, Brunt E, McLachlan F, Millenson M, et al. Statins and Multiple Noncardiovascular Outcomes: Umbrella Review of Meta-analyses of Observational Studies and Randomized Controlled Trials. Ann Intern Med. 2018;169(8):543-53.
- National CGCU. Lipid modification: cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease. 2014.
- Webster AC, Nagler EV, Morton RL, Masson P. Chronic Kidney Disease. Lancet (London, England). 2017;389(10075):1238-52.
- Caravaca-Fontan F, Azevedo L, Luna E, Caravaca F. Patterns of progression of chronic kidney disease at later stages. Clin Kidney J. 2018;11(2):246-53.
- Abeysekera RA, Healy HG, Wang Z, Cameron AL, Hoy WE. Heterogeneity in patterns of progression of chronic kidney disease. Internal medicine journal. 2020.
- Naimark DM, Grams ME, Matsushita K, Black C, Drion I, Fox CS, et al. Past Decline Versus Current eGFR and Subsequent Mortality Risk. J Am Soc Nephrol. 2016;27(8):2456-66.
- Kovesdy CP, Coresh J, Ballew SH, Woodward M, Levin A, Naimark DM, et al. Past Decline Versus Current eGFR and Subsequent ESRD Risk. J Am Soc Nephrol. 2016;27(8):2447-55.
- Badve SV, Palmer SC, Hawley CM, Pascoe EM, Strippoli GF, Johnson DW. Glomerular filtration rate decline as a surrogate end point in kidney disease progression trials. Nephrology Dialysis Transplantation. 2016;31(9):1425-36.
- Heerspink HJL, Greene T, Tighiouart H, Gansevoort RT, Coresh J, Simon AL, et al. Change in albuminuria as a surrogate endpoint for progression of kidney disease: a meta-analysis of treatment effects in randomised clinical trials. The lancet Diabetes & endocrinology. 2019;7(2):128-39.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. Cochrane Database Syst Rev. 2014(6):Cd007333.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


