DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: adultos con cáncer de colon.
- Usuarios: Esta GPC está dirigida al personal médico y no médico, que participa en la atención multidisciplinaria del paciente con cáncer de colon. Las recomendaciones serán aplicadas por médicos generales, oncólogos, cirujano oncólogo, internistas, médicos residentes de las diversas especialidades, médicos gestores y personal técnico. Asimismo, podrá ser utilizada como referencia por estudiantes de profesiones relacionadas al ámbito de la salud y pacientes.
Autores
Grupo elaborador
Expertos clínicos:
- Yan Quiroz, Edgar Fermin.
Cirujano oncólogo
Hospital de Alta Complejidad “Virgen de la Puerta”, EsSalud, Trujillo, Perú - Gonzales Gonzales, Carol Marianella.
Médico oncóloga
Hospital Victor Lazarte Echegaray, EsSalud, Trujillo, Perú - Marcial Carranza, Erika.
Médico oncóloga
Hospital Nacional Alberto Sabogal Sologuren, EsSalud, Lima, Perú - López Cutipa, Ever Frank.
Cirujano oncólogo
Hospital Nacional Guillermo Almenara Irigoren, EsSalud, Lima, Perú - Mendoza Romero, Manoel Antonio.
Cirujano general
Hospital Nacional Ramiro Priale Priale, EsSalud, Huancayo, Perú - Espiritu Flores, Miguel Jefferson.
Médico oncólogo
Hospital Nacional Ramiro Priale Priale, EsSalud, Huancayo, Perú
Metodólogos:
- Delgado Flores, Carolina Jaqueline.
Metodóloga
IETSI, EsSalud, Lima, Perú - Montes Alvis, José Manuel.
Metodólogo
IETSI, EsSalud, Lima, Perú - Chavez Rimache, Lesly Karem.
Metodóloga
IETSI, EsSalud, Lima, Perú
Gestores:
- Zeta Ruiz, Nieves del Milagro.
Selección de recomendaciones trazadoras
IETSI, EsSalud, Lima, Perú - Salvador Salvador, Stefany.
Coordinadora del grupo elaborador
IETSI, EsSalud, Lima, Perú - Santos Sánchez, Vladimir.
Coordinador del grupo elaborador
IETSI, EsSalud, Lima, Perú
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
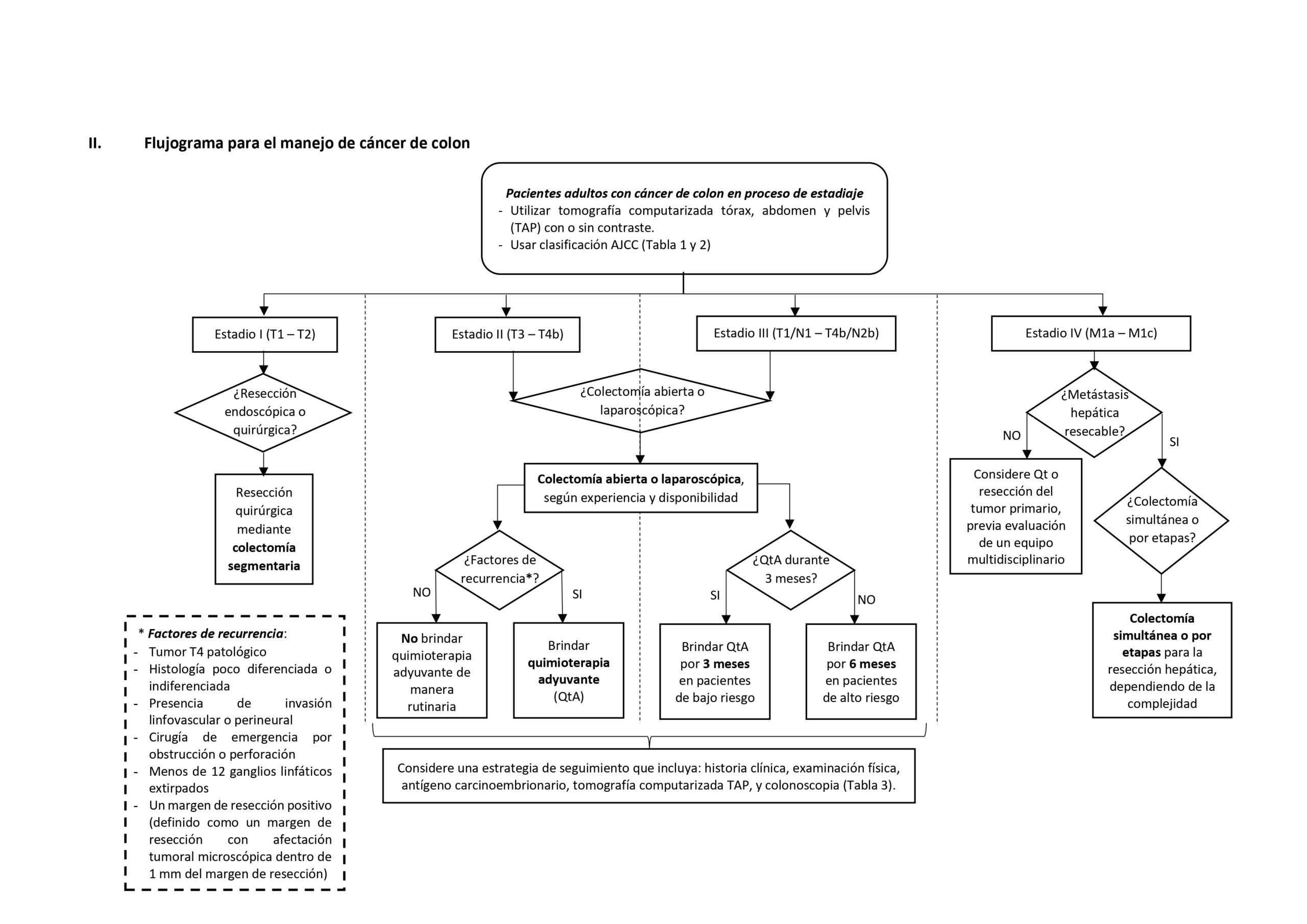
vacio
vacio
1. TC vs PET/TC
Descargar PDF con el desarrollo de la pregunta.
BPC 1: En pacientes adultos con cáncer de colon, que se encuentran en proceso de estadiaje inicial, considere utilizar la TC de tórax, abdomen y pelvis (con o sin contraste) para definir el estadiaje, en lugar de usar PET/TC.
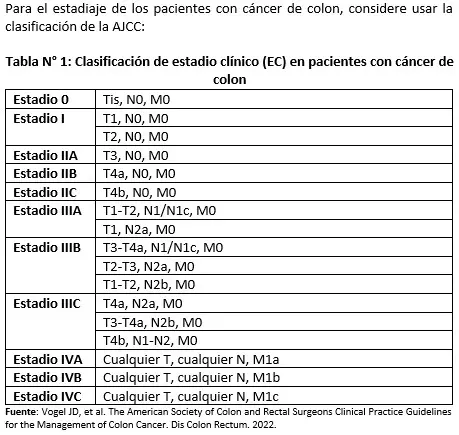
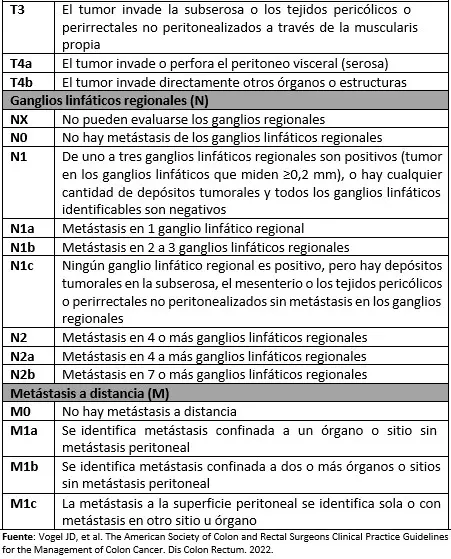
BPC 2: Para el estadiaje de los pacientes con cáncer de colon, considere usar la clasificación de la AJCC:

2. Resección endoscópica vs Resección quirúrgica
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos con cáncer de colon en EC I, sugerimos realizar resección quirúrgica en lugar de la endoscópica.
(Recomendación condicional a favor del control, certeza muy baja de la evidencia)
3. Cirugía mínimamente invasiva vs Cirugía abierta
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos con cáncer de colon EC I-III, sugerimos realizar colectomía segmentaria mediante cirugía laparoscópica o cirugía abierta, según la experiencia de los especialistas y disponibilidad de recursos.
(Recomendación condicional a favor de la intervención o del control, Certeza de la evidencia: Muy baja)
4. Quimioterapia adyuvante
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos con cáncer de colon EC II resecado y sin factores de riesgo de recurrencia, sugerimos no brindar quimioterapia adyuvante de manera rutinaria.
Recomendacióncondicional en contra de la intervención Certeza evidencia: Muy baja
Recomendación 2:
En pacientes adultos con cáncer de colon EC II resecado y con al menos un factor de riesgo de recurrencia, sugerimos brindar quimioterapia adyuvante.
(Recomendación condicional a favor de la intervención, Certeza de la evidencia: Muy baja)
BPC 1:
Considere a los pacientes adultos con un alto riesgo de recurrencia de la enfermedad, si presenta al menos uno de los siguientes criterios:
– Tumor T4 patológico,
– Histología poco diferenciada o indiferenciada,
– Presencia de invasión linfovascular o perineural,
– Cirugía de emergencia por obstrucción o perforación,
– Menos de 12 ganglios linfáticos extirpados,
– Un margen de resección positivo (definido como un margen de resección con afectación tumoral microscópica dentro de 1 mm del
margen de resección).
5. Quimioterapia adyuvante 3 meses vs 6 meses
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos con cáncer de colon resecado en EC III de bajo riesgo,
sugerimos brindar quimioterapia adyuvante por 3 meses en lugar de 6 meses.
Recomendación condicional a favor de la intervención Certeza evidencia: Muy baja
BPC 1:
En adultos con cáncer de colon resecado en EC III, la consideración de extender la duración de la quimioterapia a 6 meses requiere una evaluación minuciosa de las siguientes características:
– Tumor del paciente,
– Integridad de la resección quirúrgica,
– Número de ganglios linfáticos examinados,
– Comorbilidades y estado funcional.
– Estado de desempeño,
– Valores y preferencias,
– Edad en el momento del diagnóstico,
– Esperanza de vida,
– Años potenciales en riesgo de secuelas a largo plazo del tratamiento.
6. Quimioterapia vs Resección quirúrgica
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
Los pacientes adultos con enfermedad metastásica irresecable de cáncer de colon deben ser evaluados en una reunión del equipo multidisciplinario con la experiencia quirúrgica adecuada antes de someterse a cualquier tratamiento (excepto en caso de una emergencia quirúrgica). Esta evaluación se debe basar en los síntomas del tumor primario y el impacto de las alternativas terapéuticas en el pronóstico del paciente.
BPC 2:
Idealmente, la elección del tratamiento debe ser realizada por un equipo multidisciplinario de cirujanos, médicos oncólogos, patólogos, oncólogos radioterápicos, radiólogos, gastroenterólogos y médico paliativista luego de la discusión del caso.
Se debe realizar un enfoque de toma de decisiones compartida con el paciente y familiares.
7. Stent colónico vs Cirugía de emergencia
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos con cáncer de colon y obstrucción colónica izquierda aguda, sugerimos brindar cirugía de emergencia o colocar stent colónico.
(Recomendación condicional a favor de la intervención o del control, certeza muy baja de la evidencia)
BPC 1:
En pacientes adultos con cáncer de colon y obstrucción colónica izquierda, considerar las características del paciente (edad avanzada, estado funcional, medio interno, presencia de comorbilidades), así como la disponibilidad de recursos y experiencia de los especialistas para la elección del tratamiento.
8. Colectomía simultánea vs Colectomía por etapas con resección hepática y/o pulmonar
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes adultos con metástasis hepáticas resecables de cáncer de colon, sugerimos realizar colectomía simultánea o colectomía por etapas para la resección hepática; dependiendo de la complejidad de la hepatectomía o colectomía, enfermedades comórbidas, estado funcional
del paciente, exposición quirúrgica y experiencia del equipo de cirugía.
(Recomendación condicional a favor de la intervención o del control, certeza muy baja de la evidencia.)
BPC 1:
Considere brindar colectomía simultánea en los siguientes casos:
– El paciente pueda recibir cuatro a seis ciclos de quimioterapia neoadyuvante seguido de cirugía simultánea,
– En el caso de enfermedad hepática limitada y un tumor primario resecable, o
– En caso sea accesible la cirugía del tumor primario y la metástasis hepática al mismo tiempo.
BPC 2:
El tratamiento de pacientes adultos con cáncer de colon resecable en EC IV debe ser individualizado y basado en una discusión multidisciplinaria integral.
BPC 3:
Brindar un adecuado soporte posoperatorio especializado, ya sea en cuidados intensivos o intermedios, después de la cirugía para cáncer de colon y hepatectomía.
9. Colonoscopia vs TC contrastada
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
Considere la siguiente estrategia de seguimiento en los pacientes adultos con cáncer de colon no metastásico, y con quimioterapia adyuvante:
Referencias bibliográficas
1. DeVita VT. DeVita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology. LWW; 2014. 2234 p.
2. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249.
3. Zafra-Tanaka JH, Tenorio-Mucha J, Villarreal-Zegarra D, Carrillo-Larco R, Bernabe-Ortiz
A. Cancer-related mortality in Peru: Trends from 2003 to 2016. PLoS One. 2020 Feb 6;15(2):e0228867.
4. Lewandowska A, Rudzki G, Lewandowski T, Stryjkowska-Góra A, Rudzki S. Risk Factors for the Diagnosis of Colorectal Cancer. Cancer Control. 2022 Jan- Dec;29:10732748211056692.
5. Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
6. Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
7. Baxter NN, Kennedy EB, Bergsland E, Berlin J, George TJ, Gill S, Gold PJ, Hantel A, Jones L, Lieu C, Mahmoud N, Morris AM, Ruiz-Garcia E, You YN, Meyerhardt JA. Adjuvant Therapy for Stage II Colon Cancer: ASCO Guideline Update. J Clin Oncol. 2022 Mar 10;40(8):892-910.
8. National Institute for Health and Care Excellence (NICE). NICE guideline [NG151] Colorectal cancer. Last updated: 15 December 2021. Disponible en: https://www.nice.org.uk/guidance/ng151.
9. Chiorean EG, Nandakumar G, Fadelu T, Temin S, Alarcon-Rozas AE, Bejarano S, Croitoru AE, Grover S, Lohar PV, Odhiambo A, Park SH, Garcia ER, Teh C, Rose A, Zaki B, Chamberlin MD. Treatment of Patients With Late-Stage Colorectal Cancer: ASCO Resource-Stratified Guideline. JCO Glob Oncol. 2020 Mar;6:414-438.
10. National Clinical Effectiveness Committee. National Cancer Control Programme. Diagnosis, staging and treatment of patients with colon cancer; 2020 [citado el 01 de junio del 2023]. Disponible en: https://www.hse.ie/eng/services/list/5/cancer/profinfo/guidelines/diagnosis-
staging-and-treatment-of-patients-with-colon-cancer.pdf.
11. Lieu C, Kennedy EB, Bergsland E, Berlin J, George TJ, Gill S, Gold PJ, Hantel A, Jones L, Mahmoud N, Meyerhardt J, Morris AM, Ruíz-García E, You YN, Baxter N. Duration of Oxaliplatin-Containing Adjuvant Therapy for Stage III Colon Cancer: ASCO Clinical Practice Guideline. J Clin Oncol. 2019 Jun 1;37(16):1436-1447.
12. Ministerio de Salud. Guía de práctica clínica Cáncer Colorectal en personas de 15 años y más. Santiago: MINSAL; 2019. Disponible en: https://diprece.minsal.cl/garantias- explicitas-en-salud-auge-o-ges/guias-de-practica-clinica/cancer-colorectal-en- personas-de-15-anos-y-mas/recomendaciones/.
13. Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ (Clinical research ed).2017;358:j4008.
14. Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ (Clinical research ed). 2011;343:d5928.
15. Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The NewcastleOttawa Scale (NOS) for assessing the quality of nonrandomised studies in metaanalyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
16. Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
17. Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
18. Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ (Clinical research ed). 2016;353:i2016.
19. Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ (Clinical research ed). 2016;353:i2089.
20. Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719- 25.
21. Brush J, Boyd K, Chappell F, Crawford F, Dozier M, Fenwick E, Glanville J, McIntosh H, Renehan A, Weller D, Dunlop M. The value of FDG positron emission tomography/computerised tomography (PET/CT) in pre-operative staging of colorectal cancer: a systematic review and economic evaluation. Health Technol Assess. 2011 Sep;15(35):1-192, iii-iv.
22. Engelmann BE, Loft A, Kjær A, Nielsen HJ, Berthelsen AK, Binderup T, Brinch K, Brünner N, Gerds TA, Høyer-Hansen G, Kristensen MH, Kurt EY, Latocha JE, Lindblom G, Sloth C, Højgaard L. Positron emission tomography/computed tomography for optimized colon cancer staging and follow up. Scand J Gastroenterol. 2014 Feb;49(2):191-201.
23. Argilés G, Tabernero J, Labianca R, Hochhauser D, Salazar R, Iveson T, et al. Electronic address: clinicalguidelines@esmo.org. Localised colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020 Oct;31(10):1291- 1305. doi: https://www.doi.org/10.1016/j.annonc.2020.06.022. Epub 2020 Jul 20.
24. Vogel JD, Felder SI, Bhama AR, Hawkins AT, Langenfeld SJ, Shaffer VO, et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Management of Colon Cancer. Diseases of the Colon & Rectum. 2022;65(2):148-77. doi: https://www.doi.org/10.1097/DCR.0000000000002323.
25. Yeh JH, Tseng CH, Huang RY, Lin CW, Lee CT, Hsiao PJ, Wu TC, Kuo LT, Wang WL. Long- term Outcomes of Primary Endoscopic Resection vs Surgery for T1 Colorectal Cancer: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2020 Nov;18(12):2813-2823.e5.
26. Silva GL, de Moura EG, Bernardo WM, Leite de Castro V, Morais C, Baba ER, Safatle- Ribeiro AV. Endoscopic versus surgical resection for early colorectal cancer-a systematic review and meta-analysis. J Gastrointest Oncol. 2016 Jun;7(3):326-35.
27. Li F, Wang B, Zhou X, Fu W. Comparison between different approaches applied in the management of early colorectal cancer: A Bayesian network meta-analysis. Asian J Surg. 2021 Dec;44(12):1539-1540.
28. Arthursson V, Rosén R, Norlin JM, Gralen K, Toth E, Syk I, Thorlacius H, Rönnow CF. Cost comparisons of endoscopic and surgical resection of stage T1 rectal cancer. Endosc Int Open. 2021 Sep 16;9(10):E1512-E1519.
29. Noh SM, Hwang SW, Park SH, Yang DH, Ye BD, Park IJ, Lim SB, Byeon JS. Comparative Cost Analysis Between Endoscopic Resection and Surgery for Submucosal Colorectal Cancer. Dis Colon Rectum. 2021 Dec 27.
30. Kuhry E, Schwenk W, Gaupset R, Romild U, Bonjer J. Long-term outcome of laparoscopic surgery for colorectal cancer: a cochrane systematic review of randomised controlled trials. Cancer Treat Rev. 2008 Oct;34(6):498-504.
31. Lilley R, Chan E, Ng N, Orr A, Szostok M, Yeh GTT, Tulloch R, Ramsay G, Mokini Z, Forget
P. Recurrence Kinetics after Laparoscopic Versus Open Surgery in Colon Cancer. A Meta-Analysis. J Clin Med. 2021 Sep 15;10(18):4163.
32. Anania G, Arezzo A, Davies RJ, Marchetti F, Zhang S, Di Saverio S, Cirocchi R, Donini A. A global systematic review and meta-analysis on laparoscopic vs open right hemicolectomy with complete mesocolic excision. Int J Colorectal Dis. 2021 Aug;36(8):1609-1620.
33. Lorenzon L, La Torre M, Ziparo V, Montebelli F, Mercantini P, Balducci G, Ferri M. Evidence based medicine and surgical approaches for colon cancer: evidences, benefits and limitations of the laparoscopic vs open resection. World J Gastroenterol. 2014 Apr 7;20(13):3680-92.
34. Theophilus M, Platell C, Spilsbury K. Long-term survival following laparoscopic and open colectomy for colon cancer: a meta-analysis of randomized controlled trials. Colorectal Dis. 2014 Mar;16(3):O75-81.
35. Di B, Li Y, Wei K, Xiao X, Shi J, Zhang Y, Yang X, Gao P, Zhang K, Yuan Y, Zhang D, Wei X, Liu S, Wang J, Wang X, Zhang Y, Cai H. Laparoscopic versus open surgery for colon cancer: a meta-analysis of 5-year follow-up outcomes. Surg Oncol. 2013 Sep;22(3):e39- 43.
36. Ohtani H, Tamamori Y, Arimoto Y, Nishiguchi Y, Maeda K, Hirakawa K. A meta-analysis of the short- and long-term results of randomized controlled trials that compared laparoscopy-assisted and open colectomy for colon cancer. J Cancer. 2012;3:49-57.
37. Ma Y, Yang Z, Qin H, Wang Y. A meta-analysis of laparoscopy compared with open colorectal resection for colorectal cancer. Med Oncol. 2011 Dec;28(4):925-33.
38. Bai HL, Chen B, Zhou Y, Wu XT. Five-year long-term outcomes of laparoscopic surgery for colon cancer. World J Gastroenterol. 2010 Oct 21;16(39):4992-7.
39. Bonjer HJ, Hop WC, Nelson H, Sargent DJ, Lacy AM, Castells A, Guillou PJ, Thorpe H, Brown J, Delgado S, Kuhrij E, Haglind E, Påhlman L; Transatlantic Laparoscopically Assisted vs Open Colectomy Trials Study Group. Laparoscopically assisted vs open colectomy for colon cancer: a meta-analysis. Arch Surg. 2007 Mar;142(3):298-303.
40. Toritani K, Watanabe J, Nakagawa K, Suwa Y, Suwa H, Ishibe A, Ota M, Fujii S, Kunisaki C, Endo I. Randomized controlled trial to evaluate laparoscopic versus open surgery in transverse and descending colon cancer patients. Int J Colorectal Dis. 2019 Jul;34(7):1211-1220. .
41. Li JC, Leung KL, Ng SS, Liu SY, Lee JF, Hon SS. Laparoscopic-assisted versus open resection of right-sided colonic cancer–a prospective randomized controlled trial. Int J Colorectal Dis. 2012 Jan;27(1):95-102.
42. Vlug MS, Wind J, Hollmann MW, Ubbink DT, Cense HA, Engel AF, Gerhards MF, van Wagensveld BA, van der Zaag ES, van Geloven AA, Sprangers MA, Cuesta MA, Bemelman WA; LAFA study group. Laparoscopy in combination with fast track multimodal management is the best perioperative strategy in patients undergoing colonic surgery: a randomized clinical trial (LAFA-study). Ann Surg. 2011 Dec;254(6):868-75.
43. Schietroma M, Pessia B, Carlei F, Cecilia EM, Amicucci G. Gut barrier function and systemic endotoxemia after laparotomy or laparoscopic resection for colon cancer: A prospective randomized study. J Minim Access Surg. 2016 Jul-Sep;12(3):254-9.
44. Fujii S, Ishibe A, Ota M, Yamagishi S, Watanabe K, Watanabe J, Kanazawa A, Ichikawa Y, Oba M, Morita S, Hashiguchi Y, Kunisaki C, Endo I. Short-term results of a randomized study between laparoscopic and open surgery in elderly colorectal cancer patients. Surg Endosc. 2014 Feb;28(2):466-76.
45. Sheng QS, Lin JJ, Chen WB, Liu FL, Xu XM, Lin CZ, Wang JH, Li YD. Hand-assisted laparoscopic versus open right hemicolectomy: short-term outcomes in a single institution from China. Surg Laparosc Endosc Percutan Tech. 2012 Jun;22(3):267-71. .
46. Kennedy RH, Francis EA, Wharton R, Blazeby JM, Quirke P, West NP, Dutton SJ. Multicenter randomized controlled trial of conventional versus laparoscopic surgery for colorectal cancer within an enhanced recovery programme: EnROL. J Clin Oncol. 2014 Jun 10;32(17):1804-11.
47. Yamamoto S, Inomata M, Katayama H, Mizusawa J, Etoh T, Konishi F, Sugihara K, Watanabe M, Moriya Y, Kitano S; Japan Clinical Oncology Group Colorectal Cancer Study Group. Short-term surgical outcomes from a randomized controlled trial to evaluate laparoscopic and open D3 dissection for stage II/III colon cancer: Japan Clinical Oncology Group Study JCOG 0404. Ann Surg. 2014 Jul;260(1):23-30. .
48. Deijen CL, Vasmel JE, de Lange-de Klerk ESM, Cuesta MA, Coene PLO, Lange JF, Meijerink WJHJ, Jakimowicz JJ, Jeekel J, Kazemier G, Janssen IMC, Påhlman L, Haglind E, Bonjer HJ; COLOR (COlon cancer Laparoscopic or Open Resection) study group. Ten- year outcomes of a randomised trial of laparoscopic versus open surgery for colon cancer. Surg Endosc. 2017 Jun;31(6):2607-2615.
49. Sajid MS, Rathore MA, Baig MK, Sains P. A critical appraisal of the cost effectiveness of laparoscopic colorectal surgery for oncological and non-oncological resections. Updates Surg. 2017 Sep;69(3):339-344.
50. Simillis C, Singh HKSI, Afxentiou T, Mills S, Warren OJ, Smith JJ, Riddle P, Adamina M, Cunningham D, Tekkis PP. Postoperative chemotherapy improves survival in patients with resected high-risk Stage II colorectal cancer: results of a systematic review and meta-analysis. Colorectal Dis. 2020 Oct;22(10):1231-1244.
51. Zhang C, Yin S, Tan Y, Huang J, Wang P, Hou W, Zhang Z, Xu H. Patient Selection for Adjuvant Chemotherapy in High-Risk Stage II Colon Cancer: A Systematic Review and Meta-Analysis. Am J Clin Oncol. 2020 Apr;43(4):279-287.
52. Agencia Española de Medicamentos y Productos Sanitarios. Oxaliplatino Kabi 5 mg/ml concentrado para solución para perfusión EFG. Accedido en: 02 de octubre de 2023. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/71346/71346_ft.pdf
53. André T, Meyerhardt J, Iveson T, Sobrero A, Yoshino T, Souglakos I, et al. Effect of duration of adjuvant chemotherapy for patients with stage III colon cancer (IDEA collaboration): final results from a prospective, pooled analysis of six randomised, phase 3 trials. Lancet Oncol. 2020 Dec;21(12):1620-1629. doi: https://www.doi.org/10.1016/S1470-2045(20)30527-1.
54. Taieb J, Gallois C. Adjuvant Chemotherapy for Stage III Colon Cancer. Cancers. 2020; 12(9):2679. .
55. Des Guetz G, Uzzan B, Morere JF, Perret G, Nicolas P. Duration of adjuvant chemotherapy for patients with non-metastatic colorectal cancer. Cochrane Database Syst Rev. 2010 Jan 20;(1):CD007046.
56. Benson AB, Venook AP, Al-Hawary MM, Arain MA, Chen YJ, Ciombor KK, et al. Colon Cancer, Version 4.2023, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2023 Nov 16. Disponible en: https://www.nccn.org/professionals/physician_gls/pdf/colon.pdf.
57. Clancy C, Burke JP, Barry M, Kalady MF, Calvin Coffey J. A meta-analysis to determine the effect of primary tumor resection for stage IV colorectal cancer with unresectable metastases on patient survival. Ann Surg Oncol. 2014 Nov;21(12):3900-8.
58. Stillwell AP, Buettner PG, Ho YH. Meta-analysis of survival of patients with stage IV colorectal cancer managed with surgical resection versus chemotherapy alone. World J Surg. 2010 Apr;34(4):797-807.
59. Liang Z, Liu Z, Huang C, Chen X, Zhang Z, Xiang M, Hu W, Wang J, Feng X, Yao X. The role of upfront primary tumor resection in asymptomatic patients with unresectable stage IV colorectal cancer: A systematic review and meta-analysis. Front Surg. 2023 Jan 6;9:1047373.
60. Hashiguchi Y, Muro K, Saito Y, Ito Y, Ajioka Y, Hamaguchi T, Hasegawa K, Hotta K, Ishida H, Ishiguro M, Ishihara S, Kanemitsu Y, Kinugasa Y, Murofushi K, Nakajima TE, Oka S, Tanaka T, Taniguchi H, Tsuji A, Uehara K, Ueno H, Yamanaka T, Yamazaki K, Yoshida M, Yoshino T, Itabashi M, Sakamaki K, Sano K, Shimada Y, Tanaka S, Uetake H, Yamaguchi S, Yamaguchi N, Kobayashi H, Matsuda K, Kotake K, Sugihara K; Japanese Society for Cancer of the Colon and Rectum. Japanese Society for Cancer of the Colon and Rectum (JSCCR) guidelines 2019 for the treatment of colorectal cancer. Int J Clin Oncol. 2020 Jan;25(1):1-42.
61. Suzuki H, Tsujinaka S, Sato Y, Miura T, Shibata C. Oncologic impact of colonic stents for obstructive left-sided colon cancer. World J Clin Oncol. 2023 Jan 24;14(1):1-12. .
62. Binetti M, Lauro A, Tonini V. Colonic stent for bridge to surgery for acute left-sided malignant colonic obstruction: A review of the literature after 2020. World J Clin Oncol. 2022 Dec 24;13(12):957-966. doi: https://www.doi.org/10.5306/wjco.v13.i12.957.
63. Cirocchi R, Arezzo A, Sapienza P, Crocetti D, Cavaliere D, Solaini L, Ercolani G, Sterpetti AV, Mingoli A, Fiori E. Current Status of the Self-Expandable Metal Stent as a Bridge to Surgery Versus Emergency Surgery in Colorectal Cancer: Results from an Updated Systematic Review and Meta-Analysis of the Literature. Medicina (Kaunas). 2021 Mar 15;57(3):268.
64. Gavriilidis P, de’Angelis N, Wheeler J, Askari A, Di Saverio S, Davies JR. Diversion, resection, or stenting as a bridge to surgery for acute neoplastic left-sided colonic obstruction: a systematic review and network meta-analysis of studies with curative intent. Ann R Coll Surg Engl. 2021 Apr;103(4):235-244. doi: https://www.doi.org/10.1308/rcsann.2020.7137. .
65. Spannenburg L, Sanchez Gonzalez M, Brooks A, Wei S, Li X, Liang X, Gao W, Wang H. Surgical outcomes of colonic stents as a bridge to surgery versus emergency surgery for malignant colorectal obstruction: A systematic review and meta-analysis of high quality prospective and randomised controlled trials. Eur J Surg Oncol. 2020 Aug;46(8):1404-1414.
66. CReST Collaborative Group. Colorectal Endoscopic Stenting Trial (CReST) for obstructing left-sided colorectal cancer: randomized clinical trial. Br J Surg. 2022 Oct 14;109(11):1073-1080. doi: https://www.doi.org/10.1093/bjs/znac141.
67. van Hooft JE, Veld JV, Arnold D, Beets-Tan RGH, Everett S, Götz M, et al. Self- expandable metal stents for obstructing colonic and extracolonic cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – Update 2020. Endoscopy. 2020 May;52(5):389-407. doi: https://www.doi.org/10.1055/a-1140-3017. Epub 2020 Apr 7.
68. Leporrier J, Maurel J, Chiche L, Bara S, Segol P, Launoy G (2006) A population-based study of the incidence, management and prog- nosis of hepatic metastases from colorectal cancer. Br J Surg 93: 465–474.
69. Hajibandeh S, Hajibandeh S, Sultana A, Ferris G, Mwendwa J, Mohamedahmed AYY, Zaman S, Peravali R. Simultaneous versus staged colorectal and hepatic resections for colorectal cancer with synchronous hepatic metastases: a meta-analysis of outcomes and clinical characteristics. Int J Colorectal Dis. 2020 Sep;35(9):1629-1650.
70. Gavriilidis P, Sutcliffe RP, Hodson J, Marudanayagam R, Isaac J, Azoulay D, Roberts KJ. Simultaneous versus delayed hepatectomy for synchronous colorectal liver metastases: a systematic review and meta-analysis. HPB (Oxford). 2018 Jan;20(1):11- 19.
71. Slesser AA, Simillis C, Goldin R, Brown G, Mudan S, Tekkis PP. A meta-analysis comparing simultaneous versus delayed resections in patients with synchronous colorectal liver metastases. Surg Oncol. 2013 Mar;22(1):36-47.
72. Baca B, Beart RW, Etzioni DA. Surveillance after colorectal cancer resection: a systematic review. Dis Colon Rectum 2011 Aug;54(8):1036-1048.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


