DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
VERSIÓN CORTA
DESCARGAR
FLUJOGRAMA
vacio
vacio
Ámbito
- La presente guía de práctica clínica tiene como ámbito de aplicación los establecimientos de salud de las Redes Integradas de Salud (RIS), las Direcciones Regionales de Salud y las Gerencias Regionales de Salud o aquellas que cumplan funciones equivalentes a nivel regional. Asimismo, servirá como referente para los demás establecimientos de salud del Seguro Social de Salud (EsSalud), las Instituciones Armadas, la Policía Nacional del Perú, los establecimientos de salud privados y otros prestadores de servicios de salud en todo el país.
Población y alcance
- Población: Mujeres de 40 a 69 años que acuden a los establecimientos de salud en el primer nivel de atención.
- Usuarios: La guía está dirigida a todo el personal de salud que tenga a su cargo la atención integral de la prevención y diagnóstico de cáncer de mama: médicos generales, oncólogos médicos, cirujanos oncólogos, gineco-obstetras, internistas, médicos de familia, obstetras, nutricionistas, enfermeros, psicólogos, trabajadores sociales, tecnólogos médicos, u otro profesional de la salud que brinda atención en el primer nivel de atención, así como profesionales gestores responsables de tomar decisiones a nivel institucional, regional o nacional, con el fin de facilitar el proceso de implementación.
Autores
Grupo elaborador
Expertos clínicos:
- Juan Carlos Samamé Pérez-Vargas
Médico especialista en Oncología Médica, Hospital Nacional Arzobispo Loayza. - Juan Carlos Pari Salas
Médico especialista en Radioterapia, Hospital III Goyeneche, Arequipa. - Fiorella Belisa Ore Sánchez
Médico especialista en Cirugía Oncológica de mamas, tejidos blandos y piel, IREN Centro. - Joan Manuel Moreno Luján
Médico especialista en Oncología Médica, IREN Norte. - Fernando Segundo Valencia Juárez
Médico especialista en Medicina General y Oncológica, IREN Sur. - Oliver Raziel Rúa Fernández
Médico especialista en Oncología Médica, Hospital Nacional Cayetano Heredia. - Luis Alberto Álvarez Rodríguez
Médico especialista en Cirugía General y Oncológica, Departamento de Promoción de la Salud, Prevención y Control Nacional del Cáncer, INEN. - Lia Pamela Rebaza Vásquez
Médico especialista en Cirugía Oncológica de mamas, tejidos blandos y piel, Sociedad Peruana de Mastología. - Paul Henry Pinto Reinoso
Médico especialista en Oncología Médica, Hospital III Goyeneche, Arequipa. - Javier Paredes Arias
Médico especialista en Cirugía Oncológica, Hospital III Goyeneche, Arequipa. - Marcia Carrasco Collantes
Médico especialista en Cirugía Oncológica de mamas, tejidos blandos y piel, Hospital Santa Rosa, Lima. - Mayda Cristina Hinojosa Obando
Médico especialista en Ginecología y Obstetricia, Estrategia de Prevención del Cáncer de la DIRIS Lima Sur. - María Beatriz Nizama Ávila
Obstetra, Coordinadora del Programa Estratégico de Prevención y Control del Cáncer, DIRIS Lima Sur. - Yanina Haydee Napan Peñaloza
Obstetra, Centro Materno Infantil Ollantay, DIRIS Lima Sur. - Nelly Delfina Angulo Rivera
Obstetra, Programa Estratégico de Prevención y Control del Cáncer, DIRIS Lima Centro. - Nelly Galván Ordoñez
Obstetra, Programa Estratégico de Prevención y Control del Cáncer, DIRIS Lima Norte. - Vanessa Esmeralda Velezmoro Díaz
Médico especialista en Radiología, Departamento de Radiodiagnóstico, INEN. - Jorge Antonio Dunstan Yataco
Médico especialista en Cirugía General y Oncológica, Director Ejecutivo del Departamento de Cirugía de Mamas y Tejidos Blandos, INEN. - José Antonio Galarreta Zegarra
Médico especialista en Cirugía Oncológica de mamas, tejidos blandos y piel, Departamento de Cirugía de Mamas y Tejidos Blandos, INEN.
Metodólogos:
- Naysha Yamilet Becerra Chauca
Obstetra, Maestra en Salud Pública y Salud Global, Metodóloga, Programa “Creación de Redes Integradas de Salud”, Ministerio de Salud. - Gisely Hijar Guerra
Bióloga, Magister en Gestión en Sistemas de Salud y Salud Pública, Coordinadora Metodológica, Programa “Creación de Redes Integradas de Salud”, Ministerio de Salud.
Coordinación central para el desarrollo de la GPC:
- Ericson Leonardo Gutiérrez Ingunza
Médico Gestor en Salud, Coordinador Central, Programa “Creación de Redes Integradas de Salud”, Ministerio de Salud.
Revisores
Revisores externos:
- Romano José López Palomino
Médico especialista en Cirugía Oncológica de mamas, tejidos blandos y piel, Hospital Nacional Arzobispo Loayza. - Omar Fernando Yanque Robles
Médico especialista en Ginecología y Obstetricia, Hospital Nacional Edgardo Rebagliati Martins, EsSalud.
Revisores del Instituto Nacional de Salud:
- Lely Solari Zerpa
Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Fabiola Huaroto Ramírez
Subdirección de Guías de Práctica Clínica, CETS, Instituto Nacional de Salud. - Andrely Huerta Rosario
Subdirección de Guías de Práctica Clínica, CETS, Instituto Nacional de Salud. - Lucía Villar Bernaola
Subdirección de Guías de Práctica Clínica, CETS, Instituto
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
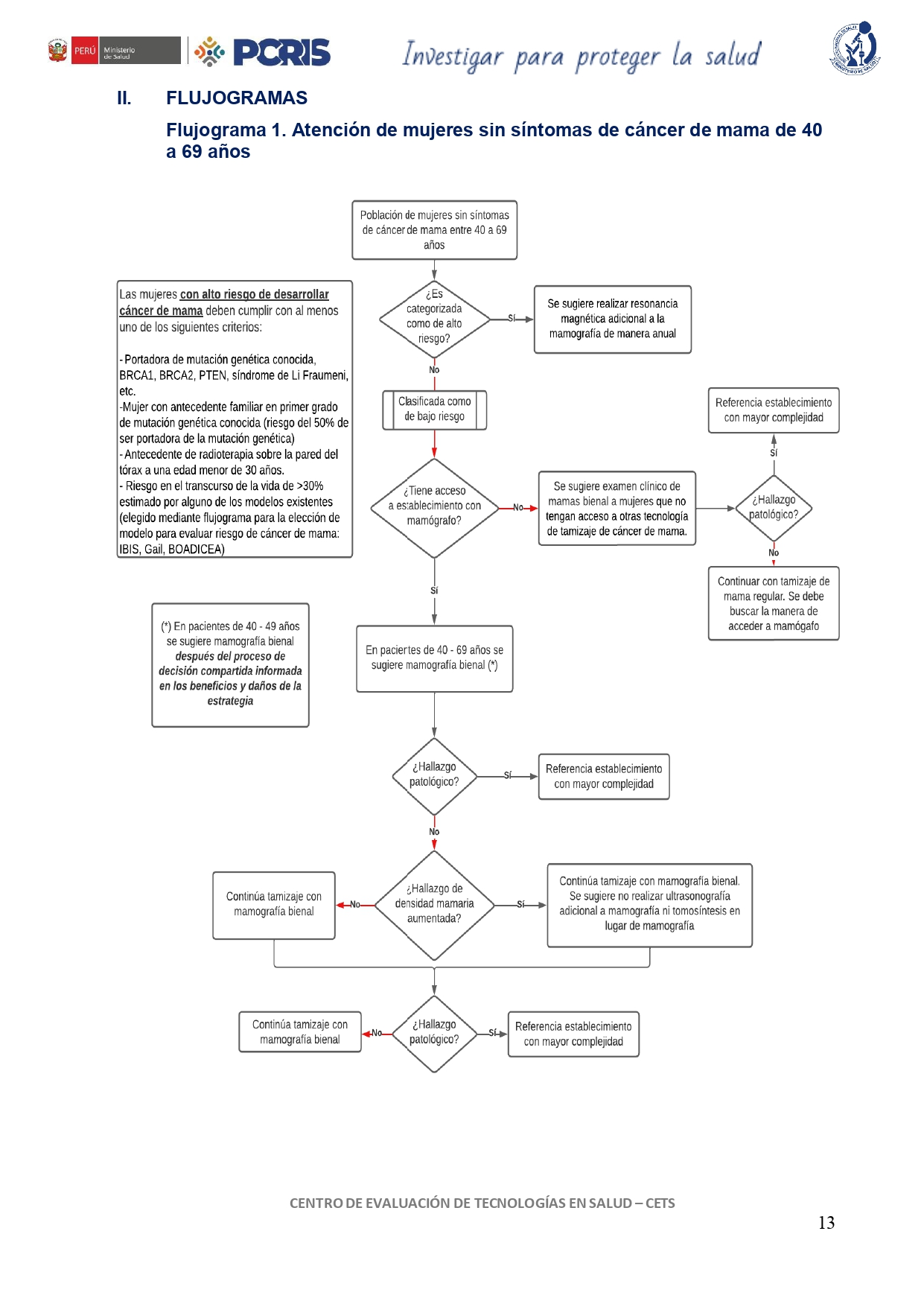
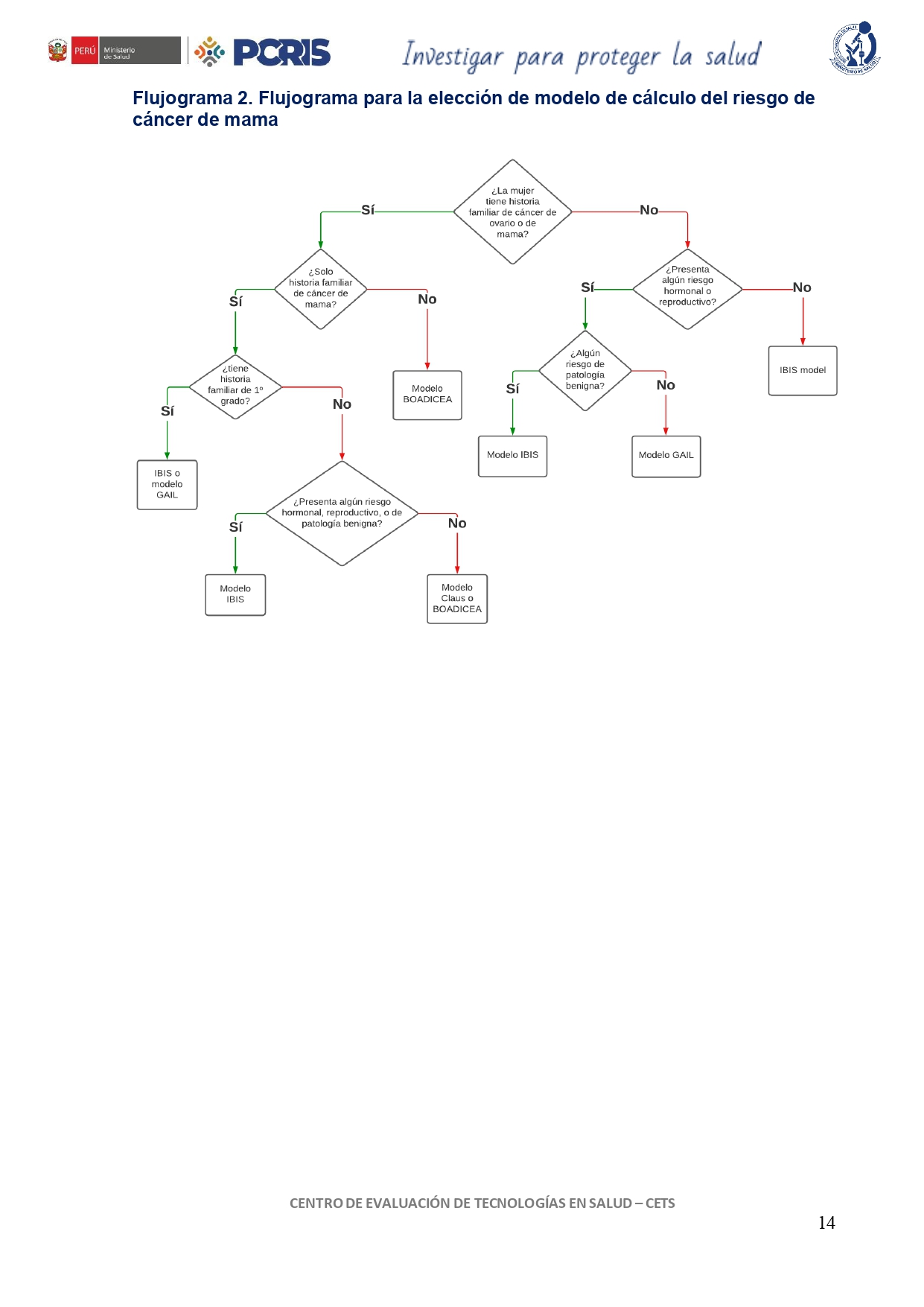
vacio
vacio
1. Tamizaje: clínico
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres asintomáticas de 40 a 69 años con bajo riesgo de desarrollar cáncer de mama se sugiere realizar examen clínico de mama cada dos años llevado a cabo por un profesional de salud como parte del tamizaje de cáncer de mama.
(Recomendación condicional a favor, certeza moderada de la evidencia)
BPC 1:
Esta recomendación deberá ser enfocada con mayor énfasis en mujeres que no tengan acceso a otras tecnologías de tamizaje de cáncer de mama e implementarse con una frecuencia bienal (cada dos años).
Esta recomendación está dirigida a mujeres asintomáticas con bajo riesgo de desarrollar cáncer, es decir, que no cumplen con ningún criterio de alto riesgo para desarrollar cáncer de mama.
2. Tamizaje: mamografía
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres de entre 40 y 49 años, asintomáticas y con bajo riesgo de desarrollar cáncer de mama, se sugiere realizar cada dos años mamografía para tamizaje de cáncer de mama.
(Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En el grupo etario de 40 a 49 años, esta recomendación debería realizarse después de un proceso de decisión compartida con las mujeres en donde se explique potenciales beneficios y daños de realizarse la mamografía como tamizaje de manera bienal y en el que la mujer acepte realizárselo.
Esta recomendación está dirigida a mujeres asintomáticas con bajo riesgo de desarrollar cáncer, es decir, que no cumplen con ningún criterio de alto riesgo para desarrollar cáncer de mama.
BPC 2:
En mujeres de entre 50 y 69 años, asintomáticas y con bajo riesgo de desarrollar cáncer de mama, se sugiere realizar cada dos años mamografía para tamizaje de cáncer de mama.
3. Densidad mamaria: Ultrasonografía
Descargar PDF con el desarrollo de la pregunta
Recomendación 1:
En mujeres asintomáticas de 40 a 69 años con bajo riesgo de desarrollar cáncer de mama, con resultado de mamografía negativa y hallazgo de densidad mamaria incrementada categoría C o D, se sugiere no realizar ultrasonografía mamaria suplementaria.
(Recomendación condicional en contra, certeza muy baja de la evidencia)
BPC 1:
El panel considera que actualmente no hay evidencia suficiente para sustentar una recomendación a favor de su uso rutinario.
4. Densidad mamaria: Tomosíntesis vs. Mamografía
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres asintomáticas de 40 a 69 años con bajo riesgo de desarrollar cáncer de mama y densidad mamaria aumentada (categoría C o D) identificada en una mamografía previa, se sugiere no realizar tomosíntesis como tamizaje de cáncer de mama.
(Recomendación condicional en contra, certeza muy baja de la evidencia)
BPC 1:
El panel considera que actualmente no hay evidencia suficiente para sustentar una recomendación a favor.
5. Tamizaje alto riesgo: RM vs. mamografía
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres asintomáticas de 40 a 69 años con alto riesgo de desarrollar cáncer de mama, se sugiere realizar resonancia magnética con contraste adicional a la mamografía como tamizaje de cáncer de mama.
(Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
Esta recomendación debería ser implementada con una frecuencia anual. Está dirigida a mujeres con alto riesgo de desarrollar cáncer de mama, es decir, aquellas que presenten al menos uno de los siguientes antecedentes:
- Portadora de mutación genética conocida que aumenta el riesgo de cáncer de mama: BRCA1, BRCA2, PTEN, síndrome de Li Fraumeni, etc.
- Mujer con antecedente familiar en primer grado de mutación genética conocida (riesgo del 50% de ser portadora de la mutación genética).
- Antecedente de radioterapia sobre la pared del tórax a una edad menor de 30 años.
- Riesgo en el transcurso de la vida >30%, estimado por modelos existentes como IBIS, Gail, BOADICEA.
Referencias bibliográficas
1. Winters S, Martin C, Murphy D, Shokar NK. Breast Cancer Epidemiology, Prevention, and Screening. Progress in molecular biology and translational science. 2017;151:1- 32.
2. Mokhtari-Hessari P, Montazeri A. Health-related quality of life in breast cancer patients: review of reviews from 2008 to 2018. Health and quality of life outcomes. 2020;18(1):338.
3. Kolak A, Kamińska M, Sygit K, Budny A, Surdyka D, Kukiełka-Budny B, et al. Primary and secondary prevention of breast cancer. Annals of agricultural and environmental medicine : AAEM. 2017;24(4):549-53.
4. Cancer IAfRo. Globocan 2020: Breast: Organización Mundial de la Salud; 2020 [Available from: https://gco.iarc.fr/today/data/factsheets/cancers/20-Breast-fact- sheet.pdf.
5. Cancer IHfRo. CANCER TODAY: Organización Mundial de la Salud; 2020 [Available from: https://gco.iarc.fr/today/online-analysis- pie?v=2020&mode=cancer&mode_population=countries&population=900&populatio ns=604&key=total&sex=2&cancer=39&type=1&statistic=5&prevalence=0&populatio n_group=0&ages_group%5B%5D=0&ages_group%5B%5D=17&nb_items=7&group
_cancer=0&include_nmsc=1&include_nmsc_other=1&half_pie=0&donut=0#collapse-group-0-1.
6. Institute for Health Metrics and Evaluation. GBC Compare: University of Washington; 2023 [Available from: https://vizhub.healthdata.org/gbd-compare/.
7. Chlebowski R. Factors that modify breast cancer risk in women: UptoDate; 2023 [Available from: https://www.uptodate.com/contents/factors-that-modify-breast- cancer-risk-in- women?search=breast%20cancer%20risk%20factor&source=search_result&selecte dTitle=1~150&usage_type=default&display_rank=1.
8. Wilkinson L, Gathani T. Understanding breast cancer as a global health concern. The British journal of radiology. 2022;95(1130):20211033.
9. Khrouf S, Letaief Ksontini F, Ayadi M, Belhaj Ali Rais H, Mezlini A. Breast cancer screening: a dividing controversy. La Tunisie medicale. 2020;98(1):22-34.
10. Documento Técnico Metodología para la elaboración de Guías de Práctica Clínica (2015).
11. Instituto de Evaluación de Tecnologías en Salud e Investigación. Guía de Práctica Clínica para el Tamizaje de Cáncer de Mama: Guía en Versión Extensa. Lima: EsSalud; 2022. .
12. Guía de Práctica Clínica para tratamiento integral, seguimiento y rehabilitación del cáncer de mama. 2da edición. Guía No 19. Colombia, Ministerio de Salud y Protección Social, Bogotá D.C.: El Ministerio; 2017. .
13. Familial breast cancer: classification, care and managing breast cancer and related risks in people with a family history of breast cancer. NICE. Clinical guideline Published: 25 June 2013.
14. Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non- randomised studies of healthcare interventions, or both. BMJ. 2017;358:j4008.
15. Higgins JPT, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
16. Sterne JAC, Hernán MA, Reeves BC, Savović J, Berkman ND, Viswanathan M, et al. ROBINS-I: a tool for assessing risk of bias in non-randomised studies of interventions. BMJ. 2016;355:i4919.
17. Whiting PF, Rutjes AWS, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: A Revised Tool for the Quality Assessment of Diagnostic Accuracy Studies. Ann Intern Med. 2011;155(8):529-36.
18. Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation-determinants of a recommendation’s direction and strength. Journal of Clinical Epidemiology. 2013;66(7):726-35.
19. Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. Marcos GRADE de la evidencia a la decisión (EtD): un enfoque sistemático y transparente para tomar decisiones sanitarias bien informadas. 2: Guías de práctica clínica. Gaceta Sanitaria. 2018;32(2).
20. Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of Clinical Epidemiology. 2013;66(7):719- 25.
21. Guyatt G, Oxman AD, Sultan S, Brozek J, Glasziou P, Alonso-Coello P, et al. GRADE guidelines: 11. Making an overall rating of confidence in effect estimates for a single outcome and for all outcomes. Journal of Clinical Epidemiology. 2013;66(2):151-7.
22. Dewidar O, Lotfi T, Langendam MW, Parmelli E, Parkinson ZS, Solo K, et al. Good or best practice statements: proposal for the operationalisation and implementation of GRADE guidance. BMJ Evidence-Based Medicine. 2022.
23. Barton MB, Harris R, Fletcher SW. The rational clinical examination. Does this patient have breast cancer? The screening clinical breast examination: should it be done? How? Jama. 1999;282(13):1270-80. oi:
https://www.doi.org/10.1001/jama.282.13.1270.
24. Nelson HD, Tyne K, Naik A, Bougatsos C, Chan BK, Humphrey L. Screening for breast cancer: an update for the U.S. Preventive Services Task Force. Ann Intern Med. 2009;151(10):727-37, w237-42. doi: https://www.doi.org/10.7326/0003-4819- 151-10-200911170-00009.
25. Mittra I, Mishra GA, Dikshit RP, Gupta S, Kulkarni VY, Shaikh HKA, et al. Effect of screening by clinical breast examination on breast cancer incidence and mortality after 20 years: prospective, cluster randomised controlled trial in Mumbai. BMJ. 2021;372:n256. doi: https://www.doi.org/10.1136/bmj.n256. Erratum in: BMJ. 2021 Mar 19;372:n738. doi: https://www.doi.org/10.1136/bmj.n738.
26. Pisani P, Parkin DM, Ngelangel C, Esteban D, Gibson L, Munson M, et al. Outcome of screening by clinical examination of the breast in a trial in the Philippines. Int J Cancer. 2006;118(1):149-54. doi: https://www.doi.org/10.1002/ijc.21343.
27. Agency for Healthcare Research and Quality. Screening for Breast Cancer: A Systematic Review to Update the 2009 U.S. Preventive Services Task Force Recommendation. Rockville: Department of Health and Human Services; 2016.
28. Bond M, Pavey T, Welch K, Cooper C, Garside R, Dean S, et al. Systematic review of the psychological consequences of false-positive screening mammograms. Health Technol Assess. 2013 Mar;17(13):1-170, v-vi. doi: https://www.doi.org/10.3310/hta17130.
29. Canadian Task Force on Preventive Health Care. Breast cancer screening: Part A. An evidence report to inform an update of the Canadian Task Force on Preventive Health Care 2011 Guideline. Ottawa: Public Health Agency of Canada; 2017.
30. Canelo-Aybar C, Ferreira DS, Ballesteros M, Posso M, Montero N, Solà I, et al. Benefits and harms of breast cancer mammography screening for women at average risk of breast cancer: A systematic review for the European Commission Initiative on Breast Cancer. J Med Screen. 2021 Dec;28(4):389-404. doi: https://www.doi.org/10.1177/0969141321993866.
31. Gøtzsche PC, Jørgensen KJ. Screening for breast cancer with mammography. Cochrane Database Syst Rev. 2013 Jun 4;2013(6):CD001877. doi: https://www.doi.org/10.1002/14651858.CD001877.pub5.
32. Hamashima C, Ohta K, Kasahara Y, Katayama T, Nakayama T, Honjo S, et al. A meta-analysis of mammographic screening with and without clinical breast examination. Cancer Sci. 2015 Jul;106(7):812-8. doi: https://www.doi.org/10.1111/cas.12693.
33. Salz T, Richman AR, Brewer NT. Meta-analyses of the effect of false-positive mammograms on generic and specific psychosocial outcomes. Psychooncology. 2010 Oct;19(10):1026-34. doi: https://www.doi.org/10.1002/pon.1676.
34. van den Ende C, Oordt-Speets AM, Vroling H, van Agt HME. Benefits and harms of breast cancer screening with mammography in women aged 40-49 years: A systematic review. Int J Cancer. 2017 Oct 1;141(7):1295-1306. doi: https://www.doi.org/10.1002/ijc.30794.
35. Bond M, Pavey T, Welch K, Cooper C, Garside R, Dean S, et al. Psychological consequences of false-positive screening mammograms in the UK. Evidence-based medicine. 2013;18(2):54-61.
36. Mathioudakis AG, Salakari M, Pylkkanen L, Saz‐Parkinson Z, Bramesfeld A, Deandrea S, et al. Systematic review on women’s values and preferences concerning breast cancer screening and diagnostic services. Psycho‐oncology. 2019;28(5):939- 47.
37. Stiggelbout A, Copp T, Jacklyn G, Jansen J, Liefers GJ, McCaffery K, et al. Women’s Acceptance of Overdetection in Breast Cancer Screening: Can We Assess Harm- Benefit Tradeoffs? Medical decision making : an international journal of the Society for Medical Decision Making. 2020;40(1):42-51.
38. Icanervilia AV, van der Schans J, Cao Q, de Carvalho AC, Cordova-Pozo K, At Thobari J, et al. Economic evaluations of mammography to screen for breast cancer in low- and middle-income countries: A systematic review. Journal of global health. 2022;12:04048.
39. Zelle SG, Vidaurre T, Abugattas JE, Manrique JE, Sarria G, Jeronimo J, et al. Cost- effectiveness analysis of breast cancer control interventions in Peru. PloS one. 2013;8(12):e82575.
40. Relecom A, Arzel B, Perneger T. Effect of an organised screening program on socioeconomic inequalities in mammography practice, knowledge and attitudes. International journal for equity in health. 2018;17(1):95.
41. Melnikow J, Fenton JJ, Whitlock EP, Miglioretti DL, Weyrich MS, Thompson JH, et al. Supplemental Screening for Breast Cancer in Women With Dense Breasts: A Systematic Review for the U.S. Preventive Services Task Force. Ann Intern Med. 2016;164(4):268-78. doi: https://www.doi.org/10.7326/M15-1789.
42. Mizzi D, Allely C, Zarb F, Kelly J, Hogg P, McEntee M, et al. Examining the effectiveness of supplementary imaging modalities for breast cancer screening in women with dense breasts: A systematic review and meta-analysis. European journal of radiology. 2022;154:110416. doi: https://www.doi.org/10.1016/j.ejrad.2022.110416.
43. Yuan WH, Hsu HC, Chen YY, Wu CH. Supplemental breast cancer-screening ultrasonography in women with dense breasts: a systematic review and meta- analysis. British journal of cancer. 2020;123(4):673-88. doi: https://www.doi.org/10.1038/s41416-020-0928-1.
44. Bodewes FTH, van Asselt AA, Dorrius MD, Greuter MJW, de Bock GH. Mammographic breast density and the risk of breast cancer: A systematic review and meta-analysis. Breast (Edinburgh, Scotland). 2022;66:62-8.
45. Manrique S, Castañeda B, Ferrer J, Casado F, Aguilar J, Laimes R, et al. Estudio exploratorio de la densidad mamaria en mujeres de Lima, Perú. Carcinos. 2014;4(2).
46. Sprague BL, Stout NK, Schechter C, van Ravesteyn NT, Cevik M, Alagoz O, et al. Benefits, harms, and cost-effectiveness of supplemental ultrasonography screening for women with dense breasts. Ann Intern Med. 2015;162(3):157-66.
47. Alabousi M, Wadera A, Kashif Al-Ghita M, Kashef Al-Ghetaa R, Salameh JP, Pozdnyakov A, et al. Performance of Digital Breast Tomosynthesis, Synthetic Mammography, and Digital Mammography in Breast Cancer Screening: A Systematic Review and Meta-Analysis. J Natl Cancer Inst. 2021;113(6):680-90. doi: https://www.doi.org/10.1093/jnci/djaa205.
48. Zeng A, Brennan ME, Young S, Mathieu E, Houssami N. The Effect of Supplemental Imaging on Interval Cancer Rates in Mammography Screening: Systematic Review.
Clinical Breast Cancer. 2022;22(3):212-22. doi: https://www.doi.org/10.1016/j.clbc.2021.09.011.
49. Granader EJ, Dwamena B, Carlos RC. MRI and mammography surveillance of women at increased risk for breast cancer: recommendations using an evidence- based approach. Acad Radiol. 2008 Dec;15(12):1590-5. PMID: 19000876. doi: https://www.doi.org/10.1016/j.acra.2008.06.006.
50. Jiang X, McGuinness JE, Sin M, Silverman T, Kukafka R, Crew KD. Identifying Women at High Risk for Breast Cancer Using Data From the Electronic Health Record Compared With Self-Report. JCO Clinical Cancer Informatics. 2019(3):1-8.
51. Ren W, Chen M, Qiao Y, Zhao F. Global guidelines for breast cancer screening: a systematic review. The Breast. 2022;64:85-99.
52. Ministerio de Salud y Protección Social de Colombia. Guía de Práctica Clínica, para la detección temprana, tratamiento integral, seguimiento y rehabilitación del cáncer de mama. 2º ed. Bogotá2017.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


