DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
VERSIÓN CORTA
DESCARGAR
FLUJOGRAMA
vacio
vacio
Ámbito
- La presente guía técnica tiene como ámbito de aplicación los establecimientos de salud de las Redes Integradas de Salud (RIS), de las Direcciones Regionales de Salud, de las Gerencias Regionales de Salud o las que hagan sus veces a nivel regional. Así mismo, servirá como referente para los demás establecimientos de salud del Seguro Social de Salud (EsSalud), de las Instituciones Armadas, de la Policía Nacional del Perú, así como para los establecimientos de salud privados y otros prestadores que brinden atenciones de salud en todo el país.
Población y alcance
- Población: Adultos (mayores de 18 años) asintomáticos, con o sin algún factor de riesgo para el desarrollo de cáncer colorrectal que acuden a los establecimientos de salud en el primer nivel de atención.
- Usuarios: La guía está dirigida a todo el personal de salud que tenga a su cargo la atención integral de la prevención y diagnóstico de cáncer de colorrectal: médicos cirujanos, internistas, médicos de familia, gastroenterólogos, nutricionistas, enfermeros, psicólogos, trabajadores sociales, tecnólogos médicos, u otro profesional de la salud que brinda atención en el primer nivel de atención, así como profesionales gestores responsables de tomar decisiones a nivel institucional, regional o nacional, con el fin de facilitar el proceso de implementación.
Autores
Grupo elaborador
Expertos clínicos:
- Rossana Andrea Franco Vásquez.
Médico especialista en gastroenterología. Hospital María Auxiliadora. - Roxana Consuelo Gallegos López.
Médico especialista en gastroenterología. Hospital María Auxiliadora. - Jeimy Lourdes Ramos Pacheco.
Médico especialista en gastroenterología. Hospital Nacional Arzobispo Loayza. - Joan Manuel Moreno Luján.
Médico especialista en oncología médica. Instituto Regional de Enfermedades Neoplásicas – IREN Norte. - César Iván León Vega.
Médico especialista en cirugía oncológica. Instituto Regional de Enfermedades Neoplásicas – IREN Norte. - Filadelfio Amador Salvador Reyes.
Médico especialista en cirugía oncológica abdominal. Instituto Regional de Enfermedades Neoplásicas – IREN Centro. - Claudio Alaín Mengoa Quintanilla.
Médico especialista en cirugía general y oncológica. Instituto Regional de Enfermedades Neoplásicas – IREN Sur. - Julio Guillermo Grados Doroteo.
Médico especialista en oncología médica. Hospital Nacional Arzobispo Loayza. - Karen Mayuly Solange Lalupu Sosa.
Médico especialista en oncología médica. Hospital Hipólito Unanue. - Ronald Ventosilla Villanueva.
Médico especialista en Medicina interna y en Medicina general y oncológica. Hospital Nacional Daniel Alcides Carrión, Callao. - Katherine Palacios Tayro.
Médico especialista en Medicina familiar y comunitaria. Departamento de Promoción de la Salud, Prevención y Control Nacional del Cáncer. INÉN. - Samuel Sixto Hidalgo Zerpa.
Médico General. Programa Estratégico de Prevención y Control del Cáncer de la Dirección de Redes Integradas de Salud Lima Sur. - María Beatriz Nizama Ávila.
Obstetra. Coordinadora del Programa Estratégico de Prevención y Control del Cáncer de la Dirección de Redes Integradas de Salud Lima Sur. - Nelly Delfina Angulo Rivera.
Obstetra. Programa Estratégico de Prevención y Control del Cáncer de la Dirección de Redes Integradas de Salud Lima Centro. - Nelly Galván Ordóñez.
Obstetra. Programa Estratégico de Prevención y Control del Cáncer de la Dirección de Redes Integradas de Salud Lima Norte. - Paulo Germán Jáuregui Munguía.
Médico especialista en oncología médica. Hospital Nacional Daniel Alcides Carrión, Callao.
Metodólogos:
- Sergio André Goicochea Lugo.
Médico Cirujano, metodólogo en elaboración de guías de práctica clínica. Programa de Inversión “Creación de Redes Integradas de Salud”. Ministerio de Salud. - Gisely Híjar Guerra.
Bióloga, Magister en Gestión en Sistemas de Salud y Salud Pública. Coordinadora Metodológica. Programa de Inversión “Creación de Redes Integradas de Salud”. Ministerio de Salud.
Revisores
Revisión externa:
- Édgar Fermín Yan Quiroz.
Médico especialista en Cirugía Oncológica. Hospital de Alta Complejidad de La Libertad “Virgen de la Puerta”. EsSalud.
Revisores Instituto Nacional de Salud:
- Lely Solari Zerpa.
Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Fabiola Huaroto Ramírez.
Subdirección de Guías de Práctica Clínica del Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Andrély Huerta Rosario.
Subdirección de Guías de Práctica Clínica del Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Lucía Villar Bernaola.
Subdirección de Guías de Práctica Clínica del Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujograma que resumen el contenido de la GPC
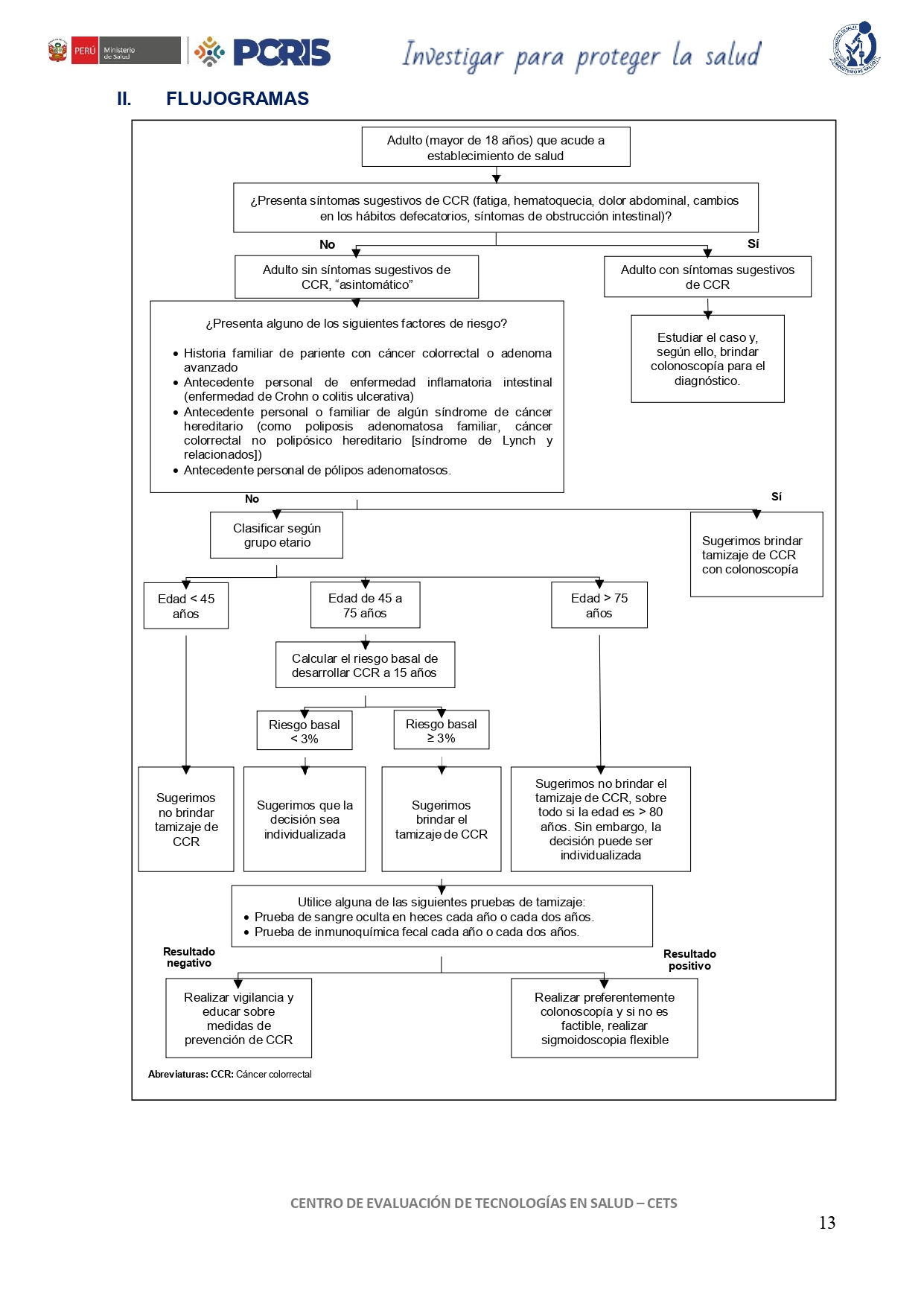
vacio
vacio
1. CCR 45 asintomáticos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos menores de 45 años, asintomáticos, de población general y sin factores de riesgo para el desarrollo de CCR, sugerimos no brindar tamizaje de CCR.
(Recomendación condicional en contra, certeza muy baja de la evidencia)
BPC 1:
Durante la anamnesis, indague sobre la presencia de alguno de los siguientes factores de riesgo:
- Historia familiar de pariente con cáncer colorrectal o adenoma avanzado.
- Antecedente personal de enfermedad inflamatoria intestinal (enfermedad de Crohn o colitis ulcerativa).
- Antecedente personal o familiar de algún síndrome de cáncer hereditario (como poliposis adenomatosa familiar, cáncer colorrectal no polipósico hereditario [síndrome de Lynch y relacionados]).
- Antecedente personal de pólipos adenomatosos.
2. CCR 45 75 asintomáticos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos de 45 a 75 años, asintomáticos, de población general, evalúe el riesgo de desarrollar cáncer colorrectal mediante calculadoras validadas como la calculadora QCancer®.
(Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
Está disponible en: https://qcancer.org/15yr/colorectal/
BPC 2:
En adultos de 45 a 75 años cuyo riesgo de desarrollar cáncer colorrectal a 15 años sea menor de 3%, sugerimos que la decisión sea individualizada teniendo en cuenta las preferencias de la persona informada sobre beneficios y daños.
- Colonoscopía en una oportunidad.
- Sigmoidoscopia flexible en una oportunidad.
- Prueba de sangre oculta en heces cada año o cada dos años.
- Prueba de inmunoquímica fecal cada año o cada dos años.
BPC 3:
Si se decide realizar el tamizaje con pruebas iniciales como sangre oculta en heces o inmunoquímica fecal y alguna resulta positiva, derive para colonoscopía o, si no es posible, opte por sigmoidoscopia flexible.
3. CCR 75 asintomáticos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos mayores de 75 años, asintomáticos, y de población general, sugerimos no brindar tamizaje de CCR, sobre todo en mayores de 80 años.
(Recomendación condicional en contra, certeza baja de la evidencia)
BPC 1:
Considere los siguientes criterios para determinar si una persona mayor de 75 años puede beneficiarse del tamizaje:
- Personas sin tamizaje previo.
- Personas con expectativa de vida mayor a 10 años.
4. CCR con riesgo
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos asintomáticos con factores de riesgo para cáncer colorrectal, sugerimos brindar tamizaje con colonoscopía.
(Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
Factores de riesgo: Historia familiar de cáncer colorrectal o adenoma avanzado, antecedente personal de enfermedad inflamatoria intestinal, antecedente personal o familiar de síndrome de cáncer hereditario, antecedente personal de pólipos adenomatosos.
BPC 2:
En adultos asintomáticos con historia familiar de cáncer colorrectal o adenoma avanzado, realice tamizaje con colonoscopía a los 40 años o 10 años antes del diagnóstico del familiar (el que ocurra primero) con frecuencia cada 5 años.
Referencias bibliográficas
REFERENCIAS BIBLIOGRÁFICAS
1. Mattiuzzi C, Sanchis-Gomar F, Lippi G. Concise update on colorectal cancer epidemiology. Annals of translational medicine. 2019;7(21):609.
2. Dekker E, Tanis PJ, Vleugels JLA, Kasi PM, Wallace MB. Colorectal cancer. Lancet (London, England). 2019;394(10207):1467-80.
3. Rawla P, Sunkara T, Barsouk A. Epidemiology of colorectal cancer: incidence, mortality, survival, and risk factors. Przeglad gastroenterologiczny. 2019;14(2):89- 103.
4. Ferlay J EM, Lam F, Colombet M, Mery L, Piñeros M, et al. Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer. [Internet]. 2020. Disponible en: https://gco.iarc.fr/today.
5. Ministerio de Salud (MINSA). Cáncer de colon: Al año, el Perú registra 4636 casos nuevos y más de 2000 fallecimientos. Disponible en: https://www.gob.pe/institucion/minsa/noticias/596696-cancer-de-colon-al-ano-el- peru-registra-4636-casos-nuevos-y-mas-de-2000-fallecimientos.
6. Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015. Disponible en: https://bvs.minsa.gob.pe/local/MINSA/3301.pdf.
7. Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
8. Instituto Nacional del Cáncer. Recomendaciones para el tamizaje organizado de Cáncer Colorrectal en población de riesgo promedio en Argentina [Internet]. Buenos Aires AINdC, Ministerio de Salud de Argentina. 2022 [citado el 30 de enero de 2024]. Disponible en: https://bancos.salud.gob.ar/sites/default/files/2022-06/2022-06- recomendaciones-tamizaje-organizado-de-ccr–poblacion-riesgo-promedio- Argentina.pdf.
9. Davidson KW, Barry MJ, Mangione CM, Cabana M, Caughey AB, Davis EM, et al. Screening for Colorectal Cancer: US Preventive Services Task Force Recommendation Statement. Jama. 2021;325(19):1965-77.
10. Helsingen LM, Vandvik PO, Jodal HC, Agoritsas T, Lytvyn L, Anderson JC, et al. Colorectal cancer screening with faecal immunochemical testing, sigmoidoscopy or colonoscopy: a clinical practice guideline. BMJ. 2019 Oct 2;367:l5515. doi: https://www.doi.org/10.1136/bmj.l5515. Erratum in: BMJ. 2023 Jan 19;380:p143. doi: https://www.doi.org/10.1136/bmj.p143.
11. Ministerio de Salud y Protección Social e Instituto de Evaluación Tecnológica en Salud (IETS). Guía de práctica clínica (GPC) para la detección temprana d, tratamiento, seguimiento y rehabilitación de pacientes con diagnóstico de cáncer de colon y recto [Internet]. Bogotá, Colombia: IETS. 2013 [citado el 30 de enero de 2024]. Disponible en: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/INEC/IETS/gpc- completa-ca-colon.pdf.
12. Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non- randomised studies of healthcare interventions, or both. BMJ. 2017 Sep 21;358:j4008. doi: https://doi.org/10.1136/bmj.j4008.
13. Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ (Clinical research ed). 2011;343:d5928.
14. Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in metaanalyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009.
15. Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011 Oct 18;155(8):529-36. doi: https://doi.org/10.7326/0003-4819- 155-8-201110180-00009.
16. Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation-determinants of a recommendation’s direction and strength. J Clin Epidemiol. 2013 Jul;66(7):726-35. doi: https://doi.org/10.1016/j.jclinepi.2013.02.003. Epub 2013 Apr 6.
17. Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: https://doi.org/10.1136/bmj.i2016.
18. Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: https://doi.org/10.1136/bmj.i2089.
19. Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. J Clin Epidemiol. 2013 Jul;66(7):719-25. doi: https://doi.org/10.1016/j.jclinepi.2012.03.013. Epub 2013 Jan 9.
20. Guyatt G, Oxman AD, Sultan S, Brozek J, Glasziou P, Alonso-Coello P, et al. GRADE guidelines: 11. Making an overall rating of confidence in effect estimates for a single outcome and for all outcomes. Journal of Clinical Epidemiology. febrero de 2013;66(2):151–7. .
21. Dewidar O, Lotfi T, Langendam MW, Parmelli E, Saz Parkinson Z, Solo K, et al. Good or best practice statements: proposal for the operationalisation and implementation of GRADE guidance. BMJ EBM. junio de 2023;28(3):189–96. .
22. Świtalski J, Tatara T, Wnuk K, Miazga W, Karauda D, Matera A, et al. Clinical Effectiveness of Faecal Immunochemical Test in the Early Detection of Colorectal Cancer-An Umbrella Review. Cancers. 2022;14(18). doi: https://www.doi.org/10.3390/cancers14184391.
23. Lin JS, Perdue LA, Henrikson NB, Bean SI, Blasi PR. Screening for Colorectal Cancer: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. Jama. 2021;325(19):1978-98. https://www.doi.org/10.1001/jama.2021.4417.
24. Gini A, Jansen EEL, Zielonke N, Meester RGS, Senore C, Anttila A, et al. Impact of colorectal cancer screening on cancer-specific mortality in Europe: A systematic review. Eur J Cancer. 2020 Mar;127:224-235. doi: https://www.doi.org/10.1016/j.ejca.2019.12.014.
25. Zheng S, Chen K, Liu X, Ma X, Yu H, Chen K, et al. Cluster randomization trial of sequence mass screening for colorectal cancer. Dis Colon Rectum. 2003 Jan;46(1):51-8. doi: https://www.doi.org/10.1007/s10350-004-6496-2.
26. Care. CTFoPH. Recommendations on screening for colorectal cancer in primary care. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne. 2016;188(5):340-8.
27. Helsingen LM, Zeng L, Siemieniuk RA, Lytvyn L, Vandvik PO, Agoritsas T, et al. Establishing thresholds for important benefits considering the harms of screening interventions. BMJ open. 2020;10(12):e037854.
28. Jodal HC, Helsingen LM, Anderson JC, Lytvyn L, Vandvik PO, Emilsson L. Colorectal cancer screening with faecal testing, sigmoidoscopy or colonoscopy: a systematic review and network meta-analysis. BMJ Open. 2019 Oct 2;9(10):e032773. doi: https://www.doi.org/10.1136/bmjopen-2019-032773.
29. Buskermolen M, Cenin DR, Helsingen LM, Guyatt G, Vandvik PO, Haug U, et al. Colorectal cancer screening with faecal immunochemical testing, sigmoidoscopy or colonoscopy: a microsimulation modelling study. BMJ. 2019 Oct 2;367:l5383. doi: https://www.doi.org/10.1136/bmj.l5383.
30. Zheng S, Schrijvers JJA, Greuter MJW, Kats-Ugurlu G, Lu W, de Bock GH. Effectiveness of Colorectal Cancer (CRC) Screening on All-Cause and CRC-Specific Mortality Reduction: A Systematic Review and Meta-Analysis. Cancers (Basel). 2023 Mar 24;15(7):1948. doi: https://www.doi.org/10.3390/cancers15071948.
31. Mutneja H, Agrawal R, Bhurwal A, Arora S, Go A, Attar B. Comparative Effectiveness of Fecal Immunochemical Tests versus Flexible Sigmoidoscopy for Colorectal Cancer Screening: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. J Gastrointestin Liver Dis. 2021 Jun 18;30(2):267-273. doi: https://www.doi.org/10.15403/jgld-3432.
32. Zhong GC, Sun WP, Wan L, Hu JJ, Hao FB. Efficacy and cost-effectiveness of fecal immunochemical test versus colonoscopy in colorectal cancer screening: a systematic review and meta-analysis. Gastrointest Endosc. 2020 Mar;91(3):684- 697.e15. doi: https://www.doi.org/10.1016/j.gie.2019.11.035.
33. Hol L, de Bekker-Grob EW, van Dam L, Donkers B, Kuipers EJ, Habbema JD, et al. Preferences for colorectal cancer screening strategies: a discrete choice experiment. British journal of cancer. 2010;102(6):972-80.
34. Hasdeu S, Lamfre L, Altuna J, Torales S, Caporale J, Sánchez Viamonte J, et al. Costo-efectividad del rastreo de cáncer colorrectal en provincias argentinas seleccionadas. Revista Argentina de Salud Pública. 2017;8(31):13-8.
35. Espinola N, Maceira D, Palacios A. Costo-efectividad de las pruebas de tamizaje del cáncer colorrectal en la Argentina. 2016.
36. Pinzon Florez CE, Rosselli D, Gamboa Garay OA. Análisis de Costo-Efectividad de las Estrategias de Tamización de Cáncer Colorrectal en Colombia. Value in health regional issues. 2012;1(2):190-200.
37. Gutierrez-Aguado A, Escobedo-Palza S, Timana-Ruiz R, Sobrevilla-Ricci A, Mosqueira-Lovón R. Costo De Cáncer De Colon Avanzado En Los Establecimientos Hospitalarios Del Perú. Value in Health. 2015;18(7):A805.
38. Nuche-Berenguer B, Sakellariou D. Socioeconomic determinants of cancer screening utilisation in Latin America: A systematic review. PloS one. 2019;14(11):e0225667.
39. Kupper BEC, Ferreira FO, Nakagawa WT, Calsavara VF, Chulam TC, Lopes A, et al. Colorectal cancer: association between sociodemographic variables and the adherence to cancer screening. Arquivos brasileiros de cirurgia digestiva : ABCD = Brazilian archives of digestive surgery. 2023;36:e1729.
40. Crenitte MRF, de Melo LR, Jacob-Filho W, Avelino-Silva TJ. Transforming the invisible into the visible: disparities in the access to health in LGBT+ older people. Clinics (Sao Paulo, Brazil). 2023;78:100149.
41. Castaneda-Avila MA, Baek J, Epstein MM, Forrester SN, Ortiz AP, Lapane KL. Association Between Body Mass Index and Cancer Screening Adherence Among Latinas in the United States and Puerto Rico. Women’s health reports (New Rochelle, NY). 2022;3(1):552-62.
42. Nuche-Berenguer B, Sakellariou D. Socioeconomic Determinants of Participation in Cancer Screening in Argentina: A Cross-Sectional Study. Frontiers in public health. 2021;9:699108.
43. López-Charneco M, Pérez CM, Soto-Salgado M, Rodríguez L, González D, Serrano R, et al. Correlates of colorectal cancer screening among Hispanics: Results from the 2008 Puerto Rico behavioral risk factor surveillance system survey. Puerto Rico health sciences journal. 2013;32(2):68-75.
44. Hyams T, Golden B, Sammarco J, Sultan S, King-Marshall E, Wang MQ, et al. Evaluating preferences for colorectal cancer screening in individuals under age 50 using the Analytic Hierarchy Process. BMC health services research. 2021;21(1):754.
45. Makaroff KE, Shergill J, Lauzon M, Khalil C, Ahluwalia SC, Spiegel BMR, et al. Patient Preferences for Colorectal Cancer Screening Tests in Light of Lowering the Screening Age to 45 Years. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2023;21(2):520-31.e10.
46. Guittet L, Quipourt V, Aparicio T, Carola E, Seitz JF, Paillaud E, et al. Should we screen for colorectal cancer in people aged 75 and over? A systematic review – collaborative work of the French geriatric oncology society (SOFOG) and the French federation of digestive oncology (FFCD). BMC Cancer. 2023 Jan 5;23(1):17. doi: https://www.doi.org/10.1186/s12885-022-10418-5.
47. Ko CW, Sonnenberg A. Comparing risks and benefits of colorectal cancer screening in elderly patients. Gastroenterology. 2005;129(4):1163-70.
48. Holt PR, Kozuch P, Mewar S. Colon cancer and the elderly: from screening to treatment in management of GI disease in the elderly. Best practice & research Clinical gastroenterology. 2009;23(6):889-907.
49. Kistler CE, Kirby KA, Lee D, Casadei MA, Walter LC. Long-term outcomes following positive fecal occult blood test results in older adults: benefits and burdens. Archives of internal medicine. 2011;171(15):1344-51.
50. Institut national du Cancer (INCa). Medico-Economic Evaluation of Colorectal Cancer Screening / Technical Report, Decision Support. Francia: INCa; 2019 [cited 2023 27 de noviembre].
51. Knudsen AB, Rutter CM, Peterse EFP, Lietz AP, Seguin CL, Meester RGS, et al. Colorectal Cancer Screening: An Updated Modeling Study for the US Preventive Services Task Force. Jama. 2021;325(19):1998-2011.
52. Royce TJ, Hendrix LH, Stokes WA, Allen IM, Chen RC. Cancer screening rates in individuals with different life expectancies. JAMA internal medicine. 2014;174(10):1558-65.
53. Walter LC, Lindquist K, Nugent S, Schult T, Lee SJ, Casadei MA, et al. Impact of age and comorbidity on colorectal cancer screening among older veterans. Annals of internal medicine. 2009;150(7):465-73.
54. Tardieu E, Manfredi S, Cottet V, Faivre J. Up to what age propose mass screening for colorectal cancer by faecal occult blood test? analysis of a cohort in a well-defined population. Endoscopy. 2019;51(04):ePP81.
55. Dodd RH, Kobayashi LC, von Wagner C. Perceived life expectancy and colorectal cancer screening intentions and behaviour: A population-based UK study. Preventive medicine reports. 2019;16:101002.
56. Wolf AM, Schorling JB. Does informed consent alter elderly patients’ preferences for colorectal cancer screening? Results of a randomized trial. Journal of general internal medicine. 2000;15(1):24-30.
57. Bye WA, Ma C, Nguyen TM, Parker CE, Jairath V, East JE. Strategies for Detecting Colorectal Cancer in Patients with Inflammatory Bowel Disease: A Cochrane Systematic Review and Meta-Analysis. Am J Gastroenterol. 2018 Dec;113(12):1801- 1809. doi: https://www.doi.org/10.1038/s41395-018-0354-7.
58. Giardiello FM, Allen JI, Axilbund JE, Boland CR, Burke CA, Burt RW, et al. Guidelines on genetic evaluation and management of Lynch syndrome: a consensus statement by the US Multi-Society Task Force on Colorectal Cancer. Diseases of the colon and rectum. 2014;57(8):1025-48.
59. Barreales L, Blasco JA, Sabés R. Eficacia del cribado del cáncer colorrectal (CCR) en familiares asintomáticos de casos. neoplasia. 2005;16:14.
60. Rex DK, Boland CR, Dominitz JA, Giardiello FM, Johnson DA, Kaltenbach T, et al. Colorectal Cancer Screening: Recommendations for Physicians and Patients From the U.S. Multi-Society Task Force on Colorectal Cancer. Gastroenterology. 2017;153(1):307-23.
61. Makkar R, Bo S. Colonoscopic perforation in inflammatory bowel disease. Gastroenterology & hepatology. 2013;9(9):573-83.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


