DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
VERSIÓN CORTA
DESCARGAR
FLUJOGRAMA
vacio
vacio
Ámbito
- La presente guía de práctica clínica tiene como ámbito de aplicación los establecimientos de salud de las Redes Integradas de Salud (RIS), de las Direcciones Regionales de Salud, de las Gerencias Regionales de Salud o las que hagan sus veces a nivel regional, que realicen diagnóstico con confirmación anátomo – patológica y/o estadiaje de cáncer de mama. Así mismo, servirá como referente para los demás establecimientos de salud del Seguro Social de Salud (EsSalud), de las Instituciones Armadas, de la Policía Nacional del Perú, así como para los establecimientos de salud privados y otros prestadores que brinden atenciones de salud en todo el país.
Población y alcance
- Población: Mujeres con sospecha de cáncer de mama, con o sin tamizaje de cáncer de mama previo.
- Usuarios: La guía está dirigida a todo el personal de salud que tenga a su cargo la atención en diagnóstico y estadiaje de cáncer de mama: médicos generales, oncólogos médicos, cirujanos oncólogos, gineco-obstetras, internistas, u otro profesional de la salud, así como profesionales gestores responsables de tomar decisiones a nivel institucional, regional o nacional, con el fin de facilitar el proceso de implementación.
Autores
Grupo elaborador
Líder del Grupo Elaborador de la GPC:
- Jorge Antonio Dunstan Yataco
Médico especialista en Cirugía General y Oncológica. Departamento de Cirugía de Mamas y Tejidos Blandos, Instituto Nacional de Enfermedades Neoplásicas.
Expertos Clínicos Participantes en Todas las Etapas del Desarrollo de la GPC:
- Nelly Rosa Alcántara Velezmoro
Médica especialista en Radiología. Hospital Central FAP “Comandante FAP Médico Juan Benavides Dorich”. - Sussy Alvis Zúñiga
Médica especialista en Radiología. Centro Médico Naval “Cirujano Mayor Santiago Távara”. - Mercedes del Pilar Bravo Taxones
Médica especialista en Patología Oncológica. Instituto Nacional de Enfermedades Neoplásicas. - Gabriela Guadalupe Calderón Valencia
Médica especialista en Cirugía Oncológica de Mamas, Tejidos Blandos y Piel. Sociedad Peruana de Mastología. - Carlos Arturo Castañeda Altamirano
Médico especialista en Oncología Médica. Instituto Nacional de Enfermedades Neoplásicas. - José Antonio Galarreta Zegarra
Médico especialista en Cirugía General y Oncológica. Instituto Nacional de Enfermedades Neoplásicas. - María del Carmen Kapsoli Sánchez
Médica especialista en Anatomía Patológica. Hospital Nacional Edgardo Rebagliati Martins – EsSalud. - Rosa Margarita Laimes Yáñez
Médica especialista en Radiología. Hospital Nacional Cayetano Heredia. - Jackeline Narciza Limas Cline de Reiter
Médica especialista en Radiología. Hospital Nacional Alberto Sabogal Sologuren – EsSalud. - Romano José López Palomino
Médico especialista en Cirugía Oncológica de Mamas, Tejidos Blandos y Piel. Hospital Nacional Arzobispo Loayza. - Silvia Patricia Neciosup Delgado
Médica especialista en Oncología Médica. Instituto Nacional de Enfermedades Neoplásicas. - Fiorella Belissa Oré Sánchez
Médica especialista en Cirugía Oncológica de Mamas, Tejidos Blandos y Piel. Instituto Regional de Enfermedades Neoplásicas – Centro. - Lía Pamela Rebaza Vásquez
Médica especialista en Cirugía Oncológica de Mamas, Tejidos Blandos y Piel. Sociedad Peruana de Mastología. - Edgardo Octaviano Salinas Alva
Médico especialista en Oncología Médica. Hospital Nacional Edgardo Rebagliati Martins – EsSalud. - María Isabel Torres Falén
Médica especialista en Radiología. Instituto Nacional de Enfermedades Neoplásicas. - Fernando Segundo Valencia Juárez
Médico especialista en Medicina General y Oncológica. Instituto Regional de Enfermedades Neoplásicas – Sur.
Expertos Clínicos Invitados para el Ajuste Técnico de la GPC:
- Luz Marina Portugal Rojas
Médica especialista en Radiología. Sociedad Peruana de Radiología. - Rolig Abad Aliaga Chávez
Médico especialista en Oncología Médica. Director del Centro Editorial del Colegio Médico del Perú. - Joan Manuel Moreno Luján
Médico especialista en Oncología Médica. Instituto Regional de Enfermedades Neoplásicas – Norte. - Gelber Raúl Eguiluz Rodríguez
Médico especialista en Cirugía Oncológica de Mamas, Tejidos Blandos y Piel. Instituto Regional de Enfermedades Neoplásicas – Sur. - Jesús Alberto Valer Benavides
Médico especialista en Cirugía Oncológica de Mamas, Tejidos Blandos y Piel. Instituto Regional de Enfermedades Neoplásicas – Centro. - Domingo Antonio Morales Luna
Médico especialista en Anatomía Patológica. Hospital Nacional Hipólito Unanue. - Yanet Yesica Arce Villavicencio
Médica especialista en Anatomía Patológica. Instituto Regional de Enfermedades Neoplásicas – Centro.
Gestores Invitados para el Ajuste Técnico de la GPC:
- Jessy Lu Chang Chang
Obstetra. Dirección de Prevención y Control de Cáncer (DPCAN) – MINSA. - Cristian Alberto Pino Melliz
Enfermero, Magister en Gestión de los Servicios de la Salud. Departamento de Normatividad, Calidad y Control Nacional de Servicios Oncológicos. Instituto Nacional de Enfermedades Neoplásicas. - Jorge Elías Cabello Gómez
Médico. Gerencia Central de Seguros y Prestaciones Económicas (GCAA) – EsSalud.
Metodólogos:
- Stefany Salvador Salvador
Obstetra. Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Aurora Elizabeth Medina Pérez
Obstetra. Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Jean Franco Rodríguez Alarcón
Médico. Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Jhoselyn Cavero O’Higgins
Economista. Equipo de Evaluaciones Económicas y Costos de la GPC. Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Stefanny María Huamán Camacho
Economista. Equipo de Evaluaciones Económicas y Costos de la GPC. Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud. - Stefany Sandra Fernández Ortiz
Economista. Equipo de Evaluaciones Económicas y Costos de la GPC. Centro de Evaluación de Tecnologías en Salud, Instituto Nacional de Salud.
Revisores:
- Henry Leónidas Gómez Moreno
Médico especialista en Medicina General y Oncología. Doctor en Medicina. Miembro de la Academia Nacional de Medicina. Instituto de Investigaciones de Ciencias Biomédicas, Universidad Ricardo Palma. - Rolando Henry Guerra Miller
Médico especialista en Anatomía Patológica. Maestro Latinoamericano de Mastología, Federación Latinoamericana de Mastología. Sociedad Peruana de Mastología. Sociedad Peruana de Cancerología. Asociación Peruana de Patólogos. - Jorge Luis Huayanay Espinoza
Médico especialista en Radiología. Departamento de Radiodiagnóstico, Instituto Nacional de Enfermedades Neoplásicas. - Marcia Carrasco Collantes
Médica especialista en Cirugía Oncológica de Mamas, Tejidos Blandos y Piel. Departamento de Oncología, Hospital Santa Rosa.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
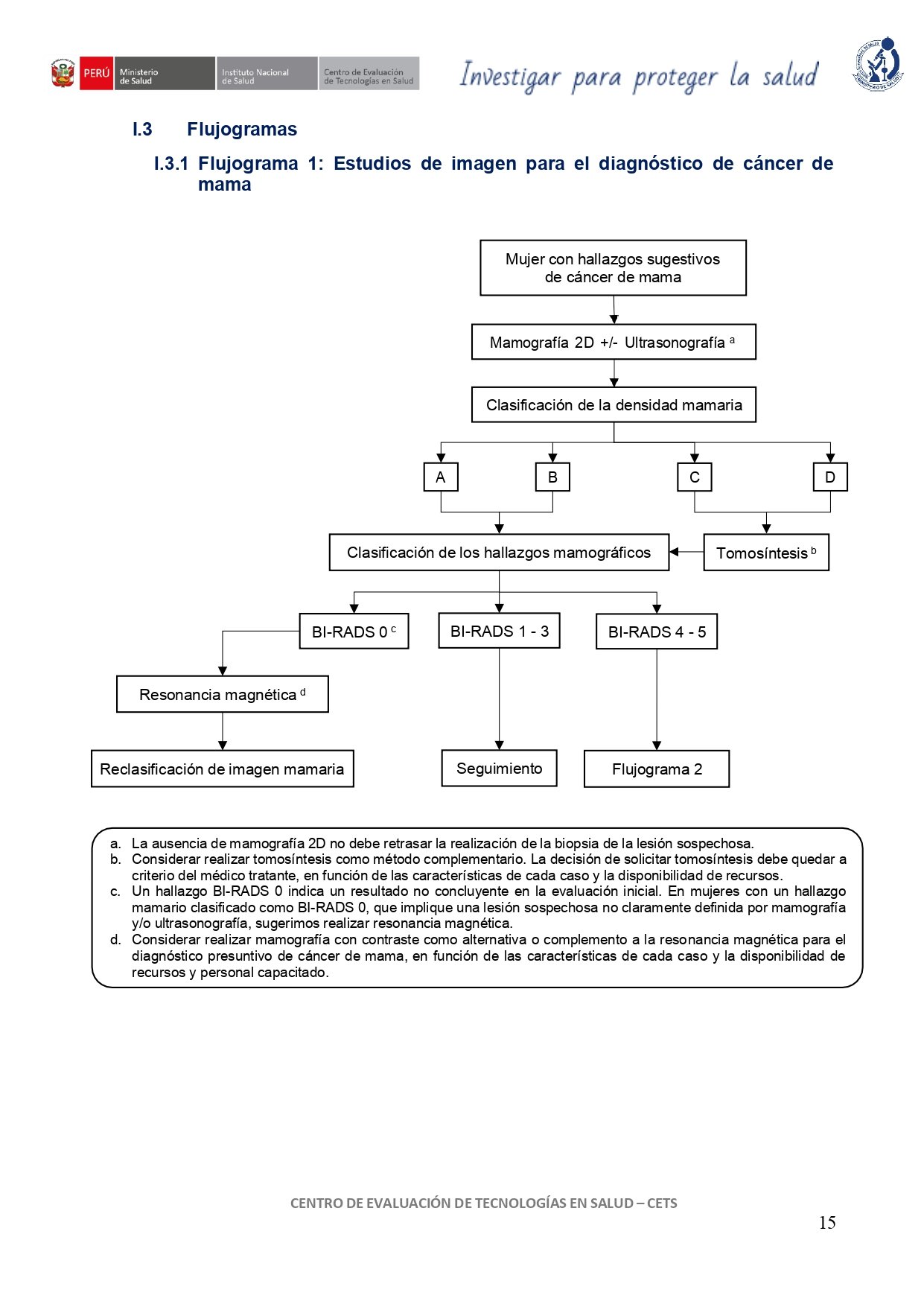

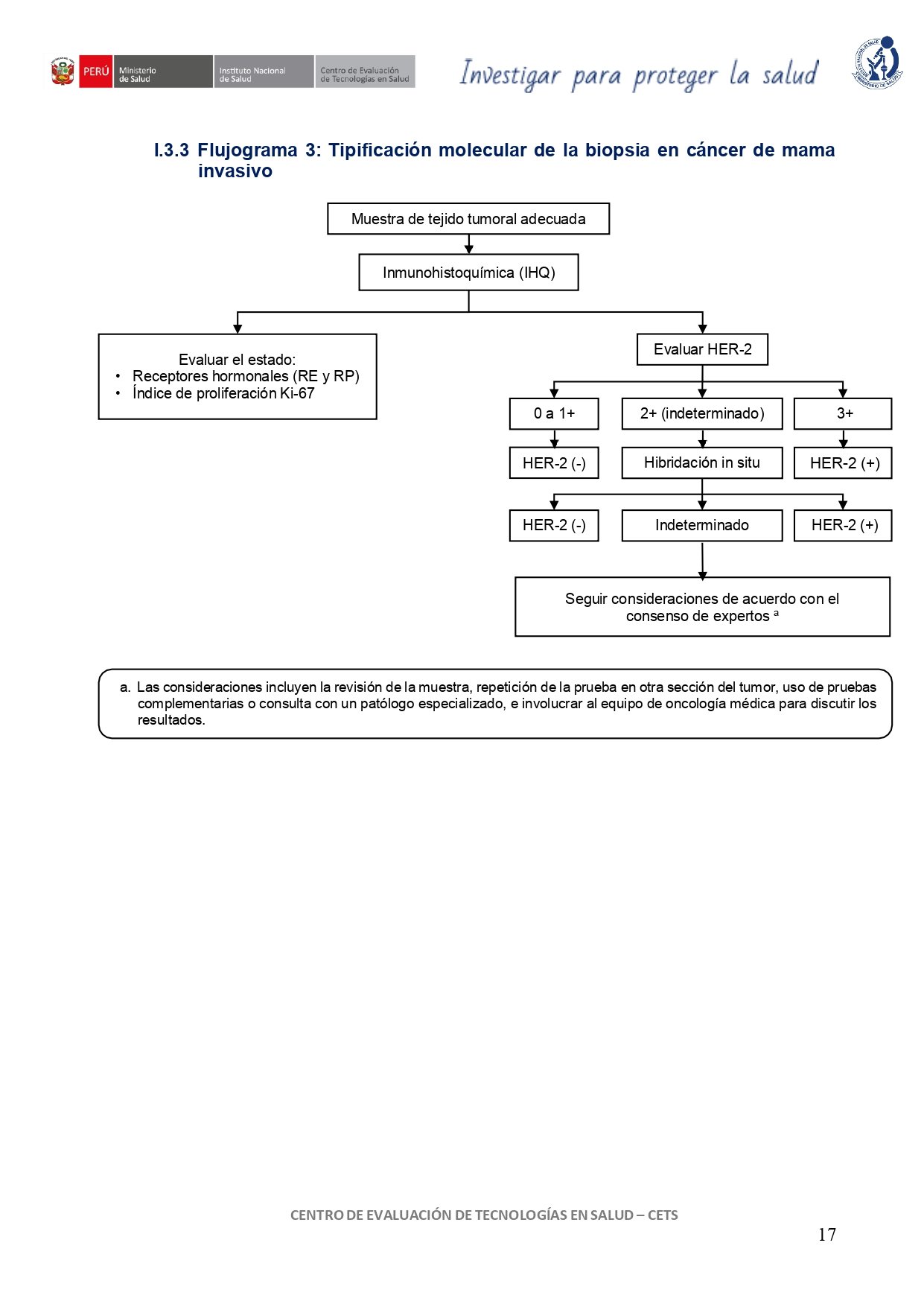
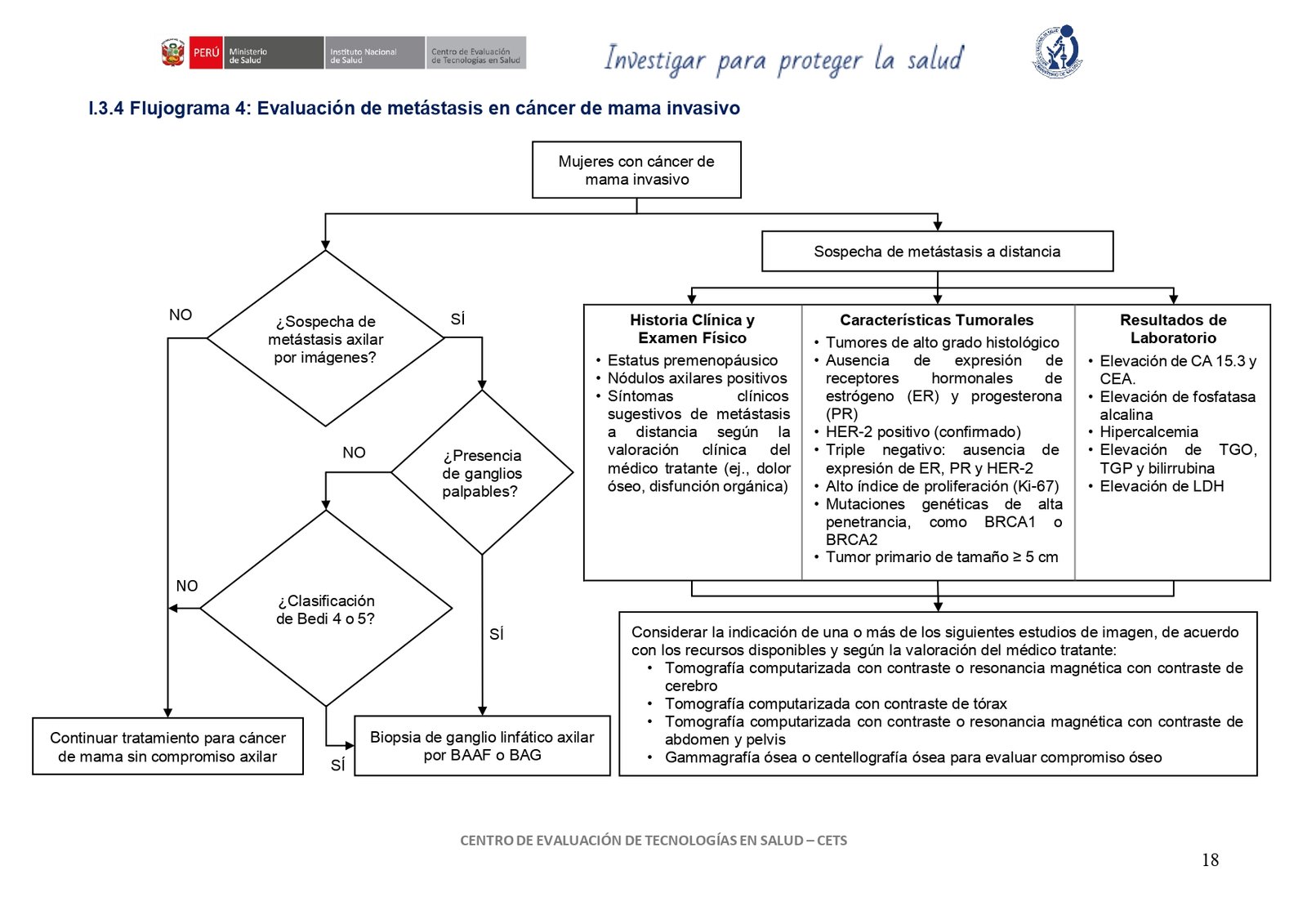
vacio
vacio
1. Mamografía 2D + ultrasonografía
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con hallazgos sugestivos de cáncer de mama, sugerimos realizar mamografía 2D en combinación con ultrasonografía para el diagnóstico presuntivo de cáncer de mama.
(Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con hallazgos sugestivos de cáncer de mama detectados mediante ultrasonografía (BI-RADS 4-5), considerar realizar mamografía antes de proceder a la biopsia, con el fin de identificar posibles lesiones adicionales no visualizadas en la ultrasonografía. Sin embargo, la ausencia de mamografía 2D no debe retrasar la realización de la biopsia de la lesión sospechosa.
BPC 2:
En mujeres con hallazgos sugestivos de cáncer de mama detectados mediante mamografía (BI-RADS 4-5), considerar realizar ultrasonografía antes de proceder a la biopsia. No obstante, si los hallazgos de la ultrasonografía no se correlacionan con los obtenidos en la mamografía 2D, esta discrepancia no debe contraindicar la biopsia de la anomalía detectada en la mamografía.
2. Tomosíntesis vs. mamografía 2D
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con mamas densas y hallazgos sugestivos de cáncer de mama, sugerimos realizar tomosíntesis para el diagnóstico presuntivo de cáncer de mama.
(Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con densidad mamaria aumentada (categoría C o D) y sospecha de cáncer de mama debido a la presencia de lesiones de tejidos blandos y/o calcificaciones observadas en una mamografía 2D previa, considerar realizar tomosíntesis como método complementario. Esta técnica permite visualizar detalles adicionales que pueden no ser detectables en la mamografía convencional, al reducir la superposición de tejidos en mamas densas.
3. RM vs. mamografía (BI-RADS 0)
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con un hallazgo mamario clasificado como BI-RADS 0, que implique una lesión sospechosa no claramente definida por mamografía y/o ultrasonografía, sugerimos realizar resonancia magnética con contraste para el diagnóstico presuntivo de cáncer de mama.
(Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con un hallazgo mamario clasificado como BI-RADS 0, considerar realizar mamografía con contraste como alternativa o complemento a la resonancia magnética para el diagnóstico presuntivo de cáncer de mama, en función de las características de cada caso y la disponibilidad de recursos y personal capacitado.
4. Biopsia gruesa guiada (visibles)
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con una lesión mamaria sospechosa, palpable o no palpable, y visible mediante ultrasonografía, sugerimos realizar biopsia con aguja gruesa guiada por ultrasonografía para el diagnóstico de cáncer de mama.
(Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con una lesión mamaria sospechosa, en caso de no disponer de biopsia con aguja gruesa, considerar métodos alternativos de biopsia. La elección del método debe ser determinada por el médico tratante, considerando factores como las características de la lesión y los recursos disponibles.
5. BAV vs. gruesa (sospechosas)
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con lesión sospechosa visible mediante mamografía, sugerimos realizar biopsia asistida por vacío o biopsia con aguja gruesa para el diagnóstico de cáncer de mama. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con microcalcificaciones visibles en mamografía, considerar realizar biopsia asistida por vacío guiada por estereotaxia para una mejor caracterización de la lesión.
BPC 2:
En mujeres con microcalcificaciones visibles en mamografía, en caso de no contar con disponibilidad de biopsia asistida por vacío guiada por estereotaxia, considerar realizar la biopsia quirúrgica con localización por arpón para la evaluación de las microcalcificaciones.
6. IHQ vs. HIS (HER-2)
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de mama, sugerimos utilizar la prueba de inmunohistoquímica (IHQ) para determinar el estado de HER-2.
(Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
En mujeres con cáncer de mama con un resultado 2+ (inequívoco o indeterminado) en la prueba de inmunohistoquímica (IHQ), considerar realizar una prueba confirmatoria de hibridación in situ (HIS).
BPC 2:
En mujeres con cáncer de mama, considerar la evaluación del estado de HER-2, receptor de estrógeno (RE), receptor de progesterona (RP) y el índice de proliferación Ki-67 para determinar el subtipo molecular.
7. Biopsia axilar guiada (metástasis)
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de mama invasivo y sospecha de metástasis axilar por estudios de imagen, sugerimos realizar biopsia de ganglio linfático axilar guiada por ultrasonografía para determinar el compromiso ganglionar.
(Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con cáncer de mama y axila clínicamente negativa, considerar realizar biopsia percutánea (BAAF o BAG) guiada por ultrasonografía si se identifica un ganglio linfático axilar sospechoso clasificado como tipo 4 o 5 en la clasificación de Bedi.
Referencias bibliográficas
1. Institute for Health Metrics and Evaluation. IHME. [citado 23 de septiembre de 2024]. Breast cancer – Level 3 cause. Disponible en: https://www.healthdata.org/research- analysis/diseases-injuries-risks/factsheets/2021-breast-cancer-level-3-disease
2. Wilkinson L, Gathani T. Understanding breast cancer as a global health concern. Br J Radiol. 2022;95(1130):e45.
3. Organización Panamericana de la Salud. Cáncer de mama – OPS/OMS [Internet]. 2024 [citado 23 de septiembre de 2024]. Disponible en: https://www.paho.org/es/temas/cancer- mama
4. The International Agency for Research on Cancer (IARC). Global Cancer Observatory [Internet]. [citado 23 de septiembre de 2024]. Disponible en: https://gco.iarc.fr/
5. Instituto Nacional de Enfermedades Neoplasicas. Datos Epidemiologicos [Internet]. INEN. 2019 [citado 23 de septiembre de 2024]. Disponible en: https://portal.inen.sld.pe/indicadores-anuales-de-gestion-produccion-hospitalaria/
6. World Health Organization. WHO. 2024 [citado 23 de septiembre de 2024]. The Global Breast Cancer Initiative. Disponible en: https://www.who.int/initiatives/global-breast- cancer-initiative
7. Nicolis O, De Los Angeles D, Taramasco C. A contemporary review of breast cancer risk factors and the role of artificial intelligence. Front Oncol. 2024;14:1356014.
8. Kellen E, Vansant G, Christiaens MR, Neven P, Van Limbergen E. Lifestyle changes and breast cancer prognosis: a review. Breast Cancer Res Treat. 2009;114(1):13-22.
9. Lofterød T, Frydenberg H, Flote V, Eggen AE, McTiernan A, Mortensen ES, et al. Exploring the effects of lifestyle on breast cancer risk, age at diagnosis, and survival: the EBBA-Life study. Breast Cancer Res Treat. 2020;182(1):215-27.
10. Zhao J, Xu L, Sun J, Song M, Wang L, Yuan S, et al. Global trends in incidence, death, burden and risk factors of early-onset cancer from 1990 to 2019. BMJ Oncol. 2023;2(1):e000049.
11. Taylor C, McGale P, Probert J, Broggio J, Charman J, Darby SC, et al. Breast cancer mortality in 500 000 women with early invasive breast cancer diagnosed in England, 1993- 2015: population based observational cohort study. BMJ. 2023;381:e074684.
12. Abdul Rahman H, Zaim SNN, Suhaimei US, Jamain AA. Prognostic Factors Associated with Breast Cancer-Specific Survival from 1995 to 2022: A Systematic Review and Meta- Analysis of 1,386,663 Cases from 30 Countries. Dis Basel Switz. 2024;12(6):111.
13. Torres-Roman JS, Martinez-Herrera JF, Carioli G, Ybaseta-Medina J, Valcarcel B, Pinto JA, et al. Breast cancer mortality trends in Peruvian women. BMC Cancer. 2020;20(1):1173.
14. Aklilu S, Bain C, Bansil P, de Sanjose S, Dunstan JA, Castillo V, et al. Evaluation of diagnostic ultrasound use in a breast cancer detection strategy in Northern Peru. PloS One. 2021;16(6):e0252902.
15. Zelle SG, Vidaurre T, Abugattas JE, Manrique JE, Sarria G, Jeronimo J, et al. Cost- effectiveness analysis of breast cancer control interventions in Peru. PloS One. 2013;8(12):e82575.
16. Yamaguchi Díaz LP, Huayanay Falconi L, Ypanaque Luyo P, Chávez Peralta B, Dueñas del Rosario NP, Villar Lopez A, et al. Documento técnico: Metodología para la elaboración de guías de práctica clínica [Internet]. Ministerio de Salud; 2015. Disponible en: https://www.gob.pe/institucion/minsa/informes-publicaciones/314118-documento- tecnico-metodologia-para-la-elaboracion-de-guias-de-practica-clinica
17. National Institute for Health and Care Excellence. Early and locally advanced breast cancer: diagnosis and management [Internet]. NICE; 2024. Disponible en: https://www.nice.org.uk/guidance/ng101
18. Salinas Alva EO, Alarcón Rozas AE, Auqui Flores R, Carnero Fuentes OF, Castro Vela DE, Nieto Gutierrez WC, et al. Guía de Práctica Clínica para el Diagnóstico y Manejo de Cáncer de Mama HER-2 positivo no metastásico [Internet]. Instituto de Evaluación de
Tecnologías en Salud e Investigación (IETSI); 2021. Disponible en: https://ietsi.essalud.gob.pe/wp-content/uploads/2021/12/GPC-Ca-de-mama-HER-2- positivo-no-metastasico_V.-Ext-Anexos.pdf
19. Perry Perry F, García Angulo OA, Díaz Casas SE, Guzman Abi-Saab LH, Aristizabal JÁ, Lehman C, et al. Guía de práctica clinica (GPC) para la detección temprana, tratamiento integral, seguimiento y rehabilitación del cáncer de mama. Instituto Nacional de Cancerología – ESE; 2013.
20. Buehler AM, Ascef B de O, Oliveira Júnior HA de, Ferri CP, Fernandes JG. Rational use of diagnostic tests for clinical decision making. Rev Assoc Medica Bras 1992. 2019;65(3):452-9.
21. Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ. 2017;358:j4008.
22. Higgins JPT, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
23. Whiting PF, Rutjes AWS, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS- 2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155(8):529-36.
24. Yang B, Mustafa RA, Bossuyt PM, Brozek J, Hultcrantz M, Leeflang MMG, et al. GRADE Guidance: 31. Assessing the certainty across a body of evidence for comparative test accuracy. J Clin Epidemiol. 2021;136:146-56.
25. Schünemann H, Brozek J, Guyatt G, Oxman A. Manual GRADE para calificar la calidad de la evidencia y la fuerza de la recomendación (1a Ed. en español) [Internet]. GRADE; 2017. Disponible en: http://gdt.guidelinedevelopment.org/app/handbook/handbook.html
26. World Health Organization. WHO handbook for guideline development, 2nd Edition. WHO; 2014.
27. Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation-determinants of a recommendation’s direction and strength. J Clin Epidemiol. 2013;66(7):726-35.
28. Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. Marcos GRADE de la evidencia a la decisión (EtD): un enfoque sistemático y transparente para tomar decisiones sanitarias bien informadas. 1: Introducción. Gac Sanit. 2018;32(2):166.e1-166.e10.
29. Guyatt G, Oxman AD, Sultan S, Brozek J, Glasziou P, Alonso-Coello P, et al. GRADE guidelines: 11. Making an overall rating of confidence in effect estimates for a single outcome and for all outcomes. J Clin Epidemiol. 2013;66(2):151-7.
30. Dewidar O, Lotfi T, Langendam MW, Parmelli E, Saz Parkinson Z, Solo K, et al. Good or best practice statements: proposal for the operationalisation and implementation of GRADE guidance. BMJ Evid-Based Med. 2023;28(3):189-96.
31. Pace LE, Keating NL. A systematic assessment of benefits and risks to guide breast cancer screening decisions. JAMA. 2014;311(13):1327-35.
32. Lauby-Secretan B, Scoccianti C, Loomis D, Benbrahim-Tallaa L, Bouvard V, Bianchini F, et al. Breast-Cancer Screening — Viewpoint of the IARC Working Group. N Engl J Med. 2015;372(24):2353-8.
33. Myers ER, Moorman P, Gierisch JM, Havrilesky LJ, Grimm LJ, Ghate S, et al. Benefits and Harms of Breast Cancer Screening: A Systematic Review. JAMA. 2015;314(15):1615- 34.
34. International Agency for Research on Cancer. Breast Cancer Screening [Internet]. [citado
23 de septiembre de 2024]. (IARC Publications; vol. 15). Disponible en: https://publications.iarc.fr/Book-And-Report-Series/Iarc-Handbooks-Of-Cancer- Prevention/Breast-Cancer-Screening-2016
35. Nelson HD, Fu R, Cantor A, Pappas M, Daeges M, Humphrey L. Effectiveness of Breast Cancer Screening: Systematic Review and Meta-analysis to Update the 2009 U.S. Preventive Services Task Force Recommendation. Ann Intern Med. 2016;164(4):244-55.
36. Perry Perry F, García Angulo OA, Díaz Casas SE, Guzman Abi-Saab LH, Aristizabal JÁ, Lehman C, et al. Guía de práctica clinica (GPC) para la detección temprana, tratamiento integral, seguimiento y rehabilitación del cáncer de mama. Instituto Nacional de Cancerología – ESE; 2013.
37. Schünemann HJ, Lerda D, Quinn C, Follmann M, Alonso-Coello P, Rossi PG, et al. Breast Cancer Screening and Diagnosis: A Synopsis of the European Breast Guidelines. Ann Intern Med. 2020;172(1):46-56.
38. Loibl S, André F, Bachelot T, Barrios CH, Bergh J, Burstein HJ, et al. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol Off J Eur Soc Med Oncol. 2024;35(2):159-82.
39. National Institute for Health and Care Excellence. Early and locally advanced breast cancer: diagnosis and management [Internet]. London: National Institute for Health and Care Excellence (NICE); 2024 [citado 23 de septiembre de 2024]. (National Institute for Health and Care Excellence: Guidelines). Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK519155/
40. D’Orsi CJ, Sickles EA, Mendelson EB, Morris EA. ACR BI-RADS Atlas: Breast Imaging Re-porting and Data System. American College of Radiology; 2013.
41. Berg WA, Blume JD, Cormack JB, Mendelson EB, Lehrer D, Böhm-Vélez M, et al. Combined screening with ultrasound and mammography vs mammography alone in women at elevated risk of breast cancer. JAMA. 2008;299(18):2151-63.
42. Ohuchi N, Suzuki A, Sobue T, Kawai M, Yamamoto S, Zheng YF, et al. Sensitivity and specificity of mammography and adjunctive ultrasonography to screen for breast cancer in the Japan Strategic Anti-cancer Randomized Trial (J-START): a randomised controlled trial. Lancet Lond Engl. 2016;387(10016):341-8.
43. Tadesse GF, Tegaw EM, Abdisa EK. Diagnostic performance of mammography and ultrasound in breast cancer: a systematic review and meta-analysis. J Ultrasound. 2023;26(2):355-67.
44. Hardy JR, Powles TJ, Judson I, Heron C, Williams M, Cherryman G, et al. How many tests are required in the diagnosis of palpable breast abnormalities? Clin Oncol R Coll Radiol G B. 1990;2(3):148-52.
45. Ozdemir A, Oznur II, Vural G, Atasever T, Karabacak NI, Gökçora N, et al. Tl-201 scintigraphy, mammography and ultrasonography in the evaluation of palpable and nonpalpable breast lesions: a correlative study. Eur J Radiol. 1997;24(2):145-54.
46. Skaane P, Engedal K, Skjennald A. Interobserver variation in the interpretation of breast imaging. Comparison of mammography, ultrasonography, and both combined in the interpretation of palpable noncalcified breast masses. Acta Radiol Stockh Swed 1987. 1997;38(4 Pt 1):497-502.
47. Zonderland HM, Coerkamp EG, Hermans J, van de Vijver MJ, van Voorthuisen AE. Diagnosis of breast cancer: contribution of US as an adjunct to mammography. Radiology. 1999;213(2):413-22.
48. Moss HA, Britton PD, Flower CD, Freeman AH, Lomas DJ, Warren RM. How reliable is modern breast imaging in differentiating benign from malignant breast lesions in the symptomatic population? Clin Radiol. 1999;54(10):676-82.
49. Gupta R, Collier D, Abdeen S, Roberts L, Hussein AYT, Al-Bader I, et al. Usefulness of scintimammography as an adjunct to mammography and ultrasound in the diagnosis of breast diseases. Australas Radiol. 2006;50(6):539-42.
50. Taylor KJW, Merritt C, Piccoli C, Schmidt R, Rouse G, Fornage B, et al. Ultrasound as a complement to mammography and breast examination to characterize breast masses. Ultrasound Med Biol. 2002;28(1):19-26.
51. Stavros AT, Thickman D, Rapp CL, Dennis MA, Parker SH, Sisney GA. Solid breast nodules: use of sonography to distinguish between benign and malignant lesions. Radiology. 1995;196(1):123-34.
52. Wöckel A, Albert US, Janni W, Scharl A, Kreienberg R, Stüber T. The Screening, Diagnosis, Treatment, and Follow-Up of Breast Cancer. Dtsch Ärztebl Int. 2018;115(18):316-23.
53. Wöckel A, Kreienberg R, Brust K, Engel J, Hölzel D, Fehm T, et al. Evidence-based Guideline for the Early Detection, Diagnosis, Treatment and Follow-up of Breast Cancer. German Guideline Program in Oncology (GGPO); 2021.
54. Ojeda Delgado L, Rodríguez Pino MY, Valladares Valle M, Díaz Yanes NM. Contribución de los estudios por imágenes en el diagnóstico de cáncer de mama. Rev Finlay. 2021;11(4):423-35.
55. Gartlehner G, Thaler KJ, Chapman A, Kaminski A, Berzaczy D, Van Noord MG, et al. Adjunct ultrasonography for breast cancer screening in women at average risk: a systematic review. Int J Evid Based Healthc. 2013;11(2):87-93.
56. Rocha García AM, Mera Fernández D. Breast tomosynthesis: state of the art. Radiologia. 2019;61(4):274-85.
57. Elizalde Pérez A. Tomosíntesis mamaria: bases físicas, indicaciones y resultados. Rev Senol Patol Mamar. 1 de enero de 2015;28(1):39-45.
58. Palazuelos G, Trujillo S, Romero J. Tomosíntesis: la nueva era de la mamografía. Rev Colomb Radiol. 2014;25(2):3926-33.
59. Sentís i Crivellé M. La densidad mamaria. Una aproximación. Rev Senol Patol Mamar – :J Senol Breast Dis. 1 de julio de 2014;27(3):138-42.
60. Chae EY, Kim HH, Cha JH, Shin HJ, Choi WJ. Detection and characterization of breast lesions in a selective diagnostic population: diagnostic accuracy study for comparison between one-view digital breast tomosynthesis and two-view full-field digital mammography. Br J Radiol. 2016;89(1062):20150743.
61. Torres Tabanera M. Novedades de la 5.a edición del sistema breast imaging reporting and data system (BI-RADS®) del Colegio Americano de Radiología. Rev Senol Patol Mamar – J Senol Breast Dis. 2016;29(1):32-9.
62. Garza-Rugerio G, Muñoz-Ahuatzin N, León-Vázquez M de la L, Maycotte-González P, Seefoó-Jarquín P. BIRADS 0 patient reclassification in a first-level of care unit. Rev Medica Inst Mex Seguro Soc. 2024;62(1):1-7.
63. Arteaga-Huanca V, Loo M, Loo H, Cedillo-Ramirez L. Asociación entre características de las calcificaciones mamográficas y neoplasia maligna en un hospital nacional, 2017. Rev Fac Med Humana. 2020;20(1):70-5.
64. Geva T. Magnetic resonance imaging: historical perspective. J Cardiovasc Magn Reson Off J Soc Cardiovasc Magn Reson. 2006;8(4):573-80.
65. Prasad A. Beyond Modern vs Alternative Science Debate: Analysis of Magnetic Resonance Imaging Research. Econ Polit Wkly. 2006;41(3):219-27.
66. Soto A. Barreras para una atención eficaz en los hospitales de referencia del Ministerio de Salud del Perú: atendiendo pacientes en el siglo XXI con recursos del siglo XX. Rev Peru Med Exp Salud Publica. 2019;36(2):304-11.
67. Dromain C, Balleyguier C, Adler G, Garbay JR, Delaloge S. Contrast-enhanced digital mammography. Eur J Radiol. 2009;69(1):34-42.
68. Cozzi A, Magni V, Zanardo M, Schiaffino S, Sardanelli F. Contrast-enhanced Mammography: A Systematic Review and Meta-Analysis of Diagnostic Performance. Radiology. 2022;302(3):568-81.
69. Gelardi F, Ragaini EM, Sollini M, Bernardi D, Chiti A. Contrast-Enhanced Mammography versus Breast Magnetic Resonance Imaging: A Systematic Review and Meta-Analysis. Diagn Basel Switz. 2022;12(8):1890.
70. Ohashi A, Kataoka M, Iima M, Honda M, Ota R, Urushibata Y, et al. Comparison of Ultrafast Dynamic Contrast-Enhanced (DCE) MRI with Conventional DCE MRI in the Morphological Assessment of Malignant Breast Lesions. Diagn Basel Switz. 2023;13(6):1105.
71. Berg WA, Bandos AI, Zuley ML, Waheed UX. Training Radiologists to Interpret Contrast- enhanced Mammography: Toward a Standardized Lexicon. J Breast Imaging. 2021;3(2):176-89.
72. Rao AA, Feneis J, Lalonde C, Ojeda-Fournier H. A Pictorial Review of Changes in the BI- RADS Fifth Edition. Radiogr Rev Publ Radiol Soc N Am Inc. 2016;36(3):623-39.
73. Mai E, Acosta P, Strada C, Bértoli M, Cabrera J. Relación entre hallazgos imageonológicas y resultados histopatológicos de lesiones mamarias biopsiadas con aguja gruesa. Rev Argent Mastol. 2020;39(141):15-33.
74. González M. P, Taub E. T, López P. A. Biopsias percutáneas de mama: biopsia core y biopsia estereotáxica digital. Rev Hosp Clin Univ Chile. 2006;17(4):311-6.
75. Gómez-Espinosa F, Onofre-Castillo J, Putz-Botello M. Correlación de hallazgos histopatológicos entre biopsias percutáneas guiadas por métodos de imagen y biopsia excisional en patología de la mama. Rev An Radiol México. 2020;19(4):20000216.
76. Wu YC, Chen DR, Kuo SJ. Personal experience of ultrasound-guided 14-gauge core biopsy of breast tumor. Eur J Surg Oncol J Eur Soc Surg Oncol Br Assoc Surg Oncol. 2006;32(7):715-8.
77. Yeow KM, Lo YF, Wang CS, Chang HK, Tsai CS, Hsueh C. Ultrasound-guided core needle biopsy as an initial diagnostic test for palpable breast masses. J Vasc Interv Radiol JVIR. 2001;12(11):1313-7.
78. Vega Bolívar A, Alonso-Bartolomé P, Ortega García E, Garijo Ayensa F. Ultrasound- guided core needle biopsy of non-palpable breast lesions: a prospective analysis in 204 cases. Acta Radiol Stockh Swed 1987. 2005;46(7):690-5.
79. Garg S, Mohan H, Bal A, Attri AK, Kochhar S. A comparative analysis of core needle biopsy and fine-needle aspiration cytology in the evaluation of palpable and mammographically detected suspicious breast lesions. Diagn Cytopathol. 2007;35(11):681-9.
80. Brancato B, Crocetti E, Bianchi S, Catarzi S, Risso GG, Bulgaresi P, et al. Accuracy of needle biopsy of breast lesions visible on ultrasound: audit of fine needle versus core needle biopsy in 3233 consecutive samplings with ascertained outcomes. Breast Edinb Scotl. 2012;21(4):449-54.
81. Lai HW, Wu HK, Kuo SJ, Chen ST, Tseng HS, Tseng LM, et al. Differences in accuracy and underestimation rates for 14- versus 16-gauge core needle biopsies in ultrasound- detectable breast lesions. Asian J Surg. 2013;36(2):83-8.
82. Pina L, Apesteguía L, Luis E de, Sáenz Bañuelos J, Zornoza G, Domínguez Cunchillos F. Técnicas de biopsia para el diagnóstico de lesiones mamarias no palpables. An Sist Sanit Navar. 2004;27(3):345-58.
83. Canadian Association of Radiation Oncologists. The palpable breast lump: information and recommendations to assist decision-making when a breast lump is detected. The Steering Committee on Clinical Practice Guidelines for the Care and Treatment of Breast Cancer. CMAJ Can Med Assoc J J Assoc Medicale Can. 1998;158(Suppl 3):S3-8.
84. Dershaw DD, Liberman L. Stereotactic breast biopsy: indications and results. Oncol Williston Park N. 1998;12(6):907-16.
85. Park HL, Hong J. Vacuum-assisted breast biopsy for breast cancer. Gland Surg. 2014;3(2):120-7.
86. Sun C, Lu Q, Zhang X, Zhang Y, Jia S, Wang J, et al. Comparison between core needle biopsy and excisional biopsy for breast neoplasm. Medicine (Baltimore). 2021;100(34):e26970.
87. Yu YH, Liang C, Yuan XZ. Diagnostic value of vacuum-assisted breast biopsy for breast carcinoma: a meta-analysis and systematic review. Breast Cancer Res Treat. 2010;120(2):469-79.
88. Dowlatshahi K, Yaremko ML, Kluskens LF, Jokich PM. Nonpalpable breast lesions: findings of stereotaxic needle-core biopsy and fine-needle aspiration cytology. Radiology. diciembre de 1991;181(3):745-50.
89. Frazee RC, Roberts JW, Symmonds RE, Snyder SK, Hendricks JC, Smith RW, et al. Open versus stereotactic breast biopsy. Am J Surg. 1996;172(5):491-3.
90. Cangiarella JF, Waisman J, Weg N, Tata M, Gross J, Symmans WF. The Use of Stereotaxic Core Biopsy and Stereotaxic Aspiration Biopsy as Diagnostic Tools in the Evaluation of Mammary Calcification. Breast J. 2000;6(6):366-72.
91. Leifland K, Lagerstedt U, Svane G. Comparison of stereotactic fine needle aspiration cytology and core needle biopsy in 522 non-palpable breast lesions. Acta Radiol Stockh Swed 1987. 2003;44(4):387-91.
92. Fajardo LL, Pisano ED, Caudry DJ, Gatsonis CA, Berg WA, Connolly J, et al. Stereotactic and sonographic large-core biopsy of nonpalpable breast lesions: results of the Radiologic Diagnostic Oncology Group V study. Acad Radiol. 2004;11(3):293-308.
93. Martínez-Ramos D, Laguna JM, Alcalde M, Escrig J, Gomis E, Rivadulla I, et al. Biopsia guiada con arpón en microcalcificaciones de mama. Estudio retrospectivo sobre 256 procedimientos. Rev Senol Patol Mamar Ed Impr. 2009;22(2):47-52.
94. Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987;235(4785):177-82.
95. Ross JS, Fletcher JA. The HER-2/neu oncogene in breast cancer: prognostic factor, predictive factor, and target for therapy. Stem Cells Dayt Ohio. 1998;16(6):413-28.
96. Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med. 2001;344(11):783-92.
97. Perez EA, Romond EH, Suman VJ, Jeong JH, Sledge G, Geyer CE, et al. Trastuzumab plus adjuvant chemotherapy for human epidermal growth factor receptor 2-positive breast cancer: planned joint analysis of overall survival from NSABP B-31 and NCCTG N9831. J Clin Oncol Off J Am Soc Clin Oncol. 2014;32(33):3744-52.
98. Ministerio de Salud. Resolución Ministerial N.° 945-2022-MINSA [Internet]. MINSA; 2022. Disponible en: https://www.gob.pe/institucion/minsa/normas-legales/3684926-945-2022- minsa
99. Wolff AC, Hammond MEH, Schwartz JN, Hagerty KL, Allred DC, Cote RJ, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Arch Pathol Lab Med. 2007;131(1):18-43.
100. Cuadros M, Villegas R. Systematic review of HER2 breast cancer testing. Appl Immunohistochem Mol Morphol AIMM. 2009;17(1):1-7.
101. Bahreini F, Soltanian AR, Mehdipour P. A meta-analysis on concordance between immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH) to detect HER2 gene overexpression in breast cancer. Breast Cancer Tokyo Jpn. 2015;22(6):615-25.
102. Dendukuri N, Khetani K, McIsaac M, Brophy J. Testing for HER2-positive breast cancer: a systematic review and cost-effectiveness analysis. CMAJ Can Med Assoc J J Assoc Medicale Can. 2007;176(10):1429-34.
103. Omurtag A, Fenton AA. Assessing Diagnostic Tests: How to Correct for the Combined Effects of Interpretation and Reference Standard. PLOS ONE. 2012;7(12):e52221.
104. Morgan CJ, Aban I. Methods for evaluating the agreement between diagnostic tests. J Nucl Cardiol. 2016;23(3):511-3.
105. Press MF, Sauter G, Bernstein L, Villalobos IE, Mirlacher M, Zhou JY, et al. Diagnostic evaluation of HER-2 as a molecular target: an assessment of accuracy and reproducibility of laboratory testing in large, prospective, randomized clinical trials. Clin Cancer Res Off J Am Assoc Cancer Res. 2005;11(18):6598-607.
106. Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987;235(4785):177-82.
107. Carlson RW, Moench SJ, Hammond MEH, Perez EA, Burstein HJ, Allred DC, et al. HER2 testing in breast cancer: NCCN Task Force report and recommendations. J Natl Compr Cancer Netw JNCCN. julio de 2006;4(Suppl 3):S1-22.
108. Perou CM, Sørlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, et al. Molecular portraits of human breast tumours. Nature. 2000;406(6797):747-52.
109. Sørlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A. 2001;98(19):10869-74.
110. Andre F, Ismaila N, Allison KH, Barlow WE, Collyar DE, Damodaran S, et al. Biomarkers for Adjuvant Endocrine and Chemotherapy in Early-Stage Breast Cancer: ASCO Guideline Update. J Clin Oncol Off J Am Soc Clin Oncol. 2022;40(16):1816-37.
111. Gradishar WJ, Anderson BO, Balassanian R, Blair SL, Burstein HJ, Cyr A, et al. NCCN Guidelines Insights Breast Cancer, Version 1.2016. J Natl Compr Cancer Netw JNCCN. 2015;13(12):1475-85.
112. Goldhirsch A, Winer EP, Coates AS, Gelber RD, Piccart-Gebhart M, Thürlimann B, et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol Off J Eur Soc Med Oncol. 2013;24(9):2206-23.
113. Press MF, Villalobos I, Santiago A, Guzman R, Cervantes M, Gasparyan A, et al. Assessing the New American Society of Clinical Oncology/College of American Pathologists Guidelines for HER2 Testing by Fluorescence In Situ Hybridization: Experience of an Academic Consultation Practice. Arch Pathol Lab Med. 2016;140(11):1250-8.
114. Wolff AC, Somerfield MR, Dowsett M, Hammond MEH, Hayes DF, McShane LM, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: ASCO-College of American Pathologists Guideline Update. J Clin Oncol Off J Am Soc Clin Oncol. 2023;41(22):3867-72.
115. Huicochea Castellanos S, Gonzales Balboa P, Tovar Calderón IL, Olarte Casas MA, Vásquez Lamadrid JV. Cáncer de mama. An Radiol México. 2009;8(1):117-26.
116. Bedi DG, Krishnamurthy R, Krishnamurthy S, Edeiken BS, Le-Petross H, Fornage BD, et al. Cortical morphologic features of axillary lymph nodes as a predictor of metastasis in breast cancer: in vitro sonographic study. AJR Am J Roentgenol. 2008;191(3):646-52.
117. Xu Q, Wang J, Wang J, Guo R, Qian Y, Liu F. The effectiveness of ultrasound-guided core needle biopsy in detecting lymph node metastases in the axilla in patients with breast cancer: systematic review and meta-analysis. Clinics. 2023;78:100207.
118. Zheng H, Zhao R, Wang W, Liu X, Wang X, Wen C, et al. The accuracy of ultrasound- guided fine-needle aspiration and core needle biopsy in diagnosing axillary lymph nodes in women with breast cancer: a systematic review and meta-analysis. Front Oncol. 2023;13:1166035.
119. Jung SY, Rosenzweig M, Sereika SM, Linkov F, Brufsky A, Weissfeld JL. Factors associated with mortality after breast cancer metastasis. Cancer Causes Control CCC. 2012;23(1):103-12.
120. Balasubramanian I, Fleming CA, Corrigan MA, Redmond HP, Kerin MJ, Lowery AJ. Meta- analysis of the diagnostic accuracy of ultrasound-guided fine-needle aspiration and core needle biopsy in diagnosing axillary lymph node metastasis. Br J Surg. 2018;105(10):1244-53.
121. Colegio Americano de Radiología. Guías de uso apropiado del ACR: Imagenes de axila [Internet]. ACR; 2021. Disponible en: https://acsearch.acr.org/list/PdfView?vendorID=3158165
122. Colegio Americano de Radiología. Guías de uso apropiado del ACR: Imagenes de axila [Internet]. ACR; 2022. Disponible en: https://acsearch.acr.org/list/PdfView?vendorID=3099208
123. Bernet L, Piñero A, Martínez M, Vidal Sicart S, Algara M, Palomares E. Consenso de la Sociedad Española de Senología y Patología Mamaria (SESPM) sobre la biopsia
selectiva del ganglio centinela (BSGC) y el manejo axilar en el cáncer de mama (2022). Rev Senol Patol Mamar Ed Impr. 2022;35:243-59.
124. Gennari A, André F, Barrios CH, Cortés J, de Azambuja E, DeMichele A, et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol Off J Eur Soc Med Oncol. 2021;32(12):1475-95.
125. Anders CK, Johnson R, Litton J, Phillips M, Bleyer A. Breast cancer before age 40 years. Semin Oncol. 2009;36(3):237-49.
126. Assi HA, Khoury KE, Dbouk H, Khalil LE, Mouhieddine TH, El Saghir NS. Epidemiology and prognosis of breast cancer in young women. J Thorac Dis. 2013;5(Suppl 1):S2-8.
127. Davis BW, Gelber RD, Goldhirsch A, Hartmann WH, Locher GW, Reed R, et al. Prognostic significance of tumor grade in clinical trials of adjuvant therapy for breast cancer with axillary lymph node metastasis. Cancer. 1986;58(12):2662-70.
128. Paluch-Shimon S, Ben-Baruch N, Wolf I, Zach L, Kopolovic J, Kruglikova A, et al. Hormone receptor expression is associated with a unique pattern of metastatic spread and increased survival among HER2-overexpressing breast cancer patients. Am J Clin Oncol. 2009;32(5):504-8.
129. Freudenberg JA, Wang Q, Katsumata M, Drebin J, Nagatomo I, Greene MI. The role of HER2 in early breast cancer metastasis and the origins of resistance to HER2-targeted therapies. Exp Mol Pathol. 2009;87(1):1-11.
130. Dent R, Hanna WM, Trudeau M, Rawlinson E, Sun P, Narod SA. Pattern of metastatic spread in triple-negative breast cancer. Breast Cancer Res Treat. 2009;115(2):423-8.
131. Yin Y, Zeng K, Wu M, Ding Y, Zhao M, Chen Q. The levels of Ki-67 positive are positively associated with lymph node metastasis in invasive ductal breast cancer. Cell Biochem Biophys. 2014;70(2):1145-51.
132. Song Y, Barry WT, Seah DS, Tung NM, Garber JE, Lin NU. Patterns of recurrence and metastasis in BRCA1/BRCA2-associated breast cancers. Cancer. 2020;126(2):271-80.
133. Geng B, Liang MM, Ye XB, Zhao WY. Association of CA 15-3 and CEA with clinicopathological parameters in patients with metastatic breast cancer. Mol Clin Oncol. 2015;3(1):232-6.
134. Brar HS, Sisley JF, Johnson RH. Value of preoperative bone and liver scans and alkaline phosphatase in the evaluation of breast cancer patients. Am J Surg. 1993;165(2):221-3.
135. Hickey RC, Samaan NA, Jackson GL. Hypercalcemia in Patients With Breast Cancer: Osseous Metastases, Hyperplastic Parathyroid Tissue, or Pseudohyperparathyroidism? Arch Surg. 1981;116(5):545-52.
136. Liu D, Wang D, Wu C, Zhang L, Mei Q, Hu G, et al. Prognostic significance of serum lactate dehydrogenase in patients with breast cancer: a meta-analysis. Cancer Manag Res. 2019;11:3611-9.
137. Gradishar WJ, Moran MS, Abraham J, Abramson V, Aft R, Agnese D, et al. NCCN Guidelines® Insights: Breast Cancer, Version 4.2023. J Natl Compr Cancer Netw JNCCN. 2023;21(6):594-608.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


