GUÍA PRÁCTICA CLÍNICA:
PARA EL DIAGNÓSTICO Y TRATAMIENTO DE LA ETAPA AGUDA DEL ATAQUE CEREBROVASCULAR ISQUÉMICO (2018)
VER
VIDEO
RESUMEN
DESCARGAR
VERSIÓN
ARTÍCULO
DESCARGAR
VERSIÓN
EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN
CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: pacientes con ataque cerebrovascular isquémico.
- Alcance: diagnóstico y tratamiento de la etapa aguda del ataque cerebrovascular isquémico.
Autores
Expertos clínicos:
- Sequeiros Chirinos Joel Mario
- Camarena Flores Carla Elizabeth
- Durand Castro Walter Severo
- Valencia Chávez Ana María
- Ecos Quispe Rosa Lisbeth
- Estupinan Valdéz Paula Inés
- Gallo Guerrero Marla Luz María
- Gómez Garay Gricelda Margot
- Huamaní Mendoza Marlene Doris
- Mariños Sánchez Evelyn Vanessa
- Morón Cabrera María Elizabeth
- Pulachet Contreras Elena Agustina
- Ramos Auccasi Alfredo Gilbert
- Rodríguez Kadota Liliana Elizabeth
- Saavedra Rocha César Augusto
Metodólogos:
- Alva Díaz Carlos Alexander
- Huamaní Saldaña Charles
- Pacheco Barrios Kevin Arturo
Coordinadores:
-
Raúl Alonso Timaná Ruiz
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
vacio
vacio
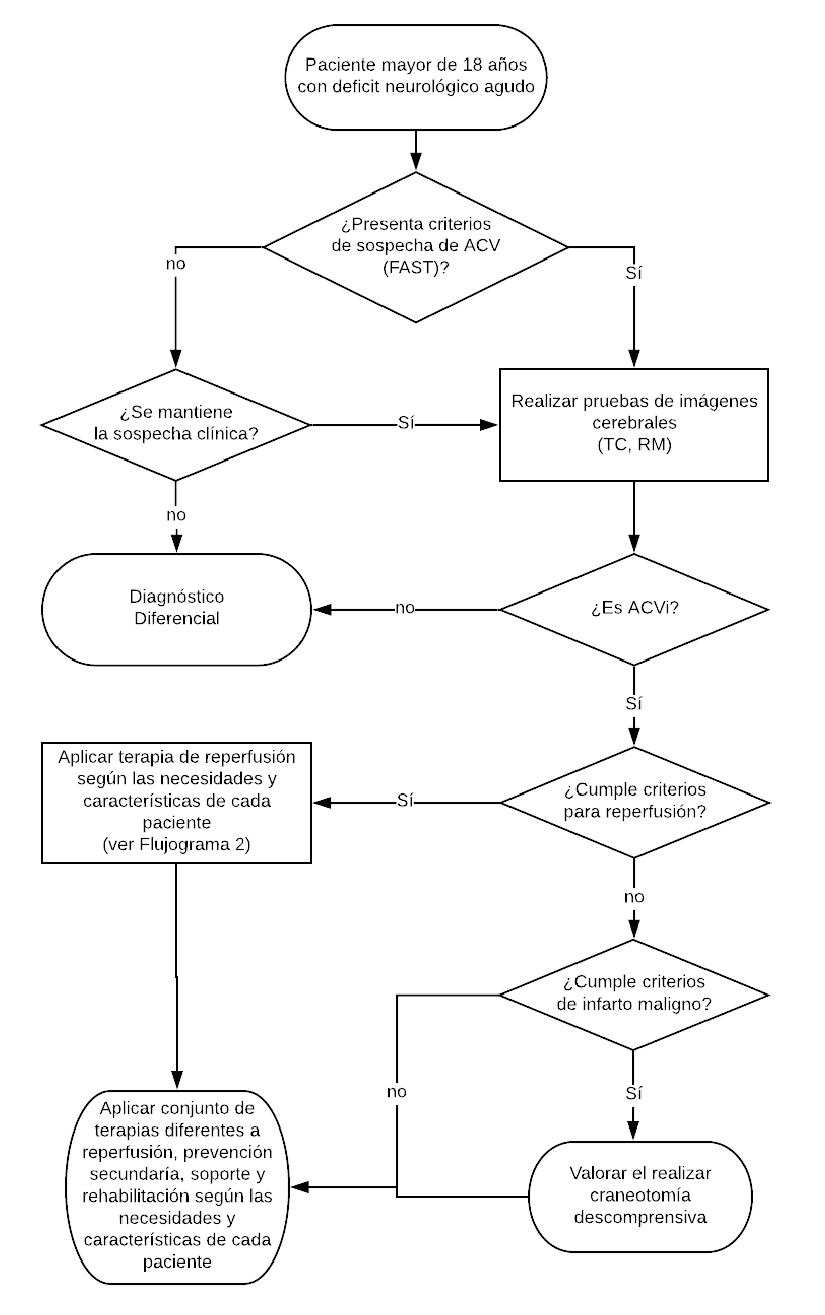
1. Sospecha de ACV
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes que presenten déficit neurológico focal agudo se recomienda usar alguna escala de atención prehospitalaria (como FAST*, LAPSS**, CPSS*** u otras) para establecer la sospecha del diagnóstico de ACVi.
* FAST: Facial, Arm, Speech and Time Score
** LAPSS: Los Angeles Prehospital Stroke Scale
*** CPSS: Cincinati Prehospital Stroke Scale
(Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 1:
En pacientes que presenten déficit neurológico focal agudo se sugiere usar la escala FAST como prueba de cribado del diagnóstico de ACVi. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
La escala FAST-ED (mayor o igual a 4 puntos) es una alternativa para la detección de ACVi por oclusión de vaso grande proximal y decisión de referencia directa a centro especializado con trombectomía mecánica.
BPC 2:
Para el grupo de pacientes que inician con vértigo persistente, alteración del nivel de conciencia, alteración súbita de la visión, inestabilidad para la marcha u otros signos/síntomas que hagan que se mantenga la sospecha clínica de ACVi a pesar de que no fueron detectados por estas escalas derivar a centros especializados.
2. Imágenes para confirmar ACV
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con sospecha de ACVi, se recomienda realizar de forma prioritaria una imagen cerebral, tomografía o resonancia magnética (TC o RM). En la mayoria de casos la TC sin contraste será útil para determinar el tipo de evento, su localización y decidir el manejo. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 2:
En pacientes con FA no valvular, recomendamos no ofrecer monoterapia con antiagregantes plaquetarios sólo como medida de prevención de eventos tromboembólicos. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En pacientes con sospecha de ACVi realizar la imagen cerebral antes de 25 min e interpretarla antes de 45 min desde la llegada al hospital.
BPC 2:
En pacientes con sospecha de ACVi, la angiotomografía (ATC) de arterias cerebrales, carotídeas y vertebrales también podría incluirse para determinar el tipo de evento, su localización y decidir el manejo. Realizar esta imagen no debería retrasar el inicio de trombólisis IV.
BPC 3:
En pacientes con ACVi y sospecha clínica de oclusión de vaso grande para evaluación de elegibilidad de trombectomía mecánica (ya sea dentro de las 6 horas de inicio de los síntomas o entre las 6 a 24 horas) solicitar una ATC o ARM, cervical y cerebral, incluso sin tener el valor de creatinina en pacientes sin antecedentes de ERC y/o valorar la TC con la escala ASPECTS (Tabla Nº 15), según disponibilidad y capacidad resolutiva.
3. Escalas de severidad de ACVi
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con ACVi se recomienda aplicar la escala NIHSS (National Institutes of Health Stroke Scale) para evaluar su severidad. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BCP 1:
En centros donde se brinda atención especializada a pacientes con ACVi, se debe procurar que los profesionales de la salud involucrados en su atención cuenten con capacitación y/o certificación para la correcta aplicación de la escala NIHSS.
BCP 2:
La valoración clínica de los pacientes con ACVi debe integrar además del puntaje en la escala NIHSS, el territorio vascular comprometido (circulación anterior o posterior) y la ubicación del infarto (izquierda-derecha).
BCP 3:
Los pacientes con puntajes de NIHSS mayores o iguales a 25 puntos deben ser considerados como pacientes con ACVi severos, donde los resultados de terapias de reperfusión por trombolisis permanecen inciertos.
4. Terapia de reperfusión en ACVi
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con ACVi que cumplan criterios de elegibilidad, se recomienda usar rTPA endovenoso inmediatamente dentro de las 4.5 horas del inicio de síntomas. (Recomendación fuerte a favor, certeza moderada de la evidencia)
Recomendación 2:
En pacientes con ACVi por oclusión de vaso grande proximal que cumplan con los criterios de elegibilidad se sugiere realizar trombectomía mecánica dentro de las 6 horas de inicio de los síntomas, según disponibilidad y capacidad resolutiva (Recomendación condicional a favor, certeza alta de la evidencia)
Recomendación 3:
En pacientes con ACVi por oclusión de vaso grande proximal, que cumplan criterios de elegibilidad de los ensayos clínicos de referencia de 6 a 24 horas de inicio de los síntomas, se sugiere realizar trombectomía mecánica, según disponibilidad y capacidad resolutiva (Recomendación condicional a favor, certeza moderada de la evidencia)
BPC 1:
En pacientes con ACVi elegibles para trombolisis IV la dosis de rTPA es 0,9 mg/kg, con dosis máxima de 90 mg; dosis inicial del 10% en bolo durante 1 minuto y el resto de la dosis en infusión durante 60 minutos
BPC 2:
En pacientes con ACVi los criterios de elegibilidad para trombólisis endovenosa son los propuestos por la AHA/ASA 2018 (Tabla Nº 14).
BPC 3:
En pacientes con ACVi los criterios de elegibilidad para trombectomía mecánica son: (1) SRm previo de 0 a 1; (2) oclusión causal de la carótida interna o arteria cerebral media (segmento M1); (3) edad ≥18 años; (4) puntaje NIHSS de ≥6; (5) puntaje ASPECTS ≥6. (según AHA-ASA 2018).
BPC 4:
Los pacientes con ACVi con oclusión del segmento M2 y M3 de la ACM, arteria cerebral anterior o posterior, arteria vertebral y basilar se podrían considerar como de elección para el manejo con trombectomía mecánica dentro de las 6 horas de inicio de los síntomas, según valoración individual del caso.
BPC 5:
En pacientes con ACVi y síntomas dentro de las 6 a 24 horas para decidir realizar trombectomía mecánica seguir los criterios de elegibilidad de ensayos clínicos de referencia (Tabla Nº 16).
BPC 6:
En pacientes con ACVi elegibles para rTPA IV, deberían recibir dicho tratamiento incluso si están siendo considerados para trombectomía mecánica y esta decisión no debería retrasar el inicio de la trombólisis IV.
5. Otros tratamientos para ACVi
Descargar PDF con el desarrollo de la pregunta.
Enfoque general
Recomendación 1:
Los pacientes con ACVi se beneficiarían de recibir una atención integral, multidisciplinaria y especializada.
Monitoreo continuo
Recomendación 2:
En pacientes con ACVi se recomienda la monitorización continua no invasiva. (Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
En pacientes con ACVi el monitoreo continuo no invasivo incluye las funciones vitales: presión arterial, frecuencia y ritmo cardiaco, frecuencia respiratoria, saturación de oxígeno, temperatura y glicemia. Este monitoreo estaría indicado para todos los pacientes hasta definir la extensión y severidad del ACVi, generalmente entre a 48 a 72 horas del inicio de los síntomas del paciente.
Modificar la presión arterial
Recomendación 3:
En pacientes con ACVi no se sugiere modificar, reducir o elevar, deliberadamente la presión arterial. (Recomendación condicional en contra, certeza muy baja de la evidencia)
BPC 2:
En pacientes con ACVi que no sean candidatos a terapias de reperfusión y que cursan con cifras de presión arterial iguales o mayores a 220/120 mmHg, estas deberían disminuirse en un 15% en las primeras 24 horas de inicio de los síntomas.
BPC 3:
En pacientes con ACVi candidatos a terapias de reperfusión, deberían mantener una presión arterial menor a 185/110 mmHg. Asimismo, en aquellos que han recibido terapia de reperfusión, se debe mantener una presión arterial menor a 180/105 mmHg durante las primeras 24 horas.
BPC 4:
En pacientes con ACVi valorar el inicio de antihipertensivos orales o habituales luego de las 24 horas del inicio del evento.
BPC 5:
En pacientes con ACVi la hipotensión y la hipovolemia deberían corregirse para mantener niveles de perfusión tisular adecuados.
Control glicémico estricto
Recomendación 4:
En pacientes con ACVi es aceptable mantener niveles de glicemia entre 140 y 180 mg/dl en las primeras 24 h. No se sugiere usar insulina para mantener la glicemia en niveles entre 72 a 135 mg/dL. (Recomendación condicional en contra, certeza baja de la evidencia)
BPC 6:
En pacientes con ACVi es razonable el monitoreo estrecho de los niveles de glicemia para prevenir la hipoglicemia y en caso de hipoglicemia (< 60 mg/dL) tratarla.
Hipotemia terapéutica
Recomendación 5:
En pacientes con ACVi no se recomienda la hipotermia terapéutica. (Recomendación fuerte en contra, certeza muy baja de la evidencia)
BPC 7:
En pacientes con ACVi mantener la normotermia. Si la temperatura fuera mayor a 38°C iniciar tratamiento antipirético con medidas farmacológicas, no farmacológicas y buscar etiología.
Antiagregación simple
Recomendación 6:
En pacientes con ACVi se recomienda el uso de antiagregantes plaquetarios. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BPC 7:
En pacientes con ACVi que no recibieron terapia trombolítica, iniciar la terapia antiagregante plaquetaria dentro de las primeras 48 horas del inicio de los síntomas.
BPC 8:
En pacientes con ACVi que recibieron terapia trombolítica, iniciar el tratamiento antiagregante posterior a 24 horas de la administración de la terapia trombolítica y luego de realizar un control con TAC.
BPC 9:
En pacientes con ACVi usar Acido Acetil Salicílico (AAS) a dosis de carga de 160 a 300 mg por vía oral, luego administrar 100 mg cada 24 horas. Como alternativa en aquellos que no puedan recibir AAS considerar el uso de Clopidogrel, a dosis de carga de 300 mg vía oral, luego administrar 75 mg cada 24 horas.
Antiagregación dual
Recomendación 3:
En pacientes con ACVi no se sugiere el uso de antiagregación dual como parte del tratamiento a largo plazo. (Recomendación condicional en contra, certeza muy baja de la evidencia)
BPC 10:
En pacientes con ACVi considerar el uso de doble antiagregación como tratamiento de corto plazo (21 días a 3 meses) en casos de pacientes con:
- ACVi menor (NIHSS ≤ 3) o AIT de alto riesgo de recurrencia (ABCD2 ≥ 4) por 21 días.
- ACVi o AIT con estenosis de ≥ 50% de arteria carótida interna, cerebral media y posterior, vertebral y basilar por 3 meses.
Anticoagulación inmediata
Recomendación 4:
En pacientes con ACVi no se recomienda la anticoagulación inmediata. (Recomendación fuerte en contra, certeza moderada de la evidencia)
BPC 11:
En pacientes con ACVi de etiología cardioembólica u otras con indicación de anticoagulación considerar el inicio de acuerdo al tiempo de enfermedad, severidad y extensión del infarto cerebral, que suele hacerse entre los 4 y 14 días del inicio de síntomas.
Estatinas
Recomendación 5:
En pacientes con ACVi con sospecha de ateroesclerosis se sugiere el uso de estatinas de intensidad moderada a alta, como atorvastatina de 40 a 80 mg u otras, independientemente de los niveles de lípidos basales según disponibilidad. Para decidir la dosis se debe valorar la tolerancia, edad y comorbilidades del paciente. (Recomendación condicional a favor, certeza muy baja de la evidencia)
6. Neuroprotección en ACVi
Descargar PDF con el desarrollo de la pregunta.
Citicolina
Recomendación 1:
En pacientes con ACVi, no se sugiere el uso de citicolina. (Condicional en contra, certeza baja de la evidencia)
Sulfato de magnesio
Recomendación 2:
En pacientes con ACVi, no se recomienda el uso de sulfato de magnesio. (Recomendación fuerte en contra, certeza alta de la evidencia)
Manitol
Recomendación 3:
En pacientes con ACVi sin hipertensión endocraneana, no se sugiere el uso de manitol como neuroprotector. (Recomendación condicional en contra, certeza muy baja de la evidencia)
Hemodilución
Recomendación 4:
En pacientes con ACVi, no se sugiere el uso de hemodilución. (Recomendación condicional en contra, certeza baja de la evidencia)
Células madre
Recomendación 5:
En pacientes con ACVi, no se sugiere el uso de células madre. (Recomendación condicional en contra, certeza baja de la evidencia)
7. Intervención quirúrgica en ACVi
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con ACVi extenso o maligno se recomienda la intervención quirúrgica (craniectomía o hemicraniectomia descompresiva) frente al tratamiento médico. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BCP 1:
A pacientes con ACVi extenso o maligno brindar evaluación neuroquirúrgica urgente.
BCP 2:
A pacientes con ACVi extenso o maligno realizar craniectomía descompresiva preferentemente dentro de las 48 horas y en no más de 96 horas del inicio del ACVi.
BCP 3:
A pacientes mayores de 60 años con ACVi extenso o maligno decidir la craniectomía descompresiva después de una cuidadosa consideración del estado funcional premórbido y las preferencias del paciente y/o familiares responsables.
BCP 4:
En pacientes con ACVi extenso o maligno infratentorial que amenaza el tronco cerebral y el 4ª ventrículo, se podría ofrecer craniectomía descompresiva.
8. Soporte y rehabilitación en ACVi
Descargar PDF con el desarrollo de la pregunta.
Alimentación y uso de sonda nasogástrica
Recomendación 1:
En pacientes con ACVi que no pueden deglutir de forma segura, se sugiere garantizar la alimentación a través del uso de SNG. (Recomendación condicional a favor, certeza baja de la evidencia)
Recomendación 2:
En pacientes con ACVi no se sugiere el uso sistemático (en todos los pacientes) de sonda nasogástrica para garantizar la alimentación. (Recomendación condicional en contra, certeza baja de la evidencia)
BCP 1:
En pacientes con ACVi se debe realizar una evaluación de la deglución antes de iniciar dieta por vía oral. La evaluación debe incluir la valoración del nivel de conciencia, la comprensión y ejecución de órdenes motoras, la ausencia de impedimentos motores orales, y la capacidad de deglutir líquidos de forma segura. Podria usarse algún protocolo de tamizaje como el test del vaso de agua, la auscultación cervical u otros validados para este propósito.
BCP 2:
En pacientes con ACVi iniciar la alimentación enteral temprana con el objetivo de mantener un adecuado aporte calórico.
BCP 3:
En pacientes con ACVi donde persista la sospecha de una inadecuada deglución, se puede solicitar evaluaciones instrumentales como evaluación endoscópica, videofluoroscopía, u otro que se encuentre disponible.
BCP 4:
En pacientes con ACVi la valoración de la seguridad de la deglución no debe retrasar el inicio de la dieta por otros medios.
BCP 5:
En pacientes con ACVi que no pueden deglutir de forma segura utilizar la alimentación por SNG para el soporte nutricional a corto plazo (2-3 semanas). En pacientes en quienes se prevé que no lograrán una adecuada deglución dentro de 3 semanas, considerar la nutrición a través de sondas colocadas por gastrostomía percutánea.
Complementos nutricionales
Recomendación 3:
En pacientes con ACVi no se sugiere agregar complementos nutricionales en la fase aguda del ACV. (Recomendación condicional en contra, certeza baja de la evidencia)
BCP 6:
En pacientes con FA sintomática (paroxística o persistente), considere la ablación quirúrgica concomitante a otra cirugía cardiotorácica.
Terapia del lenguaje / habla
Recomendación 4:
En pacientes con ACVi con afasia o trastornos del habla se sugiere realizar terapia del lenguaje/habla tan pronto sea posible. (Recomendación condicional a favor, certeza baja de la evidencia)
BCP 7:
La terapia del lenguaje/habla deben incluir la capacitación del cuidador.
Manejo de la disfagia
Recomendación 5:
En pacientes con FA paroxística sintomática que, a pesar del tratamiento farmacológico óptimo, o cuando el tratamiento farmacológico no sea tolerado por el paciente, recomendamos ofrecer ablación mediante cateterismo de los puntos gatillo ubicados en las venas pulmonares. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BCP 8:
En pacientes con FA sintomática (paroxística o persistente), considere la ablación quirúrgica concomitante a otra cirugía cardiotorácica.
Inicio de la rehabilitación
Recomendación 6:
En pacientes con FA paroxística sintomática que, a pesar del tratamiento farmacológico óptimo, o cuando el tratamiento farmacológico no sea tolerado por el paciente, recomendamos ofrecer ablación mediante cateterismo de los puntos gatillo ubicados en las venas pulmonares. (Recomendación condicional a favor, certeza baja de la evidencia)
BCP 9:
En pacientes con ACVi que presenten algún grado de discapacidad iniciar la rehabilitación temprana en casa para aquellos que puedan recibir atención médica de forma ambulatoria.
Referencias bibliográficas
- Guía de práctica clínica de diagnóstico, tratamiento y rehabilitación del episodio agudo del ataque cerebrovascular isquémico en población mayor de 18 años. Bogotá, Colombia: Ministerio de Salud y Protección Social – Colciencias; 2015.
- Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet (London, England). 2012;380(9859):2095-128.
- Haldal S, Beary J, Nattanmai P, George P, Newey C. Acute ischemic stroke management review for the hospitalist. 2018.
- Jaillard AS, Hommel M, Mazetti P. Prevalence of stroke at high altitude (3380 m) in Cuzco, a town of Peru: a population-based study. Stroke. 1995;26(4):562-8.
- Hernández-Vásquez A, Díaz-Seijas D, Espinoza-Alva D, Vilcarromero S. Análisis espacial de la mortalidad distrital por enfermedades cardiovasculares en las provincias de Lima y Callao. Revista Peruana de Medicina Experimental y Salud Pública. 2016;33:185-6.
- Castañeda-Guarderas A, Beltrán-Ale G, Casma-Bustamante R, Ruiz-Grosso P, Málaga G. Registro de pacientes con accidente cerebro vascular en un hospital público del Perú, 2000-2009. Revista Peruana de Medicina Experimental y Salud Pública. 2011;28:623-7.
- Málaga G, De La Cruz-Saldaña T, Busta-Flores P, Carbajal A, Santiago-Mariaca K. La enfermedad cerebrovascular en el Perú: estado actual y perspectivas de investigación clínica. Acta medica peruana. 2018;35(1):51-4.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Instituto de evaluación tecnológica en salud. Guía de Práctica clínica para el diagnóstico, tratamiento y rehabilitación del episodio agudo del ataque cerebrovascular isquémico en población mayor de 18 años. 2015.
- National Institute for Health and Clinical Excellence (NICE). National clinical guideline for stroke. 2016.
- Australian Ministry of Health. Clinical Guidelines for Stroke Management 2017. . In: Foundation S, editor. 2017.
- Powers WJ, Rabinstein AA, Ackerson T, Adeoye OM, Bambakidis NC, Becker K, et al. 2018 guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2018;49(3):e46-e110.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ (Clinical research ed). 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Saver JL. Time is brain—quantified. Stroke. 2006;37(1):263-6.
- Vilela P. Acute stroke differential diagnosis: Stroke mimics. European journal of radiology. 2017;96:133-44.
- Kawano-Castillo J, Arista MC, Barbarán MT, Escobar DV. Factores asociados a la demora del tratamiento hospitalario de los pacientes con enfermedad cerebrovascular aguda. Revista de neurologia. 2007;44(5):264-8.
- Davalos LF, Málaga G. El accidente cerebrovascular en el Perú: una enfermedad prevalente olvidada y desatendida. Revista Peruana de Medicina Experimental y Salud Pública. 2014;31:400-1.
- Lira-Mamani D, Concha-Flores G. Factores asociados al tiempo de llegada de pacientes con enfermedad cerebrovascular de urgencias de un hospital peruano. Revista de neurologia. 2004;39(6):508-12.
- Rudd M, Buck D, Ford GA, Price CI. A systematic review of stroke recognition instruments in hospital and prehospital settings. Emergency medicine journal : EMJ. 2016;33(11):818-22.
- National Collaborating Centre for Mental H, editor Depression: the treatment and management of depression in adults (updated edition)2010: British Psychological Society.
- Fischer JE, Bachmann LM, Jaeschke R. A readers’ guide to the interpretation of diagnostic test properties: clinical example of sepsis. Intensive care medicine. 2003;29(7):1043-51.
- Swets JA. Measuring the accuracy of diagnostic systems. Science (New York, NY). 1988;240(4857):1285-93.
- Kidwell CS, Saver JL, Schubert GB, Eckstein M, Starkman S. Design and retrospective analysis of the Los Angeles Prehospital Stroke Screen (LAPSS). Prehospital emergency care : official journal of the National Association of EMS Physicians and the National Association of State EMS Directors. 1998;2(4):267-73.
- Harbison J, Hossain O, Jenkinson D, Davis J, Louw SJ, Ford GA. Diagnostic accuracy of stroke referrals from primary care, emergency room physicians, and ambulance staff using the face arm speech test. Stroke. 2003;34(1):71-6.
- Krebs W, Sharkey-Toppen TP, Cheek F, Cortez E, Larrimore A, Keseg D, et al. Prehospital stroke assessment for large vessel occlusions: a systematic review. Prehospital Emergency Care. 2018;22(2):180-8.
- Nouh A, Remke J, Ruland S. Ischemic Posterior Circulation Stroke: A Review of Anatomy, Clinical Presentations, Diagnosis, and Current Management. Frontiers in neurology. 2014;5(30).
- Panichpisal K, Nugent K, Singh M, Rovin R, Babygirija R, Moradiya Y, et al. Pomona Large Vessel Occlusion Screening Tool for Prehospital and Emergency Room Settings. Interventional neurology. 2018;7(3-4):196-203.
- Smith EE, Kent DM, Bulsara KR, Leung LY, Lichtman JH, Reeves MJ, et al. Accuracy of Prediction Instruments for Diagnosing Large Vessel Occlusion in Individuals With Suspected Stroke: A Systematic Review for the 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke. Stroke. 2018;49(3):e111-e22.
- Chalela JA, Kidwell CS, Nentwich LM, Luby M, Butman JA, Demchuk AM, et al. Magnetic resonance imaging and computed tomography in emergency assessment of patients with suspected acute stroke: a prospective comparison. The Lancet. 2007;369(9558):293-8.
- Heiland S, Sartor K. Magnetic resonance tomography in stroke–its methodological bases and clinical use. RoFo: Fortschritte auf dem Gebiete der Rontgenstrahlen und der Nuklearmedizin. 1999;171(1):3-14.
- Campbell BC, Mitchell PJ, Kleinig TJ, Dewey HM, Churilov L, Yassi N, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. New England Journal of Medicine. 2015;372(11):1009-18.
- Ringelstein A, Lechel U, Fahrendorf DM, Altenbernd JC, Forsting M, Schlamann M. Radiation exposure in perfusion CT of the brain. Journal of computer assisted tomography. 2014;38(1):25-8.
- Krishnan P, Murphy A, Aviv RI. CT-based Techniques for Brain Perfusion. Topics in magnetic resonance imaging : TMRI. 2017;26(3):113-9.
- Brazzelli M, Sandercock PA, Chappell FM, Celani MG, Righetti E, Arestis N, et al. Magnetic resonance imaging versus computed tomography for detection of acute vascular lesions in patients presenting with stroke symptoms. The Cochrane Library. 2009.
- Biesbroek J, Niesten J, Dankbaar J, Biessels G, Velthuis B, Reitsma J, et al. Diagnostic accuracy of CT perfusion imaging for detecting acute ischemic stroke: a systematic review and meta-analysis. Cerebrovascular diseases. 2013;35(6):493-501.
- Rodriguez RM, Henderson TM, Ritchie AM, Langdorf MI, Raja AS, Silverman E, et al. Patient preferences and acceptable risk for computed tomography in trauma. Injury. 2014;45(9):1345-9.
- Hopyan J, Ciarallo A, Dowlatshahi D, Howard P, John V, Yeung R, et al. Certainty of stroke diagnosis: incremental benefit with CT perfusion over noncontrast CT and CT angiography. Radiology. 2010;255(1):142-53.
- Douglas V, Shamy M, Bhattacharya P. Should CT Angiography be a Routine Component of Acute Stroke Imaging? The Neurohospitalist. 2015;5(3):97-8.
- Albers GW, Marks MP, Kemp S, Christensen S, Tsai JP, Ortega-Gutierrez S, et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. New England Journal of Medicine. 2018;378(8):708-18.
- Nogueira RG, Jadhav AP, Haussen DC, Bonafe A, Budzik RF, Bhuva P, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. New England Journal of Medicine. 2018;378(1):11-21.
- Rost NS, Bottle A, Lee JM, Randall M, Middleton S, Shaw L, et al. Stroke Severity Is a Crucial Predictor of Outcome: An International Prospective Validation Study. Journal of the American Heart Association. 2016;5(1).
- Abdul-Rahim AH, Fulton RL, Sucharew H, Kleindorfer D, Khatri P, Broderick JP, et al. National institutes of health stroke scale item profiles as predictor of patient outcome: External validation on safe implementation of thrombolysis in stroke–monitoring study data. Stroke. 2015;46(10):2779-85.
- Cote R, Battista RN, Wolfson C, Boucher J, Adam J, Hachinski V. The Canadian Neurological Scale: validation and reliability assessment. Neurology. 1989;39(5):638-43.
- Christensen H, Boysen G, Truelsen T. The Scandinavian stroke scale predicts outcome in patients with mild ischemic stroke. Cerebrovascular diseases (Basel, Switzerland). 2005;20(1):46-8.
- Van Hooff RJ, De Smedt A, De Raedt S, Moens M, Marien P, Paquier P, et al. Unassisted assessment of stroke severity using telemedicine. Stroke. 2013;44(5):1249-55.
- El Husseini N, Shea KJ, Goldstein LB. Concerns for the reliability and validity of the National Stroke Project Stroke Severity Scale. Cerebrovascular diseases (Basel, Switzerland). 2011;32(5):426-30.
- Rangaraju S, Streib C, Aghaebrahim A, Jadhav A, Frankel M, Jovin TG. Relationship Between Lesion Topology and Clinical Outcome in Anterior Circulation Large Vessel Occlusions. Stroke. 2015;46(7):1787-92.
- Jauch EC, Saver JL, Adams HP, Jr., Bruno A, Connors JJ, Demaerschalk BM, et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013;44(3):870-947.
- Ministerio de Salud y Protección Social , Colciencias. Guía de práctica clínica para el diagnóstico, tratamineto y rehabilitación del episodio agudo del ataque cerebrovascular isquémico en población mayor de 18 años. 2015;Guía N° 54.
- Cooray C, Fekete K, Mikulik R, Lees KR, Wahlgren N, Ahmed N. Threshold for NIH stroke scale in predicting vessel occlusion and functional outcome after stroke thrombolysis. International journal of stroke : official journal of the International Stroke Society. 2015;10(6):822-9.
- Mansour OY, Megahed MM, Abd Elghany EHS. Acute ischemic stroke prognostication, comparison between Glasgow Coma Score, NIHS Scale and Full Outline of UnResponsiveness Score in intensive care unit. Alexandria Journal of Medicine. 2015;51(3):247-53.
- Kasner SE. Clinical interpretation and use of stroke scales. The Lancet Neurology. 2006;5(7):603-12.
- Lyden P, Raman R, Liu L, Grotta J, Broderick J, Olson S, et al. NIHSS Training and Certification Using a New Digital Video Disk Is Reliable. Stroke. 2005;36(11):2446-9.
- Lyden P, Raman R, Liu L, Emr M, Warren M, Marler J. National Institutes of Health Stroke Scale Certification Is Reliable Across Multiple Venues. Stroke. 2009;40(7):2507-11.
- Kwah LK, Diong J. National Institutes of Health Stroke Scale (NIHSS). Journal of physiotherapy. 2014;60(1):61.
- Lyden P. Using the National Institutes of Health Stroke Scale: A Cautionary Tale. Stroke. 2017;48(2):513-9.
- Hedna VS, Bodhit AN, Ansari S, Falchook AD, Stead L, Heilman KM, et al. Hemispheric Differences in Ischemic Stroke: Is Left-Hemisphere Stroke More Common? J Clin Neurol. 2013;9(2):97-102.
- Kim J-T, Park M-S, Choi K-H, Kim BJ, Han M-K, Park TH, et al. Clinical Outcomes of Posterior Versus Anterior Circulation Infarction With Low National Institutes of Health Stroke Scale Scores. Stroke. 2017;48(1):55-62.
- Heldner MR, Zubler C, Mattle HP, Schroth G, Weck A, Mono M-L, et al. National Institutes of Health Stroke Scale Score and Vessel Occlusion in 2152 Patients With Acute Ischemic Stroke. Stroke. 2013.
- Heldner MR, Zubler C, Mattle HP, Schroth G, Weck A, Mono ML, et al. National Institutes of Health stroke scale score and vessel occlusion in 2152 patients with acute ischemic stroke. Stroke. 2013;44(4):1153-7.
- Powers WJ, Rabinstein AA, Ackerson T, Adeoye OM, Bambakidis NC, Becker K, et al. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2018;49(3):e46-e110.
- Roger VL, Go AS, Lloyd-Jones DM, Adams RJ, Berry JD, Brown TM, et al. Heart disease and stroke statistics—2011 update: a report from the American Heart Association. Circulation. 2011;123(4):e18.
- Wardlaw JM, Murray V, Berge E, Del Zoppo G, Sandercock P, Lindley RL, et al. Recombinant tissue plasminogen activator for acute ischaemic stroke: an updated systematic review and meta-analysis. The Lancet. 2012;379(9834):2364-72.
- Wardlaw JM, Koumellis P, Liu M. Thrombolysis (different doses, routes of administration and agents) for acute ischaemic stroke. The Cochrane Library. 2013.
- Lin C, Li N, Wang K, Zhao X, Li B-Q, Sun L, et al. Efficacy and safety of endovascular treatment versus intravenous thrombolysis for acute ischemic stroke: a meta-analysis of randomized controlled trials. PloS one. 2013;8(10):e77849.
- Wardlaw JM, Murray V, Berge E, del Zoppo GJ. Thrombolysis for acute ischaemic stroke. The Cochrane Library. 2014.
- Lambrinos A, Schaink AK, Dhalla I, Krings T, Casaubon LK, Sikich N, et al. Mechanical thrombectomy in acute ischemic stroke: a systematic review. Canadian Journal of Neurological Sciences. 2016;43(4):455-60.
- Saber H, Narayanan S, Palla M, Saver JL, Nogueira RG, Yoo AJ, et al. Mechanical thrombectomy for acute ischemic stroke with occlusion of the M2 segment of the middle cerebral artery: a meta-analysis. Journal of neurointerventional surgery. 2017:neurintsurg-2017-013515.
- Barber PA, Demchuk AM, Zhang J, Buchan AM. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score. Lancet (London, England). 2000;355(9216):1670-4.
- Hankey GJ. Secondary stroke prevention. The Lancet Neurology. 2014;13(2):178-94.
- Chandratheva A, Mehta Z, Geraghty OC, Marquardt L, Rothwell PM. Population-based study of risk and predictors of stroke in the first few hours after a TIA. Neurology. 2009;72(22):1941-7.
- Giles MF, Rothwell PM. Risk of stroke early after transient ischaemic attack: a systematic review and meta-analysis. The Lancet Neurology. 2007;6(12):1063-72.
- Díez-Tejedor E, Fuentes B. Homeostasis as basis of acute stroke treatment: stroke units are the key. Cerebrovascular Diseases. 2005;20(Suppl. 2):129-34.
- Qureshi AI. Acute hypertensive response in patients with stroke: pathophysiology and management. Circulation. 2008;118(2):176-87.
- Aiyagari V, Gorelick PB. Management of blood pressure for acute and recurrent stroke. Stroke. 2009;40(6):2251-6.
- Leonardi-Bee J, Bath PM, Phillips SJ, Sandercock PA. Blood pressure and clinical outcomes in the International Stroke Trial. Stroke. 2002;33(5):1315-20.
- Capes SE, Hunt D, Malmberg K, Pathak P, Gerstein HC. Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients: a systematic overview. Stroke. 2001;32(10):2426-32.
- Lindsberg PJ, Roine RO. Hyperglycemia in acute stroke. Stroke. 2004;35(2):363-4.
- Parsons MW, Barber PA, Desmond PM, Baird TA, Darby DG, Byrnes G, et al. Acute hyperglycemia adversely affects stroke outcome: a magnetic resonance imaging and spectroscopy study. Annals of neurology. 2002;52(1):20-8.
- Olsen TS, Langhorne P, Diener HC, Hennerici M, Ferro J, Sivenius J, et al. European Stroke Initiative Recommendations for Stroke Management-update 2003. Cerebrovascular diseases (Basel, Switzerland). 2003;16(4):311-37.
- Ginsberg MD, Busto R. Combating hyperthermia in acute stroke: a significant clinical concern. Stroke. 1998;29(2):529-34.
- Sandercock PA, Counsell C, Tseng MC, Cecconi E. Oral antiplatelet therapy for acute ischaemic stroke. The Cochrane database of systematic reviews. 2014(3):Cd000029.
- Taylor F, Huffman MD, Macedo AF, Moore TH, Burke M, Davey Smith G, et al. Statins for the primary prevention of cardiovascular disease. The Cochrane database of systematic reviews. 2013(1):Cd004816.
- Cimino M, Gelosa P, Gianella A, Nobili E, Tremoli E, Sironi L. Statins: multiple mechanisms of action in the ischemic brain. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry. 2007;13(3):208-13.
- Bath PM, Krishnan K. Interventions for deliberately altering blood pressure in acute stroke. The Cochrane database of systematic reviews. 2014(10):Cd000039.
- Liu Y, Fei Z, Wang W, Fang J, Zou M, Cheng G. Efficacy and safety of short-term dual-versus mono-antiplatelet therapy in patients with ischemic stroke or TIA: a meta-analysis of 10 randomized controlled trials. Journal of neurology. 2016;263(11):2247-59.
- Sandercock PA, Counsell C, Kane EJ. Anticoagulants for acute ischaemic stroke. The Cochrane database of systematic reviews. 2015(3):Cd000024.
- Chróinín DN, Asplund K, Åsberg S, Callaly E, Cuadrado-Godia E, Díez-Tejedor E, et al. Statin therapy and outcome after ischemic stroke: systematic review and meta-analysis of observational studies and randomized trials. Stroke. 2013;44(2):448-56.
- Ciccone A, Celani MG, Chiaramonte R, Rossi C, Righetti E. Continuous versus intermittent physiological monitoring for acute stroke. The Cochrane database of systematic reviews. 2013(5):Cd008444.
- Bellolio MF, Gilmore RM, Ganti L. Insulin for glycaemic control in acute ischaemic stroke. Cochrane Database of Systematic Reviews [Internet]. 2014; (1). Available from: http://cochranelibrary-wiley.com/doi/10.1002/14651858.CD005346.pub4/abstract.
- Den Hertog HM, van der Worp HB, Tseng MC, Dippel DW. Cooling therapy for acute stroke. The Cochrane database of systematic reviews. 2009(1):Cd001247.
- Squizzato A, Romualdi E, Dentali F, Ageno W. Statins for acute ischemic stroke. The Cochrane database of systematic reviews. 2011(8):Cd007551.
- Clinical Guidelines for Stroke Management 2017. Melbourne Australia: Stroke Foundation; 2017. Available from: https://informme.org.au/Guidelines/Clinical-Guidelines-for-Stroke-Management-2017.
- Jauch EC, Saver JL, Adams HP, Bruno A, Demaerschalk BM, Khatri P, et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013;44(3):870-947.
- Saxena M, Young P, Pilcher D, Bailey M, Harrison D, Bellomo R, et al. Early temperature and mortality in critically ill patients with acute neurological diseases: trauma and stroke differ from infection. Intensive care medicine. 2015;41(5):823-32.
- Casaubon LK, Boulanger J-M, Glasser E, Blacquiere D, Boucher S, Brown K, et al. Canadian stroke best practice recommendations: acute inpatient stroke care guidelines, update 2015. International Journal of Stroke. 2016;11(2):239-52.
- Jeong HG, Kim BJ, Yang MH, Han MK, Bae HJ, Lee SH. Stroke outcomes with use of antithrombotics within 24 hours after recanalization treatment. Neurology. 2016;87(10):996-1002.
- The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke. International Stroke Trial Collaborative Group. Lancet (London, England). 1997;349(9065):1569-81.
- CAST: randomised placebo-controlled trial of early aspirin use in 20,000 patients with acute ischaemic stroke. CAST (Chinese Acute Stroke Trial) Collaborative Group. Lancet (London, England). 1997;349(9066):1641-9.
- Niu PP, Guo ZN, Jin H, Xing YQ, Yang Y. Antiplatelet regimens in the long-term secondary prevention of transient ischaemic attack and ischaemic stroke: an updated network meta-analysis. BMJ open. 2016;6(3):e009013.
- Zhang Q, Wang C, Zheng M, Li Y, Li J, Zhang L, et al. Aspirin plus clopidogrel as secondary prevention after stroke or transient ischemic attack: a systematic review and meta-analysis. Cerebrovascular diseases (Basel, Switzerland). 2015;39(1):13-22.
- Wang Y, Pan Y, Zhao X, Li H, Wang D, Johnston SC, et al. Clopidogrel With Aspirin in Acute Minor Stroke or Transient Ischemic Attack (CHANCE) Trial: One-Year Outcomes. Circulation. 2015;132(1):40-6.
- Gouya G, Arrich J, Wolzt M, Huber K, Verheugt FW, Gurbel PA, et al. Antiplatelet treatment for prevention of cerebrovascular events in patients with vascular diseases: a systematic review and meta-analysis. Stroke. 2014;45(2):492-503.
- Jing J, Meng X, Zhao X, Liu L, Wang A, Pan Y, et al. Dual Antiplatelet Therapy in Transient Ischemic Attack and Minor Stroke With Different Infarction Patterns: Subgroup Analysis of the CHANCE Randomized Clinical Trial. JAMA neurology. 2018;75(6):711-9.
- Squizzato A, Bellesini M, Takeda A, Middeldorp S, Donadini MP. Clopidogrel plus aspirin versus aspirin alone for preventing cardiovascular events. Cochrane Database Syst Rev. 2017;12:Cd005158.
- Saxena R, Koudstaal PJ. Anticoagulants for preventing stroke in patients with nonrheumatic atrial fibrillation and a history of stroke or transient ischaemic attack. The Cochrane Library. 2004.
- Saxena R, Koudstaal PJ. Anticoagulants versus antiplatelet therapy for preventing stroke in patients with nonrheumatic atrial fibrillation and a history of stroke or transient ischemic attack. The Cochrane Library. 2004.
- Johnston SC, Rothwell PM, Nguyen-Huynh MN, Giles MF, Elkins JS, Bernstein AL, et al. Validation and refinement of scores to predict very early stroke risk after transient ischaemic attack. Lancet. 2007;369(9558):283-92.
- Stocchetti N, Taccone FS, Citerio G, Pepe PE, Le Roux PD, Oddo M, et al. Neuroprotection in acute brain injury: an up-to-date review. Critical care (London, England). 2015;19:186.
- Secades JJ. Citicolina: revisión farmacológica y clínica, actualización 2010. Revista de neurologia. 2011;52(2):1-62.
- Muir KW, Lees KR, Ford I, Davis S. Magnesium for acute stroke (Intravenous Magnesium Efficacy in Stroke trial): randomised controlled trial. Lancet (London, England). 2004;363(9407):439-45.
- Bereczki D, Fekete I, Prado GF, Liu M. Mannitol for acute stroke. The Cochrane database of systematic reviews. 2007(3):Cd001153.
- Chang TS, Jensen MB. Haemodilution for acute ischaemic stroke. The Cochrane database of systematic reviews. 2014(8):Cd000103.
- Wang Q, Duan F, Wang MX, Wang XD, Liu P, Ma LZ. Effect of stem cell-based therapy for ischemic stroke treatment: A meta-analysis. Clinical neurology and neurosurgery. 2016;146:1-11.
- Shi PY, Zhou XC, Yin XX, Xu LL, Zhang XM, Bai HY. Early application of citicoline in the treatment of acute stroke: A meta-analysis of randomized controlled trials. Journal of Huazhong University of Science and Technology Medical sciences = Hua zhong ke ji da xue xue bao Yi xue Ying De wen ban = Huazhong keji daxue xuebao Yixue Yingdewen ban. 2016;36(2):270-7.
- Saver JL, Starkman S, Eckstein M, Stratton SJ, Pratt FD, Hamilton S, et al. Prehospital use of magnesium sulfate as neuroprotection in acute stroke. The New England journal of medicine. 2015;372(6):528-36.
- Juttler E, Schwab S, Schmiedek P, Unterberg A, Hennerici M, Woitzik J, et al. Decompressive Surgery for the Treatment of Malignant Infarction of the Middle Cerebral Artery (DESTINY): a randomized, controlled trial. Stroke. 2007;38(9):2518-25.
- Hofmeijer J, Kappelle LJ, Algra A, Amelink GJ, van Gijn J, van der Worp HB. Surgical decompression for space-occupying cerebral infarction (the Hemicraniectomy After Middle Cerebral Artery infarction with Life-threatening Edema Trial [HAMLET]): a multicentre, open, randomised trial. The Lancet Neurology. 2009;8(4):326-33.
- Moulin DE, Lo R, Chiang J, Barnett HJM. Prognosis in middle cerebral artery occlusion. Stroke. 1985;16(2):282-4.
- Silver FL, Norris JW, Lewis AJ, Hachinski VC. Early mortality following stroke: a prospective review. Stroke. 1984;15(3):492-6.
- Chen C-C, Cho D-Y, Tsai S-C. Outcome of and prognostic factors for decompressive hemicraniectomy in malignant middle cerebral artery infarction. Journal of clinical neuroscience. 2007;14(4):317-21.
- Hacke W, Schwab S, Horn M, Spranger M, De Georgia M, Von Kummer R. ‘Malignant’middle cerebral artery territory infarction: clinical course and prognostic signs. Archives of neurology. 1996;53(4):309-15.
- Alexander P, Heels-Ansdell D, Siemieniuk R, Bhatnagar N, Chang Y, Fei Y, et al. Hemicraniectomy versus medical treatment with large MCA infarct: a review and meta-analysis. BMJ open. 2016;6(11):e014390.
- Vahedi K, Hofmeijer J, Juettler E, Vicaut E, George B, Algra A, et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomised controlled trials. The Lancet Neurology. 2007;6(3):215-22.
- Vahedi K, Vicaut E, Mateo J, Kurtz A, Orabi M, Guichard J-P, et al. Sequential-design, multicenter, randomized, controlled trial of early decompressive craniectomy in malignant middle cerebral artery infarction (DECIMAL Trial). Stroke. 2007;38(9):2506-17.
- Jüttler E, Unterberg A, Woitzik J, Bösel J, Amiri H, Sakowitz OW, et al. Hemicraniectomy in older patients with extensive middle-cerebral-artery stroke. New England Journal of Medicine. 2014;370(12):1091-100.
- Frank JI, Schumm LP, Wroblewski K, Chyatte D, Rosengart AJ, Kordeck C, et al. Hemicraniectomy and durotomy upon deterioration from infarction-related swelling trial: randomized pilot clinical trial. Stroke. 2014;45(3):781-7.
- Cruz‐Flores S, Berge E, Whittle IR. Surgical decompression for cerebral oedema in acute ischaemic stroke. The Cochrane Library. 2012.
- Back L, Nagaraja V, Kapur A, Eslick GD. Role of decompressive hemicraniectomy in extensive middle cerebral artery strokes: a meta‐analysis of randomised trials. Internal medicine journal. 2015;45(7):711-7.
- Winstein CJ, Stein J, Arena R, Bates B, Cherney LR, Cramer SC, et al. Guidelines for Adult Stroke Rehabilitation and Recovery. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. 2016;47(6):e98-e169.
- Geeganage C, Beavan J, Ellender S, Bath PM. Interventions for dysphagia and nutritional support in acute and subacute stroke. The Cochrane database of systematic reviews. 2012;10:Cd000323.
- The FOOD Trial Collaboration. Routine oral nutritional supplementation for stroke patients in hospital (FOOD): a multicentre randomised controlled trial. The Lancet. 2005;365(9461):755-63.
- Hillis AE. Aphasia. Progress in the last quarter of a century. 2007;69(2):200-13.
- Kelly H, Brady MC, Enderby P. Speech and language therapy for aphasia following stroke. The Cochrane database of systematic reviews. 2010(5):Cd000425.
- Langdon PC, Lee AH, Binns CW. Dysphagia in acute ischaemic stroke: severity, recovery and relationship to stroke subtype. Journal of Clinical Neuroscience. 2007;14(7):630-4.
- Lynch E, Hillier S, Cadilhac D. When should physical rehabilitation commence after stroke: a systematic review. International journal of stroke : official journal of the International Stroke Society. 2014;9(4):468-78.
- Ministerio de Salud y Protección Social , Colciencias. Guía de práctica clínica para el diagnóstico, tratamiento y rehabilitación del episodio agudo del ataque cerebrovascular isquémico en población mayor de 18 años. 2015;Guía N° 54.
- Geeganage C, Beavan J, Ellender S, Bath PM. Interventions for dysphagia and nutritional support in acute and subacute stroke. Cochrane Database of Systematic Reviews [Internet]. 2012; (10). Available from:
http://cochranelibrary-wiley.com/doi/10.1002/14651858.CD000323.pub2/abstract.
- Brady MC, Kelly H, Godwin J, Enderby P, Campbell P. Speech and language therapy for aphasia following stroke. Cochrane Database of Systematic Reviews [Internet]. 2016; (6). Available from:
http://cochranelibrary-wiley.com/doi/10.1002/14651858.CD000425.pub4/abstract.
- Li Z, Zhang X, Wang K, Wen J. Effects of Early Mobilization after Acute Stroke: A Meta-Analysis of Randomized Control Trials. Journal of stroke and cerebrovascular diseases : the official journal of National Stroke Association. 2018;27(5):1326-37.
- The FOOD Trial Collaboration. Effect of timing and method of enteral tube feeding for dysphagic stroke patients (FOOD): a multicentre randomised controlled trial. The Lancet. 2005;365(9461):764-72.
- Caviedes I, Lavados P, Hoppe A, López A. Predicción clínica de aspiración en pacientes con patología neurológica aguda. Revista chilena de enfermedades respiratorias. 2005;21(1):9-14.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com