
GUÍA PRÁCTICA CLÍNICA:
PARA EL MANEJO DE CÁNCER DE CUELLO UTERINO
ESTADIOS TEMPRANOS (IA1, IA2, IB1, IB2 O IIA1) (2020)
DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: pacientes con cáncer de cuello uterino en estadios tempranos.
- Alcance: manejo de cáncer de cuello uterino en estadios tempranos (IA1, IA2, IB1, IB2 y IIA1)
Autores
Expertos clínicos:
- Mirtha Magaly Malca Tocas
- Ana Cecilia Fernandez Butrón
- Yan Vargas Caycho
- Carlos Ceballos Pacheco
- Teófilo Livano Yberico
- Oswaldo Broncano Huasasquiche
Metodólogos:
- Claudia Patricia Matos Miranda
- César Augusto Ugarte Gil
- Naysha Becerra Chauca
- Stefany Salvador Salvador
Coordinadores:
- Timaná Ruiz, Raúl Alonso
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
Flujograma 1. Tratamiento de cáncer de cuello uterino estadio IA1

Flujograma 2. Tratamiento de cáncer de cuello uterino estadio IA2 y IB1 (< 2 cm)
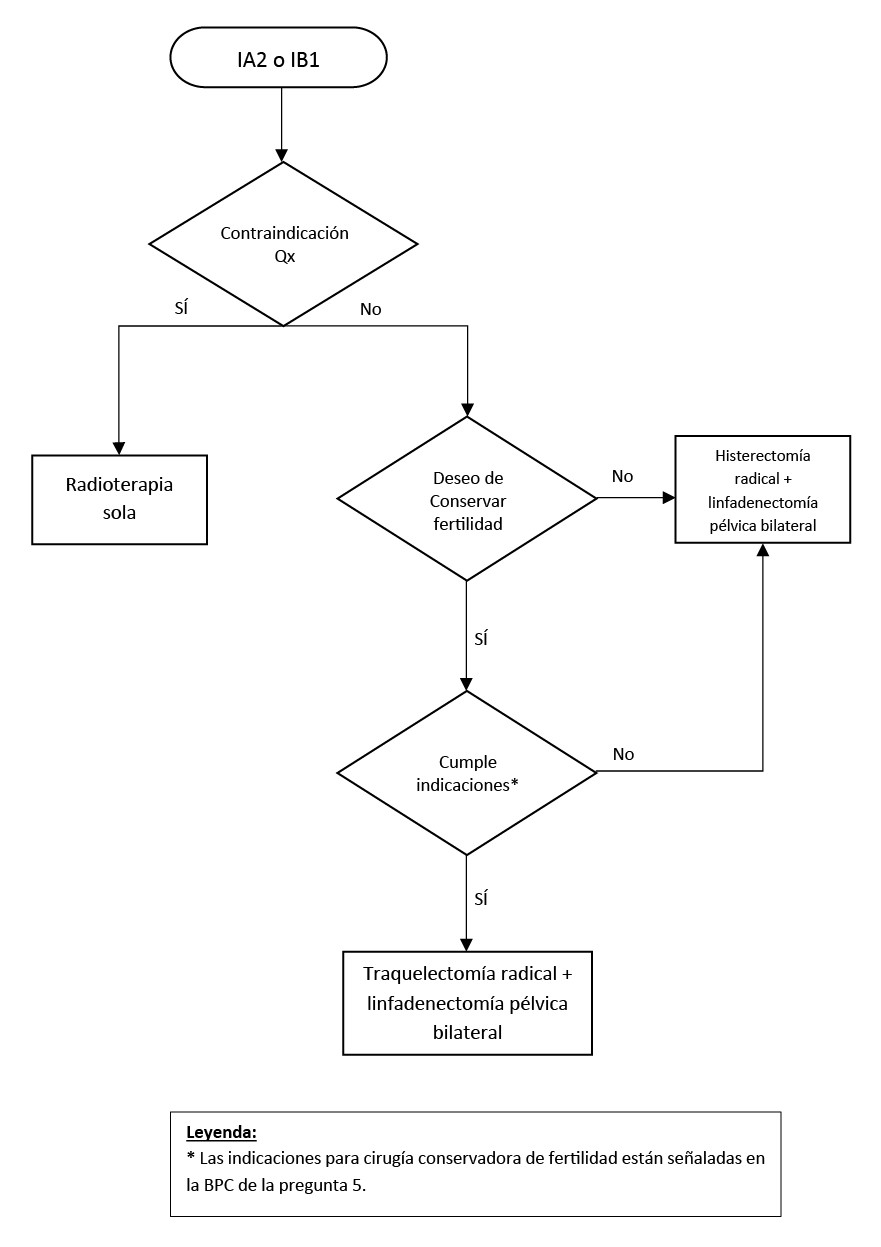
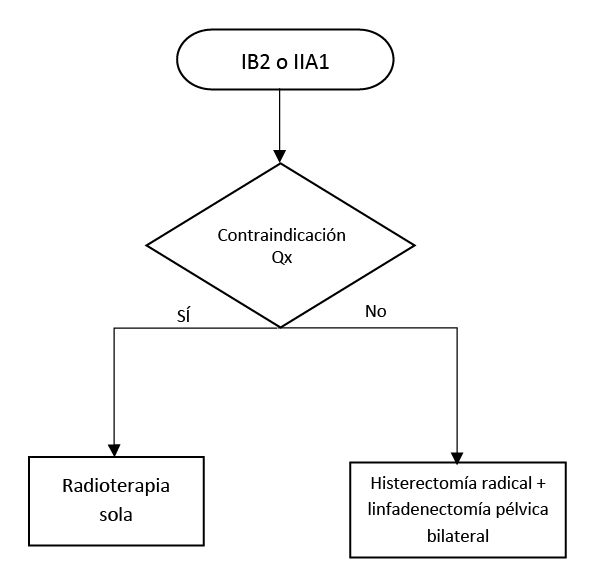
Flujograma 3. Tratamiento de cáncer de cuello uterino estadio IB2 y IIA1 (≥ 2 cm; < 4 cm)
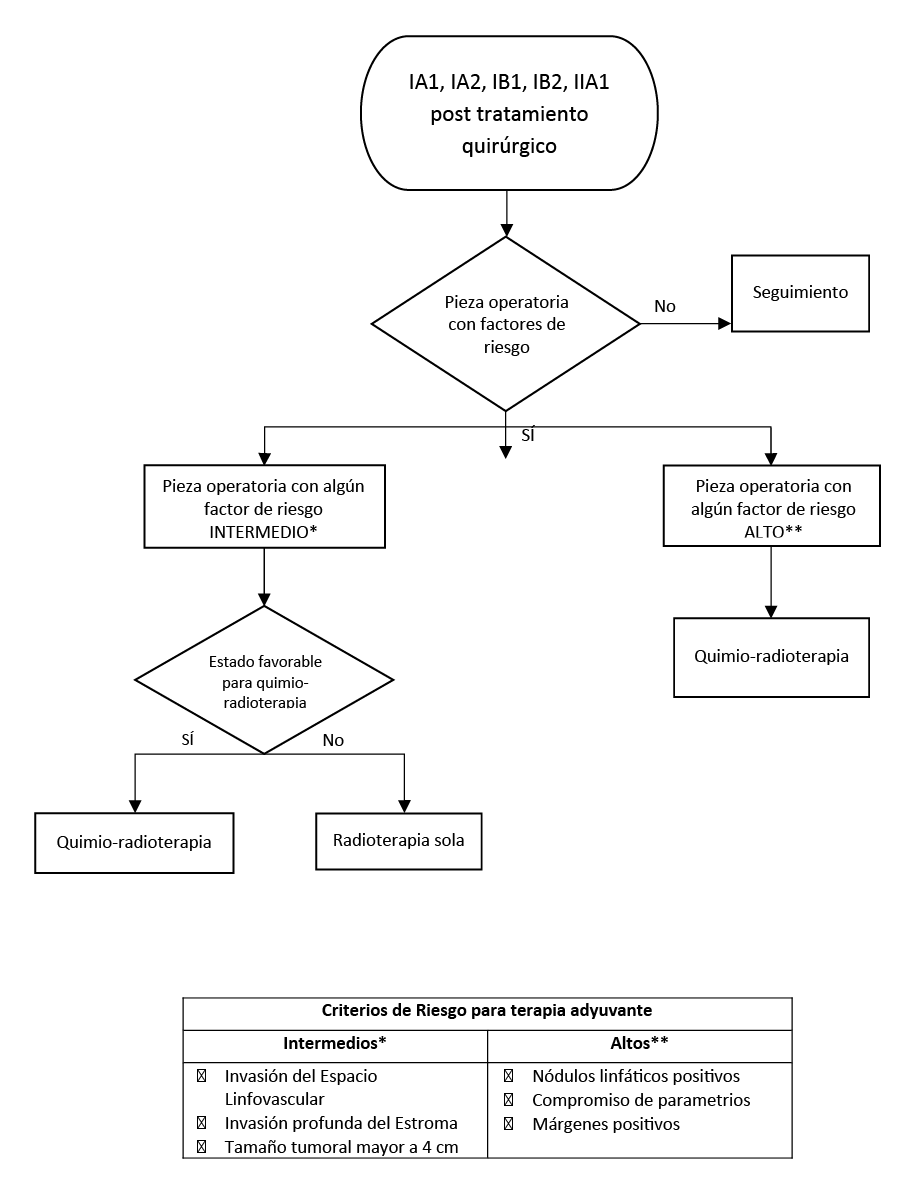
Flujograma 4. Tratamiento Adyuvante de cáncer de cuello uterino estadios IA1, IA2, IB1, IB2, IIA1
vacio
vacio
1. Tratamiento inicial
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de cuello uterino en estadios tempranos (IA1, IA2, IB1, IB2 o IIA1) recomendamos realizar la cirugía como tratamiento primario. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con cáncer de cuello uterino en estadios iniciales (IA1, IA2, IB1, IB2 o IIA1) y con contraindicaciones y/o comorbilidades importantes, u otras situaciones que, según criterio médico, son incompatibles con una cirugía, se debe considerar radioterapia como tratamiento inicial.
2. Tratamiento quirúrgico
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de cuello uterino en estadios tempranos (IA1, IA2, IB1, IB2 o IIA1) sugerimos realizar histerectomía radical como tratamiento quirúrgico inicial, salvo en ciertos escenarios especiales. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
- En mujeres con cáncer de cuello uterino estadio IA1 con cono de biopsia sin Invasión del Espacio Linfo Vascular (IELV), márgenes libres y con curetaje endocervical (CEC) negativo, considerar que han sido curadas y que no necesitan intervenciones adicionales, sólo seguimiento.
- En mujeres con cáncer de cuello uterino estadio IA1 con cono de biopsia con márgenes libres con CEC negativo, pero con IELV, considerar realizar evaluación ganglionar pélvica.
- En mujeres con cáncer de cuello uterino estadio IA1 con cono de biopsia con márgenes positivos y/o CEC positivo sin IELV, considerar realizar histerectomía tipo A.
- En mujeres con cáncer de cuello uterino estadio IA1 con cono de biopsia con márgenes positivos y/o CEC positivo con IELV, considerar realizar histerectomía tipo A más evaluación ganglionar pélvica.
- Si la pieza patológica no presenta factores de riesgo considerar seguimiento cada 6 meses durante los 5 primeros años y luego anual. Cada consulta médica incluirá examen clínico y solicitud de estudio radiológicos en base al examen clínico. Se debería solicitar un examen de papanicolaou anual.
- En mujeres con cáncer de cuello uterino en estadios iniciales (IA1, IA2, IB, IB2 o IIA1) que sean sometidas a histerectomía radical, considerar hacer cirugía conservadora de la inervación pélvica.
3. Evaluación ganglionar pélvica
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de cuello uterino en estadios tempranos (IA1, IA2, IB1, IB2 o IIA1) a quienes se les indique tratamiento quirúrgico (histerectomía, traquelectomía o conización) y evaluación ganglionar pélvica, sugerimos realizar esta última mediante linfadenectomía pélvica bilateral. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con cáncer de cuello uterino en estadio IA1, la linfadenectomía pélvica bilateral solo se realizará si la paciente presenta IELV, pudiendo ésta ser realizada por vía laparoscópica.
4. Cirugía laparoscópica versus cirugía abierta
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de cuello uterino en estadios tempranos (IA1, IA2, IB1, IB2 o IIA1) que requieran cirugía (histerectomía o traquelectomía), sugerimos realizarla mediante cirugía abierta (laparotomía). (Recomendación condicional a favor, certeza muy baja de la evidencia)
5. Indicaciones de cirugía conservadora de fertilidad
Descargar PDF con el desarrollo de la pregunta.
BCP 1:
Las mujeres con cáncer de cuello uterino estadios tempranos deben cumplir con todas las siguientes indicaciones para recibir cirugía conservadora de fertilidad:
- Deseo explícito de preservar la fertilidad
- Posibilidad de conseguir un embarazo
- Estadios IA1-IB1 según FIGO
- Tamaño de lesión de menos de 2 cm
- No evidencia de metástasis en los ganglios de la pelvis según evaluación radiológica (resonancia magnética)
- No evidencia de tumor de tipo histológico neuroendocrino u otros raros no frecuentes.
6. Qué cirugía conservadora de fertilidad realizar
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de cuello uterino estadio IA1 con cono de biopsia con márgenes positivos y/o curetaje endocervical (CEC) positivo, sin IELV que deseen conservar fertilidad y cumplan todas las indicaciones para cirugía conservadora de fertilidad explicitadas en la pregunta anterior (Nº5), sugerimos realizar reconización con diámetro más amplio. (Recomendación condicional a favor, certeza muy baja de la evidencia)
Recomendación 2:
En mujeres con cáncer de cuello uterino estadio IA1 con cono de biopsia con márgenes positivos y/o curetaje endocervical (CEC) positivo, con IELV que deseen conservar fertilidad y cumplan todas las indicaciones para cirugía conservadora de fertilidad explicitadas en la pregunta anterior (Nº5), sugerimos realizar reconización con diámetro más amplio más linfadenectomía pélvica bilateral, pudiendo ésta última ser realizada por vía laparoscópica. (Recomendación condicional a favor, certeza muy baja de la evidencia)
Recomendación 3:
En mujeres con cáncer de cuello uterino estadios IA2 o IB1 que deseen conservar fertilidad y cumplan todas las indicaciones para cirugía conservadora de fertilidad explicitadas en la pregunta anterior (Nº5) sugerimos realizar traquelectomía radical más linfadenectomía pélvica bilateral, pudiendo ésta última ser realizada por vía laparoscópica o vía abierta (laparotomía). (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres con cáncer de cuello uterino estadios IA1, IA2 o IB1 que deseen conservar fertilidad y cumplan todas las indicaciones para cirugía conservadora de fertilidad, se debería tomar la decisión terapéutica de manera compartida con la paciente explicándole previamente los riesgos y beneficios de cada intervención (conización o traquelectomía radical) de manera clara, amigable y explícita.
7. Terapia adyuvante
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de cuello uterino estadio IA1 con cono de biopsia con márgenes positivos y/o curetaje endocervical (CEC) positivo, sin IELV que deseen conservar fertilidad y cumplan todas las indicaciones para cirugía conservadora de fertilidad explicitadas en la pregunta anterior (Nº5), sugerimos realizar reconización con diámetro más amplio. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 2:
En mujeres con cáncer de cuello uterino en estadios tempranos (IA1, IA2, IB1, IB2 o IIA1) con indicación de terapia adyuvante y algún factor de riesgo intermedio pero ningún factor de riesgo alto de los mencionados en la tabla Nº 8, sugerimos usar quimio-radioterapia concurrente. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BCP 1:
En mujeres con cáncer de cuello uterino en estadios temprano con indicación de terapia adyuvante con un estado de salud no favorable para tolerar la quimio-radioterapia, o por criterio médico no son candidatas a quimio-radioterapia, considerar de radioterapia sola.
8. Quimio-radioterapia
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con cáncer de cuello uterino en estadios iniciales (IA1, IA2, IB, IB2 o IIA1) e indicación de quimio-radioterapia adyuvante, sugerimos utilizar quimioterapia en base a cisplatino. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BCP 1:
- Para terapia adyuvante con quimioterapia se utilizará una dosis de cisplatino a criterio médico, en base a características de la paciente.
- Para terapia adyuvante con radioterapia externa la dosis estándar será de 45 a 50 Gy en fracciones estándar (1.8 o 2.0 Gy diario), pudiendo ésta ser modificada a criterio médico según características del paciente.
- En mujeres con cáncer de cuello uterino estadios tempranos (IA1, IA2, IB, IB2 o IIA1) e indicación de terapia adyuvante, la adición de braquiterapia aún nocuenta con evidencia sólida que sustente su efectividad sobre la quimio-radioterapia externa sola.
- En mujeres con indicación de terapia adyuvante y con falla renal que no pueden recibir cisplatino, considerar el uso de carboplatino como alternativa quimio-terapéutica en las dosis basadas en la fórmula Calvert recomendadas por la FDA y el NCCN según tasa de filtración glomerular obtenida mediante la ecuación Cockcroft-Gault.
Referencias bibliográficas
- Ginsburg O, Bray F, Coleman MP, Vanderpuye V, Eniu A, Kotha SR, et al. The global burden of women’s cancers: a grand challenge in global health. Lancet (London, England). 2017;389(10071):847-60.
- Forouzanfar MH, Foreman KJ, Delossantos AM, Lozano R, Lopez AD, Murray CJ, et al. Breast and cervical cancer in 187 countries between 1980 and 2010: a systematic analysis. Lancet (London, England). 2011;378(9801):1461-84.
- Dirección General de Epidemiología. ANÁLISIS DE LA SITUACIÓN DEL CÁNCER EN EL PERÚ, 2013. 1º ed. Lima: Ministerio de Salud; 2013.
- Marth C Fau – Landoni F, Landoni F Fau – Mahner S, Mahner S Fau – McCormack M, McCormack M Fau – Gonzalez-Martin A, Gonzalez-Martin A Fau – Colombo N, Colombo N. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. (1569-8041 (Electronic)).
- Pirog EC, Lloveras B, Molijn A, Tous S, Guimera N, Alejo M, et al. HPV prevalence and genotypes in different histological subtypes of cervical adenocarcinoma, a worldwide analysis of 760 cases. Modern pathology : an official journal of the United States and Canadian Academy of Pathology, Inc. 2014;27(12):1559-67.
- Basu P, Mittal S, Bhadra Vale D, Chami Kharaji Y. Secondary prevention of cervical cancer. Best practice & research Clinical obstetrics & gynaecology. 2018;47:73-85.
- Bhatla N, Aoki D, Sharma DN, Sankaranarayanan R. Cancer of the cervix uteri. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics. 2018;143 Suppl 2:22-36.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne. 2010;182(18):E839-42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Lim MC, Lee M, Shim SH, Nam EJ, Lee JY, Kim HJ, et al. Practice guidelines for management of cervical cancer in Korea: a Korean Society of Gynecologic Oncology Consensus Statement. Journal of gynecologic oncology. 2017;28(3).
- Chile MdSyPSd. Guía de Práctica Clínica para el manejo del cáncer de cuello uterino invasivo. Guía completa. Colombia2014.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ (Clinical research ed). 2017;358:j4008.
- Higgins JP, Altman DG, Gotzsche PC, Juni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ (Clinical research ed). 2011;343:d5928.
- Wells G SB, O’connell D, Peterson J, Welch V, Losos M, Tugwell P. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute. 2009.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- DiSaia PC, William; Mannel, Robert; McMeekin, Scott; Mutch, David. Oncología Ginecológica Clínica. 9º ed. Barcelona: Elsevier; 2018.
- American Cancer Society. Radiation Therapy for Cervical Cancer: American Cancer Society,; 2016 [Available from: https://www.cancer.org/cancer/cervical-cancer/treating/radiation.html.
- American Cancer Society. Radiation Therapy Basics: American Cancer Society,; 2018 [Available from: https://www.cancer.org/treatment/treatments-and-side-effects/treatment-types/radiation/basics.html.
- Landoni F, Maneo A, Colombo A, Placa F, Milani R, Perego P, et al. Randomised study of radical surgery versus radiotherapy for stage Ib-IIa cervical cancer. Lancet (London, England). 1997;350(9077):535-40.
- Landoni F, Colombo A, Milani R, Placa F, Zanagnolo V, Mangioni C. Randomized study between radical surgery and radiotherapy for the treatment of stage IB-IIA cervical cancer: 20-year update. Journal of gynecologic oncology. 2017;28(3):e34.
- Machida H, Matsuo K, Furusawa A, Kita T, Kitagawa R, Mikami M. Profile of treatment-related complications in women with clinical stage IB-IIB cervical cancer: A nationwide cohort study in Japan. PLoS One. 2019;14(1):e0210125-e.
- Koontz B. Radiation Therapy Treatment Effects: An Evidence-based Guide to Managing Toxicity New York: Springer Publishing Company; 2018.
- Jensen PT, Groenvold M, Klee MC, Thranov I, Petersen MA, Machin D. Longitudinal study of sexual function and vaginal changes after radiotherapy for cervical cancer. International journal of radiation oncology, biology, physics. 2003;56(4):937-49.
- Fokom Domgue J, Schmeler KM. Conservative management of cervical cancer: Current status and obstetrical implications. Best practice & research Clinical obstetrics & gynaecology. 2019;55:79-92.
- Mann W. Radical hysterectomy. UpToDate. 2018.
- Querleu D, Morrow CP. Classification of radical hysterectomy. The Lancet Oncology. 2008;9(3):297-303.
- Xu L, Sun FQ, Wang ZH. Radical trachelectomy versus radical hysterectomy for the treatment of early cervical cancer: a systematic review. Acta obstetricia et gynecologica Scandinavica. 2011;90(11):1200-9.
- Feng Y, Zhang Z, Lou T, Wang S, Bai H, Zhang Z. The security of radical trachelectomy in the treatment of IA-IIA cervical carcinoma requires further evaluation: updated meta-analysis and trial sequential analysis. Archives of gynecology and obstetrics. 2019;299(6):1525-36.
- Sun H, Cao D, Shen K, Yang J, Xiang Y, Feng F, et al. Piver type II versus type III hysterectomy in the treatment of early-stage cervical cancer: midterm follow up results of a randomized controlled trial. Frontiers in Oncology. 2018;8:568.
- Canadian Cancer Trials Group. Radical versus simple hysterectomy and pelvic node dissection in patients with low-risk early stage cervical cancer (SHAPE). [Available from: https://clinicaltrials.gov/ct2/show/NCT01658930.
- Chuang LT, Temin S, Camacho R, Dueñas-Gonzalez A, Feldman S, Gultekin M, et al. Management and care of women with invasive cervical cancer: American Society of Clinical Oncology resource-stratified clinical practice guideline. Journal of global oncology. 2016;2(5):311-40.
- Marth C, Landoni F, Mahner S, McCormack M, Gonzalez-Martin A, Colombo N, et al. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2017;28(suppl_4):iv72-iv83.
- Network NCC. Cervical Cancer NCCN Evidence Blocks: National Comprehensive Cancer Network; 2018.
- Hou J, Goldberg GL, Qualls CR, Kuo DY, Forman A, Smith HO. Risk factors for poor prognosis in microinvasive adenocarcinoma of the uterine cervix (IA1 and IA2): a pooled analysis. Gynecologic oncology. 2011;121(1):135-42.
- Poynor E, Marshall D, Sonoda Y, Slomovitz B, Barakat R, Soslow R. Clinicopathologic features of early adenocarcinoma of the cervix initially managed with cervical conization. Gynecologic oncology. 2006;103(3):960-5.
- Qian Q, Yang J, Cao D, You Y, Chen J, Shen K. Analysis of treatment modalities and prognosis on microinvasive cervical cancer: a 10-year cohort study in China. Journal of gynecologic oncology. 2014;25(4):293-300.
- Yoneda JY, Braganca JF, Sarian LO, Borba PP, Conceição JCJ, Zeferino LC. Surgical treatment of microinvasive cervical cancer: analysis of pathologic features with implications on radicality. International Journal of Gynecologic Cancer. 2015;25(4):694-8.
- Delgado G, Bundy B, Fowler Jr W, Stehman F, Sevin B, Creasman WT, et al. A prospective surgical pathological study of stage I squamous carcinoma of the cervix: a Gynecologic Oncology Group Study. Gynecologic oncology. 1989;35(3):314-20.
- Raspagliesi F, Ditto A, Quattrone P, Solima E, Fontanelli R, Dousias V, et al. Prognostic factors in microinvasive cervical squamous cell cancer: long-term results. International Journal of Gynecologic Cancer. 2005;15(1):88-93.
- Trimbos JB, Maas CP, Deruiter MC, Peters AA, Kenter GG. A nerve-sparing radical hysterectomy: guidelines and feasibility in Western patients. International journal of gynecological cancer : official journal of the International Gynecological Cancer Society. 2001;11(3):180-6.
- Maas CP, Kenter GG, Trimbos JB, Deruiter MC. Anatomical basis for nerve-sparing radical hysterectomy: immunohistochemical study of the pelvic autonomic nerves. Acta obstetricia et gynecologica Scandinavica. 2005;84(9):868-74.
- Cibula D, Abu-Rustum NR. Pelvic lymphadenectomy in cervical cancer–surgical anatomy and proposal for a new classification system. Gynecologic oncology. 2010;116(1):33-7.
- Frost JA, Webster KE, Bryant A, Morrison J. Lymphadenectomy for the management of endometrial cancer. Cochrane Database Syst Rev. 2017;10(10):CD007585-CD.
- Lai JC-Y, Lai K-J, Yu EY-Y, Hung S-T, Chu C-Y, Wang K-L. Sentinel lymphatic mapping among women with early-stage cervical cancer: A systematic review. Taiwanese Journal of Obstetrics and Gynecology. 2018;57(5):636-43.
- Wang X-J, Fang F, Li Y-F. Sentinel-lymph-node procedures in early stage cervical cancer: a systematic review and meta-analysis. Med Oncol. 2015;32(1):385-.
- Kadkhodayan S, Hasanzadeh M, Treglia G, Azad A, Yousefi Z, Zarifmahmoudi L, et al. Sentinel node biopsy for lymph nodal staging of uterine cervix cancer: a systematic review and meta-analysis of the pertinent literature. European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology. 2015;41(1):1-20.
- Tax C, Rovers MM, de Graaf C, Zusterzeel PL, Bekkers RL. The sentinel node procedure in early stage cervical cancer, taking the next step; a diagnostic review. Gynecologic oncology. 2015;139(3):559-67.
- Cheng-Yen Lai J, Yang MS, Lu KW, Yu L, Liou WZ, Wang KL. The role of sentinel lymph node biopsy in early-stage cervical cancer: A systematic review. Taiwanese journal of obstetrics & gynecology. 2018;57(5):627-35.
- Costa S, Marra E, Martinelli GN, Santini D, Casadio P, Formelli G, et al. Outcome of conservatively treated microinvasive squamous cell carcinoma of the uterine cervix during a 10-year follow-up. International journal of gynecological cancer : official journal of the International Gynecological Cancer Society. 2009;19(1):33-8.
- Elliott P, Coppleson M, Russell P, Liouros P, Carter J, MacLeod C, et al. Early invasive (FIGO stage IA) carcinoma of the cervix: a clinico-pathologic study of 476 cases. International journal of gynecological cancer : official journal of the International Gynecological Cancer Society. 2000;10(1):42-52.
- van Meurs H, Visser O, Buist MR, Ten Kate FJ, van der Velden J. Frequency of pelvic lymph node metastases and parametrial involvement in stage IA2 cervical cancer: a population-based study and literature review. International journal of gynecological cancer : official journal of the International Gynecological Cancer Society. 2009;19(1):21-6.
- Webb JC, Key CR, Qualls CR, Smith HO. Population-based study of microinvasive adenocarcinoma of the uterine cervix. Obstetrics and gynecology. 2001;97(5 Pt 1):701-6.
- Bouchard-Fortier G, Reade CJ, Covens A. Non-radical surgery for small early-stage cervical cancer. Is it time? Gynecologic oncology. 2014;132(3):624-7.
- Kato T, Takashima A, Kasamatsu T, Nakamura K, Mizusawa J, Nakanishi T, et al. Clinical tumor diameter and prognosis of patients with FIGO stage IB1 cervical cancer (JCOG0806-A). Gynecologic oncology. 2015;137(1):34-9.
- Coutant C, Cordier AG, Guillo E, Ballester M, Rouzier R, Darai E. Clues pointing to simple hysterectomy to treat early-stage cervical cancer. Oncology reports. 2009;22(4):927-34.
- Frumovitz M, Sun CC, Schmeler KM, Deavers MT, Dos Reis R, Levenback CF, et al. Parametrial involvement in radical hysterectomy specimens for women with early-stage cervical cancer. Obstetrics and gynecology. 2009;114(1):93-9.
- Lennox GK, Covens A. Can sentinel lymph node biopsy replace pelvic lymphadenectomy for early cervical cancer? Gynecologic oncology. 2017;144(1):16-20.
- Lecuru FR, McCormack M, Hillemanns P, Anota A, Leitao M, Mathevet P, et al. SENTICOL III: an international validation study of sentinel node biopsy in early cervical cancer. A GINECO, ENGOT, GCIG and multicenter study. International journal of gynecological cancer : official journal of the International Gynecological Cancer Society. 2019;29(4):829-34.
- Handbook of Medical-Surgical Nursing. Fourth ed. Philadelphia: Lippincott Williams & Wilkins; 2006.
- Lim MC, Lee M, Shim SH, Nam EJ, Lee JY, Kim HJ, et al. Practice guidelines for management of cervical cancer in Korea: a Korean Society of Gynecologic Oncology Consensus Statement. Journal of gynecologic oncology. 2017;28(3):e22.
- Ramirez PT, Frumovitz M, Pareja R, Lopez A, Vieira M, Ribeiro R, et al. Minimally Invasive versus Abdominal Radical Hysterectomy for Cervical Cancer. The New England journal of medicine. 2018;379(20):1895-904.
- Cao T, Feng Y, Huang Q, Wan T, Liu J. Prognostic and Safety Roles in Laparoscopic Versus Abdominal Radical Hysterectomy in Cervical Cancer: A Meta-analysis. Journal of laparoendoscopic & advanced surgical techniques Part A. 2015;25(12):990-8.
- Wang YZ, Deng L, Xu HC, Zhang Y, Liang ZQ. Laparoscopy versus laparotomy for the management of early stage cervical cancer. BMC cancer. 2015;15:928.
- Zhao Y, Hang B, Xiong GW, Zhang XW. Laparoscopic Radical Hysterectomy in Early Stage Cervical Cancer: A Systematic Review and Meta-Analysis. Journal of laparoendoscopic & advanced surgical techniques Part A. 2017;27(11):1132-44.
- Holman DA. Fertility Preservation in Gynecologic Cancer. Seminars in oncology nursing. 2019;35(2):202-10.
- Pareja R, Rendon GJ, Sanz-Lomana CM, Monzon O, Ramirez PT. Surgical, oncological, and obstetrical outcomes after abdominal radical trachelectomy – a systematic literature review. Gynecologic oncology. 2013;131(1):77-82.
- Park J-Y, Kim D-Y, Kim J-H, Kim Y-M, Kim Y-T, Nam J-H. Outcomes after radical hysterectomy according to tumor size divided by 2-cm interval in patients with early cervical cancer. Annals of Oncology. 2010;22(1):59-67.
- Plante M, Gregoire J, Renaud M-C, Roy M. The vaginal radical trachelectomy: an update of a series of 125 cases and 106 pregnancies. Gynecologic oncology. 2011;121(2):290-7.
- Marchiole P, Benchaib M, Buenerd A, Lazlo E, Dargent D, Mathevet P. Oncological safety of laparoscopic-assisted vaginal radical trachelectomy (LARVT or Dargent’s operation): a comparative study with laparoscopic-assisted vaginal radical hysterectomy (LARVH). Gynecologic oncology. 2007;106(1):132-41.
- Tempfer CB, Tischoff I, Dogan A, Hilal Z, Schultheis B, Kern P, et al. Neuroendocrine carcinoma of the cervix: a systematic review of the literature. BMC cancer. 2018;18(1):530.
- Huang B-x, Fang F. Progress in the Study of Lymph Node Metastasis in Early-stage Cervical Cancer. Current medical science. 2018;38(4):567-74.
- Kyrgiou M, Athanasiou A, Kalliala IE, Paraskevaidi M, Mitra A, Martin‐Hirsch PP, et al. Obstetric outcomes after conservative treatment for cervical intraepithelial lesions and early invasive disease. Cochrane Database of Systematic Reviews. 2017(11).
- Zhuang H, Hong S, Zheng L, Zhang L, Zhuang X, Wei H, et al. Effects of cervical conisation on pregnancy outcome: a meta-analysis. Journal of Obstetrics and Gynaecology. 2018;39(1):74-81.
- Zhang Q, Li W, Kanis MJ, Qi G, Li M, Yang X, et al. Oncologic and obstetrical outcomes with fertility-sparing treatment of cervical cancer: a systematic review and meta-analysis. Oncotarget. 2017;8(28):46580.
- Partridge AH, Gelber S, Peppercorn J, Sampson E, Knudsen K, Laufer M, et al. Web-based survey of fertility issues in young women with breast cancer. Journal of Clinical Oncology. 2004;22(20):4174-83.
- Ruddy KJ, Gelber SI, Tamimi RM, Ginsburg ES, Schapira L, Come SE, et al. Prospective study of fertility concerns and preservation strategies in young women with breast cancer. Journal of Clinical Oncology. 2014;32(11):1151.
- Atherton PJ, Smith T, Singh JA, Huntington J, Diekmann BB, Huschka M, et al. The relation between cancer patient treatment decision‐making roles and quality of life. Cancer. 2013;119(12):2342-9.
- Letourneau JM, Ebbel EE, Katz PP, Katz A, Ai WZ, Chien AJ, et al. Pretreatment fertility counseling and fertility preservation improve quality of life in reproductive age women with cancer. Cancer. 2012;118(6):1710-7.
- patológico INdCe. Diccionario de Cáncer: estadio clínico: Departamento de Salud y Servicios Humanos de EEUU; [Available from: https://www.cancer.gov/espanol/publicaciones/diccionario/def/estadio-clinico.
- Rogers L, Siu SS, Luesley D, Bryant A, Dickinson HO. Radiotherapy and chemoradiation after surgery for early cervical cancer. The Cochrane database of systematic reviews. 2012(5):Cd007583.
- Skeel RK, SN. Handbook of Cancer Chemotherapy. Décimo Septa ed. Filadelfia: Lippincott Williams & Wilkins; 2007. 896 p.
- Society AC. Radiation Therapy for Cervical Cancer: American Cancer Society; 2016 [Available from: https://www.cancer.org/cancer/cervical-cancer/treating/radiation.html.
- Society AC. Radiation Therapy Basics: American Cancer Society; 2017 [Available from: https://www.cancer.org/treatment/treatments-and-side-effects/treatment-types/radiation/basics.html.
- Delgado G, Bundy B, Zaino R, Sevin B-U, Creasman WT, Major F. Prospective surgical-pathological study of disease-free interval in patients with stage IB squamous cell carcinoma of the cervix: a Gynecologic Oncology Group study. Gynecologic oncology. 1990;38(3):352-7.
- Takekuma M, Kasamatsu Y, Kado N, Kuji S, Tanaka A, Takahashi N, et al. The issues regarding postoperative adjuvant therapy and prognostic risk factors for patients with stage I-II cervical cancer: A review. The journal of obstetrics and gynaecology research. 2017;43(4):617-26.
- Solis JA. Tratamiento adyuvante del cáncer cérvico uterino: Factores de riesgo, indicaciones y tratamiento. Revista chilena de obstetricia y ginecología. 2005;70(1):41-8.
- Asano H, Todo Y, Watari H. Adjuvant chemotherapy for early-stage cervical cancer. Chinese Journal of Cancer Research. 2016;28(2):228.
- Sedlis A, Bundy BN, Rotman MZ, Lentz SS, Muderspach LI, Zaino RJ. A randomized trial of pelvic radiation therapy versus no further therapy in selected patients with stage IB carcinoma of the cervix after radical hysterectomy and pelvic lymphadenectomy: A Gynecologic Oncology Group Study. Gynecologic oncology. 1999;73(2):177-83.
- Falcetta FS, Medeiros LR, Edelweiss MI, Pohlmann PR, Stein AT, Rosa DD. Adjuvant platinum-based chemotherapy for early stage cervical cancer. The Cochrane database of systematic reviews. 2016;11:Cd005342.
- Rotman M, Sedlis A, Piedmonte MR, Bundy B, Lentz SS, Muderspach LI, et al. A phase III randomized trial of postoperative pelvic irradiation in Stage IB cervical carcinoma with poor prognostic features: follow-up of a gynecologic oncology group study. International Journal of Radiation Oncology* Biology* Physics. 2006;65(1):169-76.
- Bilek K, Ebeling K, Leitsmann H, Seidel G. Radical pelvic surgery versus radical surgery plus radiotherapy for stage Ib carcinoma of the cervix uteri. Preliminary results of a prospective randomized clinical study. Archiv fur Geschwulstforschung. 1982;52(3):223-9.
- Peters III WA, Liu P, Barrett RJ, Stock RJ, Monk BJ, Berek JS, et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. Obstetrical & Gynecological Survey. 2000;55(8):491-2.
- UK CR. A prospective randomised trial of adjuvant chemotherapy in node positive early stage carcinoma of the cervix – Protocol CE3005. UK Clinical Trials Register 2001 [3374305]. 2001.
- Group GO. Radiation Therapy With or Without Chemotherapy in Patients With Stage I-IIA Cervical Cancer Who Previously Underwent Surgery. ClinicalTrialsgov Identifier: NCT01101451. 2010.
- Kirwan JM, Symonds P, Green JA, Tierney J, Collingwood M, Williams CJ. A systematic review of acute and late toxicity of concomitant chemoradiation for cervical cancer. Radiotherapy and Oncology. 2003;68(3):217-26.
- Koning CC, Wouterse SJ, Daams JG, Uitterhoeve LL, van den Heuvel MM, Belderbos JS. Toxicity of concurrent radiochemotherapy for locally advanced non–small-cell lung cancer: a systematic review of the literature. Clinical lung cancer. 2013;14(5):481-7.
- Abdel-Razaq W, Alzahrani M, Bustami R, Alolah Y, Almutlag M. Exploring patient’s perceptions of cancer chemotherapy side effects. Education. 2017;60:60.0.
- Benedí JGDR, M. Fármacos antineoplásicos (I). Farmacia Profesional. 2006;20(2):60-5.
- Society AC. How Chemotherapy Drugs Work 2016 [Available from: https://www.cancer.org/treatment/treatments-and-side-effects/treatment-types/chemotherapy/how-chemotherapy-drugs-work.html.
- Administration FaD. TAXOL® (paclitaxel) INJECTION (Patient Information Included). Princeton. 2011.
- Sehouli J, Runnebaum IB, Fotopoulou C, Blohmer U, Belau A, Leber H, et al. A randomized phase III adjuvant study in high-risk cervical cancer: simultaneous radiochemotherapy with cisplatin (S-RC) versus systemic paclitaxel and carboplatin followed by percutaneous radiation (PC-R): a NOGGO-AGO Intergroup Study. Annals of oncology : official journal of the European Society for Medical Oncology. 2012;23(9):2259-64.
- Sun W, Wang T, Shi F, Wang J, Wang J, Hui B, et al. Randomized phase III trial of radiotherapy or chemoradiotherapy with topotecan and cisplatin in intermediate-risk cervical cancer patients after radical hysterectomy. BMC cancer. 2015;15:353.
- Lan M-L, Yu X, Xiao H, Zhou P, Hu N, Liu Y, et al. Comparison of chemoradiotherapy with and without brachytherapy as adjuvant therapy after radical surgery in early-stage cervical cancer with poor prognostic factors: An observational study. Medicine. 2017;96(46).
- Administration FaD. PARAPLATIN® (carboplatin) Injection
- National Comprehensivre Cancer Network. NCCN Chemotherapy Order Templates (NCCN Templates®) Appendix B. National Comprehensivre Cancer Network; 2018.
107. van Warmerdam LJ, Rodenhuis S, ten Bokkel Huinink WW, Maes RA, Beijnen JH. The use of the Calvert formula to determine the optimal carboplatin dosage. Journal of cancer research and clinical oncology. 1995;121(8):478-86.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com

