
GUÍA PRÁCTICA CLÍNICA:
PARA EL DIAGNÓSTICO Y MANEJO DE CÁNCER DE MAMA HER-2
POSITIVO NO METASTÁSICO (2021)
DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- El ámbito asistencial incluye los servicios o unidades de oncología del III nivel de atención, de EsSalud.
Población y alcance
- Población: Pacientes con cáncer de mama HER-2 positivo no metastásico, que incluye estadíos tempranos y localmente avanzados de la enfermedad
- Alcance: diagnóstico y manejo de cáncer de mama HER2+.
Autores
Expertos clínicos:
- Salinas Alva, Edgardo Octaviano.
- Médico oncólogo
- Hospital Nacional Edgardo Rebagliati Martins, EsSalud
- Alarcón Rozas, Ashley Efraín.
- Médico oncólogo
- Hospital Nacional Guillermo Almenara Irigoyen, EsSalud
- Auqui Flores, Rodrigo.
- Médico oncólogo
- Hospital Almanzor Aguinaga Asenjo, EsSalud
- Carnero Fuentes, Oscar Felipe.
- Médico oncólogo
- Hospital Nacional Carlos Alberto Seguin Escobedo, EsSalud
- Castro Vela, Daniel Enrique.
- Médico oncólogo
- Hospital Nacional Guillermo Almenara Irigoyen, EsSalud
Metodólogos:
- Nieto Gutiérrez, Wendy Carolina
- IETSI, EsSalud, Lima, Perú.
- Becerra Chauca, Naysha Yamilet
- IETSI, EsSalud, Lima, Perú.
Coordinadores:
- Salvador Salvador, Stefany
- IETSI, EsSalud, Lima, Perú.
- Carrera Acosta, Lourdes del Rocío
- IETSI, EsSalud, Lima, Perú.
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
Flujograma 1. Flujograma para el diagnóstico de cáncer de mama HER-2 positivo (Parte 1)

Flujograma 2. Flujograma para el diagnóstico de cáncer de mama HER-2 positivo (Parte 2)

Flujograma 3. Flujograma para el tratamiento de cáncer de mama HER-2 positivo
vacio
vacio
1. Biopsia core para evaluar HER-2
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con diagnóstico clínico de cáncer de mama, sugerimos realizar biopsia core para obtener el tejido del tumor primario para la evaluación del estado de HER-2. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
Priorizar la obtención del tejido del tumor primario para la evaluación del estado de HER-2 utilizando una guía ecográfica, en caso de tener disponible el dispositivo y contar con el personal capacitado.
BPC 2:
Utilizar la pieza quirúrgica (es decir el producto de la biopsia por incisión, escisión, cirugía conservadora o mastectomía) para la evaluación del estado de HER-2, cuando solo se cuente con esta pieza como única muestra del tejido.
BPC 3:
Obtener una segunda muestra de tejido del tumor en los siguientes casos:
- La evaluación del HER-2 no sea interpretable en la biopsia core, debido artefactos técnicos (procesamiento o tinción sub-óptimos) o exista dudas acerca el manejo del espécimen.
- Se interprete el estado HER-2 como dudoso tanto en la inmunohistoquímica como en la hibridación in situ.
- El tumor de la pieza quirúrgica sea morfológicamente diferente al de la biopsia core, sin considerar diferencias mínimas como el conteo mitótico o la proporción de áreas sólidas.
- Existan características sugestivas de posible discordancia histopatológica.
- La tinción de la biopsia core sea heterogénea y muestre un foco de positividad para HER-2 menor del 10% de células neoplásicas.
BPC 4:
El diagnóstico de cáncer de mama HER-2 positivo se debe realizar en base a lo reportado de la biopsia obtenida previo al tratamiento.
2. Inmunohistoquímica vs hibridación in situ para evaluar HER-2
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con diagnóstico de cáncer de mama, sugerimos realizar la detección del estado de HER-2 utilizando la Inmunohistoquímica (IHC). (Recomendación condicional a favor, certeza baja de la evidencia)
Recomendación 2:
En caso de haber obtenido un resultado de IHC de 2+, definida como una débil-moderada tinción completa de la membrana observada en más del 10% de las células tumorales, recomendamos realizar hibridación in situ (ISH) para determinar el estado de HER-2. (Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
En pacientes con diagnóstico de cáncer de mama en los que se indique la realización de la ISH, se debe utilizar las técnicas de FISH o CISH, tomando en cuenta la disponibilidad del establecimiento.
BPC 2:
La prueba se rechaza y se repite en cualquiera de los siguientes casos:
IHC
- Los controles no son los esperados
- Los artefactos involucran la mayor parte de la muestra
- La muestra tiene una fuerte tinción de la membrana de los conductos mamarios normales
ISH
- Los controles no son los esperados.
- El observador no puede encontrar ni contar al menos dos áreas de tumor invasivo, producto de que más del 25% de las señales son incalculables por señales débiles o más del 10% de las señales ocurren sobre el citoplasma.
- La resolución nuclear es pobre
- La autofluorescencia es fuerte
- El informe del resultado de la prueba HER-2 se considera como indeterminado según los parámetros descritos.
BPC 3:
En caso de que la determinación del estado de HER-2 se realice mediante el IHC se considerá lo siguiente:
- La prueba de IHC se debe interpretar usando un umbral > 10% de las células tumorales, las cuales deben mostrar un patrón circunferencial oscuro y homogéneo para definir al resultado como HER-2 positivo (IHC 3+).
- Se considerará como un resultado negativo en la IHC en cualquiera de los siguientes casos:
- No observar tinción o la tinción de membrana es incompleta y débil, apenas perceptible, y en ≤ 10% de células tumorales (IHC 0).
- Tinción incompleta de la membrana débil, apenas perceptible, y en> 10% de las células tumorales (IHC 1+).
BPC 4:
En caso de que la determinación del estado de HER-2 se realice mediante ISH, el patólogo debe escanear todo el porta objetos antes de contar al menos 20 células, o utilizar IHC para definir las áreas de potencial amplificación de HER-2.
Si hay una segunda población de células con señales de HER-2 y esta población de células consta de > 10% de células tumorales en el portaobjetos, se debe realizar un recuento por separado de al menos 20 células adicionales que no se superponen dentro de esta población.
BPC 5:
La determinación del estado de HER-2 mediante el ISH clasificará el resultado en alguno de los siguientes grupos:
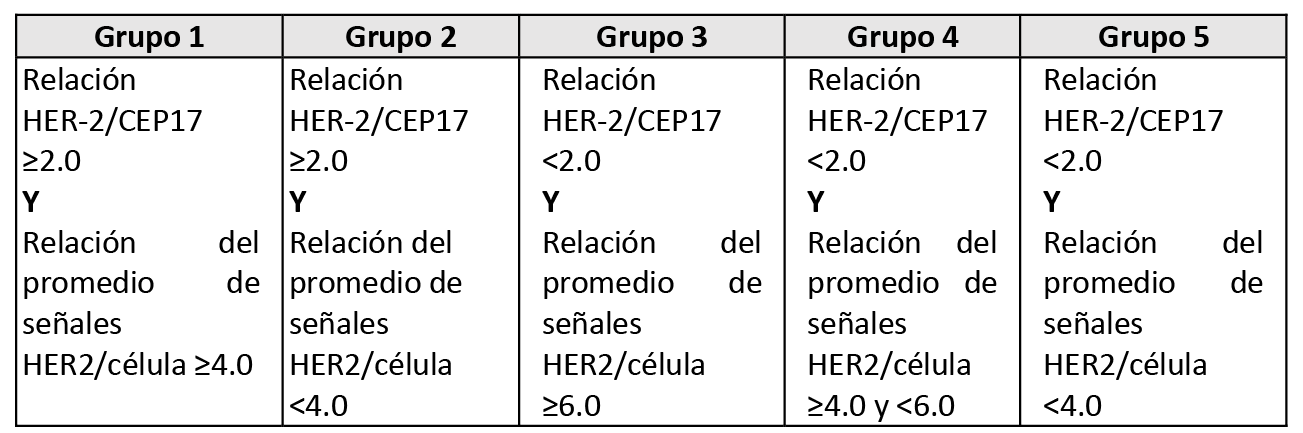
- De contar con los criterios del grupo 1, el diagnóstico será HER-2 positivo
- De contar con los criterios del grupo 2, el diagnóstico definitivo se basará en estudios adicionales utilizando una prueba IHC en la misma muestra del tejido que se utilizó para la evaluación de ISH.
- Si el resultado de IHC es 3+, el diagnóstico es positivo para HER-2.
- Si el resultado de IHC es 2+, el resultado debe ser nuevamente evaluado por un observador cegado a los resultados anteriores de ISH, contando al menos 20 células que incluyen el área de invasión con tinción IHC 2+.
- Si al realizar una prueba de ISH cambia el resultado a otra categoría, el resultado debe ser adjudicado por procedimientos internos para definir la categoría final.
- Si en el recuento se obtiene una relación del promedio de señales HER-2/célula <4.0 y una relación HER-2/CEP17 ≥2.0, el diagnóstico es HER-2 negativo.
- Si el resultado de IHC es 0 o 1+, el diagnóstico es HER-2 negativo.
- De contar con los criterios del grupo 3, el diagnóstico definitivo se basará en estudios adicionales utilizando una nueva prueba de IHC en la misma muestra de tejido utilizo para la evaluación de ISH.
- Si el resultado de IHC es 3+, el diagnóstico es positivo para HER-2.
- Si el resultado de IHC es 2+, el resultado debe ser nuevamente evaluado por un observador cegado a los resultados anteriores de ISH, contando al menos 20 células que incluyen el área de invasión con tinción IHC 2+.
- Si al realizar una prueba de ISH cambia el resultado a otra categoría, el resultado debe ser adjudicado por procedimientos internos para definir la categoría final.
- Si en el recuento se obtiene una relación del promedio de señales HER-2/célula es ≥6.0 y una relación HER-2/CEP17 <2.0, el diagnóstico es HER-2 positivo.
- Si el resultado de IHC es 0 o 1+, el diagnóstico es HER-2 negativo
- De contar con los criterios del grupo 4, el diagnóstico definitivo se basará en estudios adicionales utilizando una nueva prueba de IHC en la misma muestra de tejido utilizo para la evaluación de ISH.
- Si el resultado de IHC es 3+, el diagnóstico es positivo para HER-2
- Si el resultado de IHC es 2+, el resultado debe ser nuevamente evaluado por un observador cegado a los resultados anteriores de ISH, contando al menos 20 células.
- Si la revisión del recuento por parte del observador adicional cambia el resultado a otra categoría de ISH, el resultado debe adjudicarse según los procedimientos internos para definir la categoría final.
- Si en el recuento se obtiene una relación del promedio de señales HER-2/célula es ≥4.0 y <6.0, y una relación HER-2/CEP17 <2.0, el diagnóstico es HER-2 negativo.
- Si el resultado de IHC es 0 o 1+, el diagnóstico es HER-2 negativo.
- De contar con los criterios del grupo 5, el diagnóstico será HER-2 negativo.
BPC 6:
Las muestras citológicas deben ser fijadas lo más pronto posible posterior a la obtención. Se deben fijar en formalina tamponada neutra al 10% durante 6-72 horas, y deben tener un tamaño de 5 a 10 mm.
3. Escala para pronóstico de la enfermedad
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En pacientes con cáncer de mama HER 2 positivo que recibieron terapia neoadyuvante, utilizar la escala Residual Cancer Burden para la evaluación del pronóstico de la enfermedad posterior a la terapia.

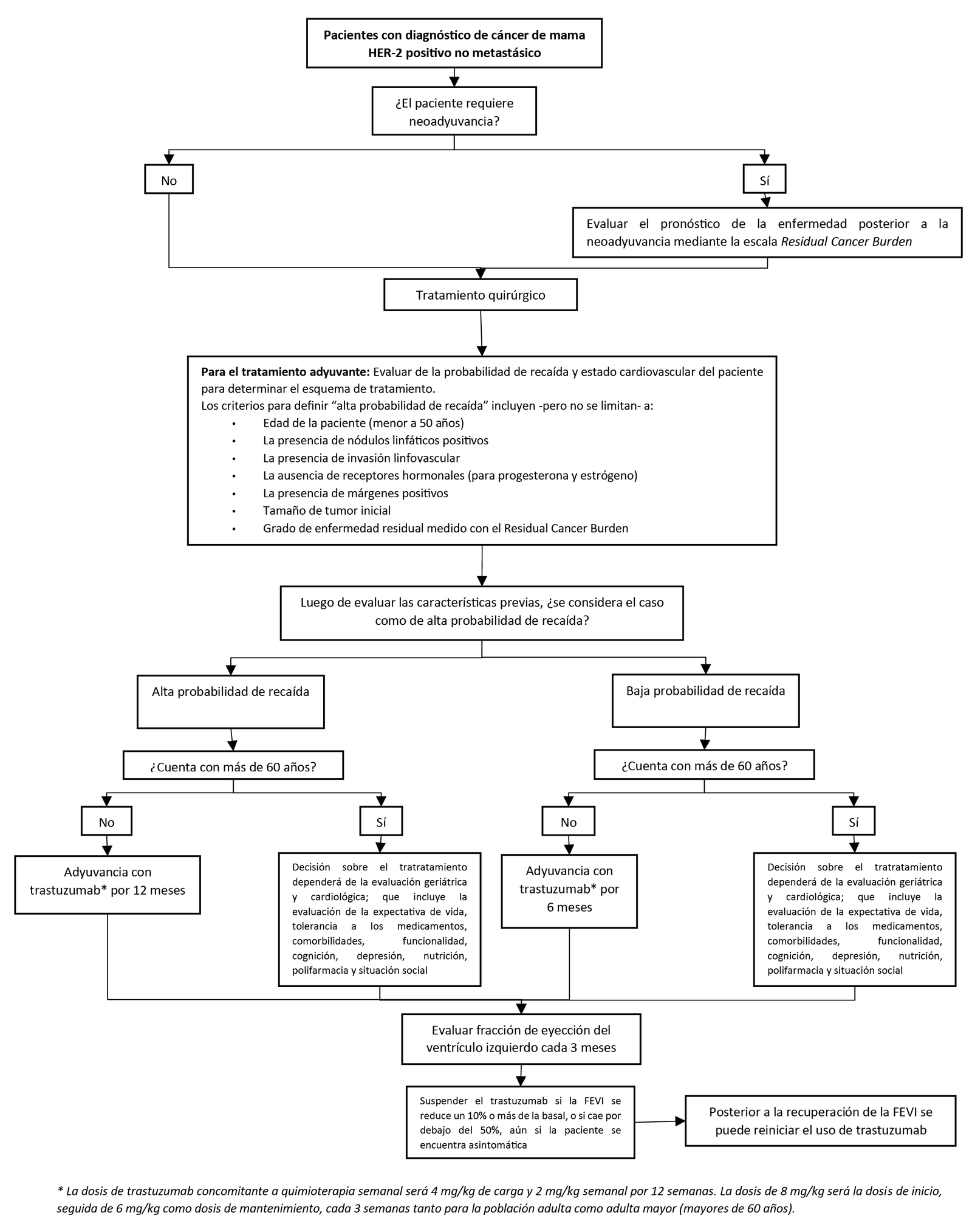
4. Tratamiento adyuvante con trastuzumab: 6 vs 12 meses
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En personas con cáncer de mama HER-2 positivo no metastásica y alta probabilidad de recaída, brindar trastuzumab adyuvante por 12 meses (Recomendación por consenso de expertos clínicos)
Recomendación 2:
En personas con cáncer de mama HER-2 positivo no metastásica y baja probabilidad de recaída, sugerimos brindar trastuzumab adyuvante por 6 meses. (Recomendación condicional a favor, certeza moderada de la evidencia)
BPC 1:
Los criterios para definir “alta probabilidad de recaída” incluyen -pero no se limitan- a:
- Edad de la paciente (menor a 50 años)
- La presencia de nódulos linfáticos positivos
- La presencia de invasión linfovascular
- La ausencia de receptores hormonales (para progesterona y estrógeno)
- La presencia de márgenes positivos
- Tamaño de tumor inicial
- Grado de enfermedad residual medido con el Residual Cancer Burden
BPC 2:
La dosis concomitante a quimioterapia semanal será 4 mg/kg de carga y 2 mg/kg semanal por 12 semanas. La dosis de 8 mg/kg será la dosis de inicio, seguida de 6 mg/kg como dosis de mantenimiento, cada 3 semanas.
BPC 3:
Previo al tratamiento se debe realizar un examen físico general, con precaución en la evaluación neurológica, y de ser necesario considerar la necesidad de exámenes adicionales. Así mismo, se debe evaluar la fracción de eyección del ventrículo izquierdo (FEVI) antes del inicio del tratamiento con trastuzumab y cada 3 meses durante el mismo.
- Se debe suspender el trastuzumab si la FEVI se reduce un 10% o más de la basal, o si cae por debajo del 50%, aún si la paciente se encuentra asintomática.
- Posterior a la recuperación de la FEVI, se puede reiniciar el uso del trastuzumab.
BPC 4:
En pacientes con cáncer de mama temprano y localmente avanzado no metastásico HER-2 positivo, se evitará administrar trastuzumab de manera concomitante a la administración de antraciclinas.
BPC 5:
En pacientes con cáncer de mama temprano y localmente avanzado HER-2 positivo, se evitará retrasar el inicio de trastuzumab adjuvante debido a la potencial disminución de sus beneficios.
5. Trastuzumab en adultos mayores
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos mayores (60 años a más) con cáncer de mama HER-2 positivo no metastásico, sugerimos adicionar trastuzumab a la quimioterapia adyuvante. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En adultos mayores (60 años a más) con cáncer de mama HER-2 positivo no metastásico, la decisión sobre el tratratamiento dependerá de la evaluación geriátrica y cardiológica; que incluye la evaluación de la expectativa de vida, tolerancia a los medicamentos, comorbilidades, funcionalidad, cognición, depresión, nutrición, polifarmacia y situación social; y no solo de la edad cronológica.
BPC 2:
En adultos mayores (60 años a más) con cáncer de mama HER-2 positivo no metastásico, se evitará administrar trastuzumab de manera concomitante a la administración de antraciclinas.
BPC 3:
La dosis de trastuzumab para esta población será la misma que para la población general:
- La dosis concomitante a quimioterapia semanal será 4 mg/kg de carga y 2 mg/kg semanal por 12 semanas.
- La dosis de 8 mg / kg como dosis de inicio, seguida de 6 mg / kg como dosis de mantenimiento, cada 3 semanas, respectivamente.
Referencias bibliográficas
- World Health Organization [Internet]. WHO: 2021; Suecia [citado 4 oct 2021] Breast Cancer [Available from: https://www.who.int/es/news-room/fact-sheets/detail/breast-cancer.
- Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science. 1989;244(4905):707-12.
- Callahan R, Hurvitz S. Human epidermal growth factor receptor-2-positive breast cancer: Current management of early, advanced, and recurrent disease. Curr Opin Obstet Gynecol. 2011;23(1):37-43.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Wöckel A, Albert U-S, Janni W, Scharl A, Kreienberg R, Stüber T. The Screening, Diagnosis, Treatment, and Follow-Up of Breast Cancer. Dtsch Arztebl Int. 2018;115(18):316-23.
- Agency for Healthcare Research and Quality. Core Needle and Open Surgical Biopsy for Diagnosis of Breast Lesions. In: Department of Health and Human Services, editor. USA: Brown Evidence-Based Practice Center; 2014.
- Chen X, Yuan Y, Gu Z, Shen K. Accuracy of estrogen receptor, progesterone receptor, and HER2 status between core needle and open excision biopsy in breast cancer: a meta-analysis. Breast cancer research and treatment. 2012;134(3):957-67.
- Knuttel FM, Menezes GL, van Diest PJ, Witkamp AJ, van den Bosch MA, Verkooijen HM. Meta-analysis of the concordance of histological grade of breast cancer between core needle biopsy and surgical excision specimen. The British journal of surgery. 2016;103(6):644-55.
- Wang M, He X, Chang Y, Sun G, Thabane L. A sensitivity and specificity comparison of fine needle aspiration cytology and core needle biopsy in evaluation of suspicious breast lesions: A systematic review and meta-analysis. Breast. 2017;31:157-66.
- Wolff AC, Hammond ME, Hicks DG, Dowsett M, McShane LM, Allison KH, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2013;31(31):3997-4013.
- Pauletti G, Dandekar S, Rong H, Ramos L, Peng H, Seshadri R, et al. Assessment of methods for tissue-based detection of the HER-2/neu alteration in human breast cancer: a direct comparison of fluorescence in situ hybridization and immunohistochemistry. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2000;18(21):3651-64.
- Cuadros M, Villegas R. Systematic review of HER2 breast cancer testing. Applied immunohistochemistry & molecular morphology : AIMM. 2009;17(1):1-7.
- Bahreini F, Soltanian AR, Mehdipour P. A meta-analysis on concordance between immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH) to detect HER2 gene overexpression in breast cancer. Breast cancer (Tokyo, Japan). 2015;22(6):615-25.
- Grazziotin LR, Dada BR, de la Rosa Jaimes C, Cheung WY, Marshall DA. Chromogenic and Silver in Situ Hybridization for Identification of HER 2 Overexpression in Breast Cancer Patients: A Systematic Review and Meta-Analysis. Applied immunohistochemistry & molecular morphology : AIMM. 2020;28(6):411-21.
- Wolff AC, Hammond MEH, Allison KH, Harvey BE, Mangu PB, Bartlett JMS, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2018;36(20):2105-22.
- Bui MM, Riben MW, Allison KH, Chlipala E, Colasacco C, Kahn AG, et al. Quantitative Image Analysis of Human Epidermal Growth Factor Receptor 2 Immunohistochemistry for Breast Cancer: Guideline From the College of American Pathologists. Arch Pathol Lab Med. 2019;143(10):1180-95.
- Hamy A-S, Darrigues L, Laas E, De Croze D, Topciu L, Lam G-T, et al. Prognostic value of the Residual Cancer Burden index according to breast cancer subtype: Validation on a cohort of BC patients treated by neoadjuvant chemotherapy. PLoS One. 2020;15(6):e0234191-e.
- Hatzis C, Gould R, Zhang Y, Abu-Khalaf M, Chung G, Sanft T, et al. Abstract P6-06-37: Predicting improvements in survival based on improvements in pathologic response rate to neoadjuvant chemotherapy in different breast cancer subtypes. Cancer Research. 2013;73(24 Supplement):P6-06-37-P6-06-37.
- Müller HD, Posch F, Suppan C, Bargfrieder U, Gumpoldsberger M, Hammer R, et al. Validation of Residual Cancer Burden as Prognostic Factor for Breast Cancer Patients After Neoadjuvant Therapy. Ann Surg Oncol. 2019;26(13):4274-83.
- Symmans WF, Wei C, Gould R, Yu X, Zhang Y, Liu M, et al. Long-Term Prognostic Risk After Neoadjuvant Chemotherapy Associated With Residual Cancer Burden and Breast Cancer Subtype. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2017;35(10):1049-60.
- Campbell JI, Yau C, Krass P, Moore D, Carey LA, Au A, et al. Comparison of residual cancer burden, American Joint Committee on Cancer staging and pathologic complete response in breast cancer after neoadjuvant chemotherapy: results from the I-SPY 1 TRIAL (CALGB 150007/150012; ACRIN 6657). Breast cancer research and treatment. 2017;165(1):181-91.
- Deng H, Du X, Wang L, Chen M. Six Months vs. 12 Months of Adjuvant Trastuzumab Among Women With HER2-Positive Early-Stage Breast Cancer: A Meta-Analysis of Randomized Controlled Trials. Frontiers in oncology. 2020;10:288.
- Eiger D, Franzoi MA, Pondé N, Brandão M, de Angelis C, Schmitt Nogueira M, et al. Cardiotoxicity of trastuzumab given for 12 months compared to shorter treatment periods: a systematic review and meta-analysis of six clinical trials. ESMO open. 2020;5(1).
- Stewart P, Blanchette P, Shah PS, Ye XY, Boldt RG, Fernandes R, et al. Do all patients with HER2 positive breast cancer require one year of adjuvant trastuzumab? A systematic review and meta-analysis. Breast (Edinburgh, Scotland). 2020;54:203-10.
- Goldvaser H, Korzets Y, Shepshelovich D, Yerushalmi R, Sarfaty M, Ribnikar D, et al. Deescalating Adjuvant Trastuzumab in HER2-Positive Early-Stage Breast Cancer: A Systemic Review and Meta-Analysis. JNCI cancer spectrum. 2019;3(2):pkz033.
- Chen L, Zhou W, Hu X, Yi M, Ye C, Yao G. Short-duration versus 1-year adjuvant trastuzumab in early HER2 positive breast cancer: A meta-analysis of randomized controlled trials. Cancer treatment reviews. 2019;75:12-9.
- Inno A, Barni S, Ghidini A, Zaniboni A, Petrelli F. One year versus a shorter duration of adjuvant trastuzumab for HER2-positive early breast cancer: a systematic review and meta-analysis. Breast cancer research and treatment. 2019;173(2):247-54.
- Pivot X, Romieu G, Debled M, Pierga JY, Kerbrat P, Bachelot T, et al. 6 months versus 12 months of adjuvant trastuzumab in early breast cancer (PHARE): final analysis of a multicentre, open-label, phase 3 randomised trial. Lancet (London, England). 2019;393(10191):2591-8.
- Pivot X, Romieu G, Debled M, Pierga JY, Kerbrat P, Bachelot T, et al. 6 months versus 12 months of adjuvant trastuzumab for patients with HER2-positive early breast cancer (PHARE): a randomised phase 3 trial. The Lancet Oncology. 2013;14(8):741-8.
- Mavroudis D, Saloustros E, Malamos N, Kakolyris S, Boukovinas I, Papakotoulas P, et al. Six versus 12 months of adjuvant trastuzumab in combination with dose-dense chemotherapy for women with HER2-positive breast cancer: a multicenter randomized study by the Hellenic Oncology Research Group (HORG). Annals of oncology : official journal of the European Society for Medical Oncology. 2015;26(7):1333-40.
- Earl HM, Hiller L, Vallier AL, Loi S, McAdam K, Hughes-Davies L, et al. 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial. Lancet (London, England). 2019;393(10191):2599-612.
- Instituto de Evaluación de Tecnología en Salud e Investigación. DICTAMEN METODOLÓGICO DE EVALUACIÓN DE TECNOLOGÍA SANITARIA N. ° 004-SDEPFYOTS-DETS-IETSI-2017 VALIDEZ DE LA SOBREVIDA LIBRE DE PROGRESIÓN COMO DESENLACE SUBROGADO DE LA SOBREVIDA GLOBAL O CALIDAD DE VIDA EN PACIENTES CON CÁNCER DE MAMA LOCALMENTE AVANZADO. Lima: Instituto de Evalaución de TEcnología en Salud e Investigación; 2017.
- Cardoso F, Kyriakides S, Ohno S, Penault-Llorca F, Poortmans P, Rubio I, et al. Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2019;30(8):1194-220.
- Ministerio de Salud y Protección Social. Guía de Práctica Clínica para tratamiento integral, seguimiento y rehabilitación del cáncer de mama. 2º ed. Bogotá D.C.: Ministerio de Salud y Protección Social; 2017.
- National Institute for Health and Care Excellence. Early and locally advanced breast cancer: diagnosis and management. London: National Institute for Health and Care Excellence,; 2018.
- Wiseman R, Riddin J, Jugathpal J, Parrish A, Ruff P, Blockman M. Adjuvant trastuzumab in early HER2-positive breast cancer: Journeying towards the optimal duration of therapy in South Africa. South African Medical Journal. 2020;110(4):271-3.
- Earl HM, Hiller L, Dunn J, Macpherson I, Rea D, Hughes-Davies L, et al. Optimising the Duration of Adjuvant Trastuzumab in Early Breast Cancer in the UK. Clin Oncol (R Coll Radiol). 2021;33(1):15-9.
- Taylor MA, Byers KF, Meisel JL. Optimizing the Duration of Trastuzumab: A Fresh Perspective. Oncology (Williston Park, NY). 2020;34(8):296-301.
- Denduluri N, Chavez-MacGregor M, Telli ML, Eisen A, Graff SL, Hassett MJ, et al. Selection of optimal adjuvant chemotherapy and targeted therapy for early breast cancer: ASCO clinical practice guideline focused update. Journal of Clinical Oncology. 2018;36(23):2433-43.
- de la Peña FA, Andrés R, Garcia-Saenz JA, Manso L, Margelí M, Dalmau E, et al. SEOM clinical guidelines in early stage breast cancer (2018). Clinical and Translational Oncology. 2019;21(1):18-30.
- Sabel M, Hirsch A, Bellon J. Clinical manifestations and evaluation of locoregional recurrences of breast cancer: UpToDate; 2021 [Available from: https://bibvirtual.upch.edu.pe:2050/contents/clinical-manifestations-and-evaluation-of-locoregional-recurrences-of-breast-cancer?search=BREAST%20CANCER%20RELAPSE&source=search_result&selectedTitle=4~129&usage_type=default&display_rank=4.
- Cheng SH, Horng CF, Clarke JL, Tsou MH, Tsai SY, Chen CM, et al. Prognostic index score and clinical prediction model of local regional recurrence after mastectomy in breast cancer patients. International journal of radiation oncology, biology, physics. 2006;64(5):1401-9.
- de Bock GH, van der Hage JA, Putter H, Bonnema J, Bartelink H, van de Velde CJ. Isolated loco-regional recurrence of breast cancer is more common in young patients and following breast conserving therapy: long-term results of European Organisation for Research and Treatment of Cancer studies. European journal of cancer (Oxford, England : 1990). 2006;42(3):351-6.
- Lupe K, Truong PT, Alexander C, Lesperance M, Speers C, Tyldesley S. Subsets of women with close or positive margins after breast-conserving surgery with high local recurrence risk despite breast plus boost radiotherapy. International journal of radiation oncology, biology, physics. 2011;81(4):e561-8.
- Botteri E, Bagnardi V, Rotmensz N, Gentilini O, Disalvatore D, Bazolli B, et al. Analysis of local and regional recurrences in breast cancer after conservative surgery. Annals of oncology : official journal of the European Society for Medical Oncology. 2010;21(4):723-8.
- Denduluri N, Somerfield MR, Chavez-MacGregor M, Comander AH, Dayao Z, Eisen A, et al. Selection of optimal adjuvant chemotherapy and targeted therapy for early breast cancer: ASCO guideline update. Journal of Clinical Oncology. 2021;39(6):685-93.
- Gallagher CM, More K, Kamath T, Masaquel A, Guerin A, Ionescu-Ittu R, et al. Delay in initiation of adjuvant trastuzumab therapy leads to decreased overall survival and relapse-free survival in patients with HER2-positive non-metastatic breast cancer. Breast cancer research and treatment. 2016;157(1):145-56.
- Gullo G, Walsh N, Fennelly D, Bose R, Walshe J, Tryfonopoulos D, et al. Impact of timing of trastuzumab initiation on long-term outcome of patients with early-stage HER2-positive breast cancer: the «one thousand HER2 patients» project. British journal of cancer. 2018;119(3):374-80.
- Brollo J, Curigliano G, Disalvatore D, Marrone BF, Criscitiello C, Bagnardi V, et al. Adjuvant trastuzumab in elderly with HER-2 positive breast cancer: a systematic review of randomized controlled trials. Cancer treatment reviews. 2013;39(1):44-50.
- Muss HB, Berry DA, Cirrincione CT, Theodoulou M, Mauer AM, Kornblith AB, et al. Adjuvant chemotherapy in older women with early-stage breast cancer. N Engl J Med. 2009;360(20):2055-65.
- Kimmick G, Seo P, Hans W. Overview of the approach to early breast cancer in older women: UpToDate; 2021 [
- Sawaki M, Taira N, Uemura Y, Saito T, Baba S, Kobayashi K, et al. Randomized Controlled Trial of Trastuzumab With or Without Chemotherapy for HER2-Positive Early Breast Cancer in Older Patients. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2020;38(32):3743-52.
- Perez EA, Suman VJ, Davidson NE, Sledge GW, Kaufman PA, Hudis CA, et al. Cardiac safety analysis of doxorubicin and cyclophosphamide followed by paclitaxel with or without trastuzumab in the North Central Cancer Treatment Group N9831 adjuvant breast cancer trial. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2008;26(8):1231-8.
- Romond EH, Jeong J-H, Rastogi P, Swain SM, Geyer CE, Jr., Ewer MS, et al. Seven-year follow-up assessment of cardiac function in NSABP B-31, a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel (ACP) with ACP plus trastuzumab as adjuvant therapy for patients with node-positive, human epidermal growth factor receptor 2-positive breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2012;30(31):3792-9.
- Cancer Australia. Guidance for the management of early breast cancer: Recommendations and practice points. Surry Hills: Cancer Australia; 2020.
- Du XL, Xia R, Burau K, Liu CC. Cardiac risk associated with the receipt of anthracycline and trastuzumab in a large nationwide cohort of older women with breast cancer, 1998-2005. Medical oncology (Northwood, London, England). 2011;28 Suppl 1:S80-90.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com

