DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- El ámbito asistencial incluye los servicios o unidades de gineco-obstetricia, obstetricia, medicina familiar y medicina general de cada nivel de EsSalud
Población y alcance
- Población: pacientes con riesgo o diagnóstico de hipertensión gestacional.
- Alcance: prevención y manejo de hipertensión gestacional
Autores
Expertos clínicos:
- Omar Yanque Robles
Hospital Edgardo Rebagliati Martins, EsSalud - Raúl Alegría Guerrero
Hospital Guillermo Almenara Irigoyen, EsSalud - Marco Uriarte Morales
Hospital II Ramón Castilla, EsSalud - Wilmer Valencia Vargas
Policlínico Chincha, EsSalud - Jorge Arroyo Campuzano
Hospital Alberto Sabogal Sologuren, EsSalud - Lourdes Sheillah Torres Peña
Hospital Luis Negreiros Vega, EsSalud - Rita Ada Meza Padilla
Gerencia Central de Prestaciones, EsSalud - Carmen Meza Luis
Gerencia Central de Prestaciones, EsSalud
Metodólogos:
- Naysha Yamilet Becerra Chauca
IETSI, EsSalud - Wendy Carolina Nieto Gutiérrez
IETSI, EsSalud
Coordinadores:
- Stefany Salvador Salvador
IETSI, EsSalud - Lourdes del Rocío Carrera Acosta
IETSI, EsSalud
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC

vacio
vacio
1. Ácido acetilsalicílico para prevenir preeclampsia
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En gestantes con riesgo de desarrollar preeclampsia, recomendamos brindar ácido acetilsalicílico a una dosis de entre 100 a 150 mg desde las 12 a 16 semanas de gestación. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BPC 1:
Se define como gestante con riesgo de desarrollar preeclampsia a aquella gestante que cuenta con alguno de los siguientes criterios:
- Antecedente de enfermedad hipertensiva en el embarazo anterior
- Enfermedad renal crónica
- Enfermedad autoinmune como lupus eritematoso sistémico o síndrome antifosfolípido
- Diabetes tipo 1 o tipo 2
- Hipertensión crónica
O, se puede considerar como gestante en riesgo de desarrollar preeclampsia cuando presenta al menos dos de los siguientes criterios:
- Primer embarazo
- Edad ≥40 años
- Intervalo intergenésico > 10 años
- Índice de masa corporal ≥30 kg/m2 durante el primer control
- Antecedentes familiares de preeclampsia
- Embarazo múltiple
- Uso de técnicas de reproducción asistida
El uso de indicadores basados en ultrasonografía Doppler, como la pulsatilidad de la arteria uterina, podrán realizarse solo cuando el médico lo crea justificado y si está disponible. Se tendrá en cuenta que esta prueba ha demostrado baja sensibilidad, por ende, el inicio de ácido acetilsalicílico no será restringido ni retrasado únicamente en base a los resultados de dichos estudios.
BPC 2:
Si el primer control prenatal de la gestante con riesgo de desarrollar preeclampsia se realizó después de las 16 semanas de gestación, el inicio de ácido acetilsalicílico puede extenderse hasta antes de las 20 semanas de gestación.
La indicación de ácido acetilsalicílico será hasta la detección de la preeclampsia o hasta las 36 semanas de gestación, lo que ocurra primero.
BPC 3:
Se indicará a todas las gestantes 2000 mg diario de calcio desde las 20 semanas de gestación hasta el final del embarazo.
BPC 4:
En pacientes con riesgo de desarrollar preeclampsia se debe realizar una referencia a un nivel de atención de salud con una mayor capacidad resolutiva (nivel II o III); sin embargo, esto no debe retrasar el inicio de la terapia con ácido acetilsalicílico en el establecimiento de salud donde se haya identificado el riesgo.
2. Antihipertensivos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En gestantes con hipertensión gestacional leve con o sin preeclampsia sugerimos no brindar antihipertensivos. (Recomendación condicional en contra, certeza muy baja de la evidencia)
BPC 1:
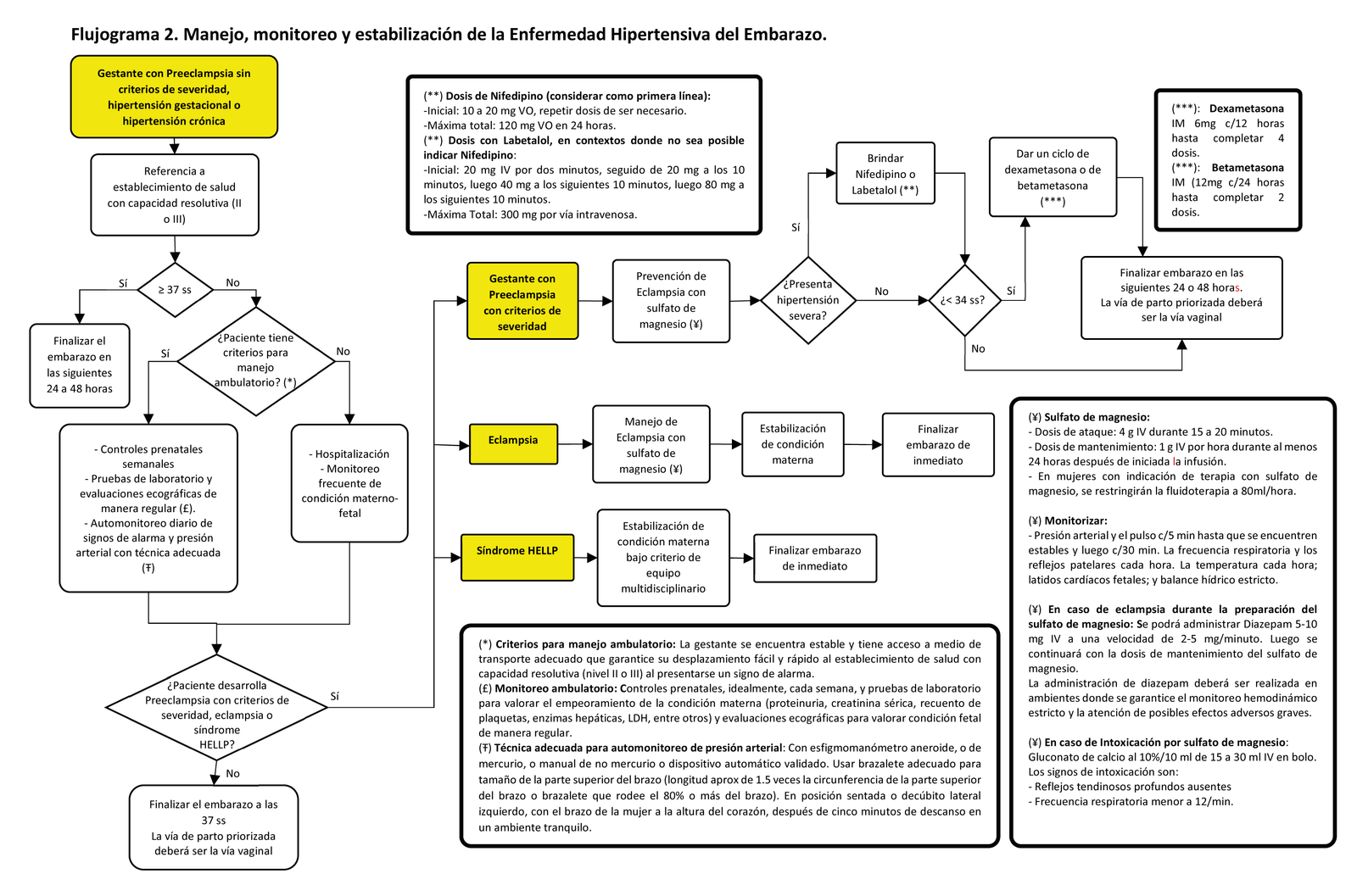
En gestantes con hipertensión gestacional leve con o sin preeclampsia, o con hipertensión crónica, se debe realizar referencia a establecimiento de salud con capacidad resolutiva (nivel II o III).
BPC 2:
Las mujeres con diagnóstico de preeclampsia sin criterios de severidad podrían ser atendidas de manera ambulatoria solo si se determina, a criterio médico, que la gestante se encuentra estable y que tenga tiene acceso a un medio de transporte adecuado que garantice un desplazamiento fácil y rápido al establecimiento de salud con capacidad resolutiva (nivel II o III) al presentarse un signo de alarma.
BPC 3:
Las mujeres con hipertensión gestacional leve, preeclampsia sin criterios de severidad, o con hipertensión crónica; quienes estén con manejo ambulatorio; deberán tener controles prenatales, idealmente cada semana, y se le deberán realizar pruebas de laboratorio para valorar el empeoramiento de la condición materna (proteinuria, creatinina sérica, recuento de plaquetas, enzimas hepáticas, LDH, entre otros) así como evaluaciones ecográficas para valorar condición fetal de manera regular.
BPC 4:
En gestantes con hipertensión gestacional, hipertensión crónica, o preeclampsia con o sin criterios de severidad, realizar el monitoreo de la presión arterial con la técnica adecuada:
- Con esfigmomanómetro aneroide, de mercurio, manual de no mercurio o dispositivo automático validado.
- Usar brazalete adecuado para tamaño de la parte superior del brazo (longitud 1.5 veces la circunferencia de la parte superior del brazo o brazalete que rodee el 80% o más del brazo).
- En posición sentada o decúbito lateral izquierdo, con el brazo de la mujer a la altura del corazón.
Después de cinco minutos de descanso en un ambiente tranquilo.
BPC 5:
En gestantes con hipertensión gestacional, hipertensión crónica o preeclampsia sin criterios de severidad; quienes estén con manejo ambulatorio; brindar educación sobre el automonitoreo diario de la presión arterial y signos de alarma obstétricos. Asimismo, de experimentar alguno de esos signos o el aumento de la presión arterial, se debe remarcar la necesidad de acudir de inmediato al establecimiento de salud con capacidad resolutiva (nivel II o III).
3. Sulfato de magnesio en preeclampsia
Descargar PDF con el desarrollo de la pregunta.
En gestantes con preeclampsia con criterios de severidad recomendamos:
Recomendación 1:
Brindar sulfato de magnesio. (Recomendación fuerte a favor, certeza moderada de la evidencia)
Recomendación 1:
Brindar sulfato de magnesio en lugar de diazepam. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 1:
Brindar sulfato de magnesio en lugar de fenitoína. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
En gestantes con preeclampsia con criterios de severidad, el sulfato de magnesio será administrado de la siguiente manera:
- Dosis de ataque: 4 g IV durante 15 a 20 minutos.
- Dosis de mantenimiento: 1 g IV por hora durante al menos 24 horas después de iniciada la infusión.
- Dosis máxima: 40 g en 24 horas
BPC 2:
En mujeres que reciben sulfato de magnesio se deberá monitorizar lo siguiente durante todo el tiempo en que lo reciben:
– La presión arterial y el pulso cada 5 minutos hasta que vuelvan a su estado basal, y luego cada 30 minutos.
– La frecuencia respiratoria y los reflejos patelares cada hora
– La temperatura cada hora
– Latidos cardíacos fetales
– Balance hídrico estricto
BPC 3:
En caso de intoxicación por sulfato de magnesio, se administrará gluconato de calcio al 10%/10 ml de 15 a 30 ml IV en bolo por 5 minutos.
Los signos de intoxicación son:
– Reflejos tendinosos profundos ausentes
– Frecuencia respiratoria menor a 12/min.
Tomar en cuenta que la pérdida de reflejo patelar suele aparecer con concentración plasmática de magnesio de 3.5 a 5 mmol/L (9–12 mg/dL), la parálisis respiratoria con 6 a 7 mmol/L (15–17 mg/dL), alteraciones cardíacas desde 7.5 mmol/L.
BPC 4:
En mujeres con indicación de terapia con sulfato de magnesio, se restringirá la fluidoterapia a 80ml/hora.
4. Nifedipino, labetalol e hidralazina
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En gestantes con hipertensión severa, sugerimos brindar nifedipino como terapia antihipertensiva de primera línea. (Recomendación condicional favor, certeza baja de la evidencia)
Recomendación 2:
En gestantes con hipertensión severa, sugerimos brindar labetalol como terapia antihipertensiva alternativa al nifedipino. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
La dosis con nifedipino es:
- Inicial: 10 a 20 mg VO, repetir dosis de ser necesario.
- Máxima total: 120 mg VO en 24 horas.
La dosis con labetalol es:
- Inicial: 20 mg IV por dos minutos, seguido de 20 mg a los 10 minutos, luego 40 mg a los siguientes 10 minutos, luego 80 mg a los siguientes 10 minutos.
- Máxima Total: 300 mg por vía intravenosa.
BPC 2:
La elección del uso de labetalol para la hipertensión severa durante el embarazo, debe basarse principalmente en la experiencia de uso del equipo de salud que lo administrará, aceptación de la gestante, la presencia de contraindicaciones del uso del nifedipino y la disponibilidad local.
BPC 3:
Se restringirá el uso de diuréticos salvo a las mujeres que presenten sobrecarga de líquidos o a quienes, de acuerdo al criterio médico, lo necesiten.
5. Resolución del embarazo
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En gestantes con preeclampsia con criterios de severidad, sugerimos brindar un manejo intervencionista y finalizar el embarazo dentro de las 24 a 48 horas siguientes al diagnóstico. (Recomendación condicional a favor, certeza muy baja de la evidencia)
Observación: Un grupo estrictamente seleccionado de mujeres con preeclampsia con criterios de severidad puede tener un manejo expectante si, a criterio médico, el estado materno-fetal lo permite y se cuenta con los recursos humanos y materiales necesarios para el monitoreo estricto de la condición materno-fetal. El manejo intervencionista incluye la maduración fetal.
BCP 1:
En mujeres que tienen una edad gestacional confiable de 24+0 a 33+6 semanas, en quienes el parto pretérmino es considerado inminente (como en mujeres con preeclampsia con criterios de severidad) y no haya evidencia clínica de infección, brindar corticoides prenatales.
Cuando se decida administrar corticoides prenatales, brindar un ciclo de dexametasona IM (6mg cada 12 horas hasta completar 4 dosis) o de betametasona IM (12mg cada 24 horas hasta completar 2 dosis).
No se administrará una segunda dosis de sulfato de magnesio para neuroprotección fetal a las mujeres que ya hayan recibido dosis de sulfato de magnesio para prevención y/o recurrencia de eclampsia.
BCP 2:
En gestantes con menos de 37 semanas y preeclampsia sin criterios de severidad, o hipertensión gestacional, o hipertensión crónica, la finalización del embarazo se manejará de manera expectante hasta cumplir las 37 semanas, o hasta que la gestante desarrolle preeclampsia con criterios de severidad, o hasta que exista alguna indicación adicional para la finalización del embarazo (cualquiera que ocurra primero).
BPC 3:
En gestantes con 37 semanas de gestación a más, y preeclampsia sin criterios de severidad, hipertensión gestacional o hipertensión crónica, se finalizará el embarazo dentro de las 24 a 48 horas.
BPC 4:
En gestantes con eclampsia o síndrome HELLP, se finalizará la gestación independientemente de la edad gestacional.
BPC 5:
La vía de parto priorizada deberá ser la vía vaginal. La preeclampsia por sí sola no es una indicación de parto por cesárea a menos que exista alguna contraindicación que comprometa a la madre y/o al feto.
6. Sulfato de magnesio en eclampsia
Descargar PDF con el desarrollo de la pregunta.
En gestantes con eclampsia recomendamos:
Recomendación 1:
Brindar sulfato de magnesio en lugar de diazepam.(Recomendación fuerte a favor, certeza baja de la evidencia)
Recomendación 2:
Brindar sulfato de magnesio en lugar de fenitoína.(Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
En gestantes con eclampsia, el uso de diazepam o fenitoína será considerado solo en caso no se tenga disponible el sulfato de magnesio.
BPC 2:
En gestantes con eclampsia, el sulfato de magnesio será administrado de la siguiente manera:
- Dosis de ataque: 4 g IV durante 20 minutos.
- Dosis de mantenimiento: 1 g IV por hora durante al menos 24 horas después de iniciada la infusión
Dosis máxima: 40 g en 24 horas
BPC 3:
Si la gestante tiene otro episodio de eclampsia durante la preparación del sulfato de magnesio, se podrá administrar Diazepam 5-10 mg IV a una velocidad de 2-5 mg/minuto. Luego se continuará con la dosis de mantenimiento del sulfato de magnesio.
La administración de diazepam deberá ser realizada en ambientes donde se garantice el monitoreo hemodinámico estricto y la atención de posibles efectos adversos graves.
BPC 4:
Si la gestante tiene otro episodio de eclampsia durante la administración de la dosis de mantenimiento de sulfato de magnesio, se administrará sulfato de magnesio 2 g IV durante cinco minutos. Esta dosis puede repetirse después de dos minutos.
BPC 5:
Durante la administración de sulfato de magnesio se deberá monitorizar:
– La presión arterial y el pulso cada 5 minutos hasta que vuelvan a su estado basal, y luego cada 30 minutos.
– La frecuencia respiratoria y los reflejos patelares cada hora
– La temperatura cada hora
– Latidos cardíacos fetales
– Balance hídrico estricto
BPC 6:
En caso de intoxicación por sulfato de magnesio, se administrará gluconato de calcio al 10%/10 ml, de 15 a 30 ml IV en bolo por 5 minutos.
Los signos de intoxicación son:
– Reflejos tendinosos profundos ausentes
– Frecuencia respiratoria menor a 12/min.
Tomar en cuenta que la pérdida de reflejo patelar suele aparecer con concentración plasmática de magnesio de 3.5 a 5 mmol/L (9–12 mg/dL), la parálisis respiratoria con 6 a 7 mmol/L (15–17 mg/dL), alteraciones cardíacas desde 7.5 mmol/L.
7. Corticoides para el manejo del síndrome HELLP
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En gestantes con síndrome HELLP, sugerimos no brindar corticoesteroides para el manejo específico del síndrome HELLP. (Recomendación condicional en contra, certeza muy baja de la evidencia)
BPC 1:
El manejo del síndrome HELLP se realizará de manera individualizada de acuerdo al criterio del equipo médico interdisciplinario.
8. Monitoreo postparto
Descargar PDF con el desarrollo de la pregunta.
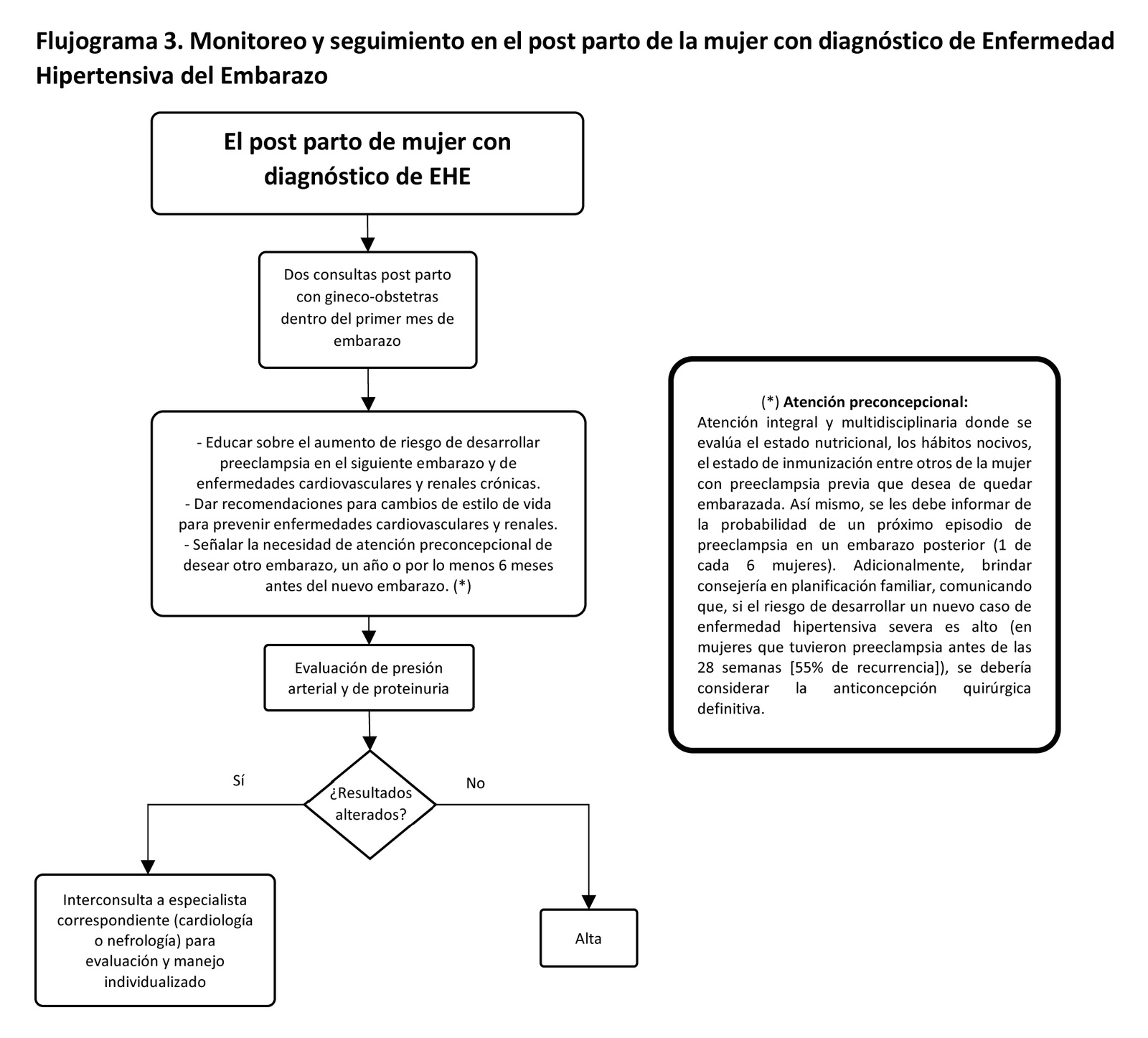
BPC 1:
En mujeres que han tenido preeclampsia, se debe indicar por lo menos dos controles durante el primer mes posterior al parto con el médico gineco-obstetra para el monitoreo de la presión arterial de la paciente, indicación de la evaluación de proteinuria, y consideración de interconsulta a otros servicios especializados (cardiología, nefrología etc.)
BPC 2:
Durante las consultas postnatales de las mujeres que han tenido preeclampsia, se les debe brindar educación sobre el aumento de riesgo de desarrollar enfermedades cardiovasculares y renales crónicas, así como brindar recomendaciones para cambios de estilos de vida con el fin de reducir su riesgo de enfermedades cardiovasculares, en especial mantener un índice de masa corporal dentro del rango saludable antes de su próximo embarazo (18,5 a 24,9 kg/m2).
BPC 3:
De no presentar proteinuria ni hipertensión en la revisión postnatal durante el primer mes posterior al parto, no es necesario realizar un seguimiento adicional por el médico gineco-obstetra. Sin embargo, de identificar proteinuria o hipertensión arterial después del primer mes posterior al parto, se debe realizar interconsulta a la especialidad de nefrología y cardiología, respectivamente, para la evaluación y el monitoreo de la paciente.
BPC 4:
Las mujeres que han tenido preeclampsia deberán recibir una atención preconcepcional integral y multidisciplinaria donde se evalúe el estado nutricional, los hábitos nocivos, el estado de inmunización, entre otros. Así mismo, se les debe informar de la probabilidad de un próximo episodio de preeclampsia en un embarazo posterior (1 de cada 6 mujeres). Adicionalmente, brindar consejería en planificación familiar, comunicando que, si el riesgo de desarrollar un nuevo caso de enfermedad hipertensiva severa es alto (en mujeres que tuvieron preeclampsia antes de las 28 semanas [55% de recurrencia]), se debería considerar la anticoncepción quirúrgica definitiva.
Referencias bibliográficas
- Urquiza JPN, Ávila MTS, Garza LAM, Nava VMS. Enfermedad hipertensiva del embarazo. Medicina Crítica. 2010;24(4):190-5.
- Poon LC, Shennan A, Hyett JA, Kapur A, Hadar E, Divakar H, et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre‐eclampsia: A pragmatic guide for first‐trimester screening and prevention. International Journal of Gynecology & Obstetrics. 2019;145:1-33.
- Sánchez SE. Actualización en la epidemiología de la preeclampsia: update. Revista Peruana de Ginecología y Obstetricia. 2014;60(4):309-20.
- Seguro Social de Salud EsSalud. EsSalud: 8% de aseguradas embarazadas sufren Preeclampsia, principal causa de muerte materna Lima: EsSalud; 2014 [Available from: http://www.essalud.gob.pe/essalud-8-de-aseguradas-embarazadas-sufren-preeclampsia-principal-causa-de-muerte-materna/.
- Centro Nacional de Epidemiología Prevención y Control de Enfermedades. Boletìn Epidemiológico. Lima: Ministerio de Salud; 2020.
- Gestational Hypertension and Preeclampsia: ACOG Practice Bulletin, Number 222. Obstetrics and gynecology. 2020;135(6):e237-e60.
- ACOG Practice Bulletin No. 203: Chronic Hypertension in Pregnancy. Obstetrics and gynecology. 2019;133(1):e26-e50.
- Ditisheim A, Sibai BM. Diagnosis and Management of HELLP Syndrome Complicated by Liver Hematoma. Clinical obstetrics and gynecology. 2017;60(1):190-7.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Ministros PdCd. DS Nº 156-2020-PCM Decreto Supremo que modifica el Decreto Supremo N° 116-2020-PCM, Decreto supremo que establece las medidas que debe seguir la ciudadanía en la nueva convivencia social y prorroga el Estado de Emergencia Nacional por las graves circunstancias que afectan la vida de la Nación a consecuencia del COVID-19, modificado por los Decretos Supremos N° 129-2020-PCM, N° 135-2020-PCM, N° 139-2020-PCM, N° 146-2020-PCM y N° 151-2020-PCM. Lima: Presidencia del Consejo de Ministros; 2020.
- World Health Organization. Prevention and treatment of pre-eclampsia and eclampsia. Ginebra: WHO; 2011.
- Magee L, von Dadelszen P. Prevention and treatment of postpartum hypertension. The Cochrane database of systematic reviews. 2013(4):Cd004351.
- Roberge S, Sibai B, McCaw-Binns A, Bujold E. Low-Dose Aspirin in Early Gestation for Prevention of Preeclampsia and Small-for-Gestational-Age Neonates: Meta-analysis of Large Randomized Trials. Am J Perinatol. 2016;33(8):781-5.
- Roberge S, Bujold E, Nicolaides KH. Aspirin for the prevention of preterm and term preeclampsia: systematic review and metaanalysis. Am J Obstet Gynecol. 2018;218(3):287-93.e1.
- Cui Y, Zhu B, Zheng F. Low-dose aspirin at ≤16 weeks of gestation for preventing preeclampsia and its maternal and neonatal adverse outcomes: A systematic review and meta-analysis. Exp Ther Med. 2018;15(5):4361-9.
- Chaemsaithong P, Cuenca-Gomez D, Plana MN, Gil MM, Poon LC. Does low-dose aspirin initiated before 11 weeks’ gestation reduce the rate of preeclampsia? Am J Obstet Gynecol. 2020;222(5):437-50.
- Turner JM, Robertson NT, Hartel G, Kumar S. Impact of low-dose aspirin on adverse perinatal outcome: meta-analysis and meta-regression. Ultrasound Obstet Gynecol. 2020;55(2):157-69.
- Duley L, Meher S, Hunter KE, Seidler AL, Askie LM. Antiplatelet agents for preventing pre‐eclampsia and its complications. Cochrane Database of Systematic Reviews. 2019(10).
- Van Doorn R, Mukhtarova N, Flyke IP, Lasarev M, Kim K, Hennekens CH, et al. Dose of aspirin to prevent preterm preeclampsia in women with moderate or high-risk factors: A systematic review and meta-analysis. PLoS One. 2021;16(3):e0247782.
- Meher S, Duley L, Hunter K, Askie L. Antiplatelet therapy before or after 16 weeks’ gestation for preventing preeclampsia: an individual participant data meta-analysis. Am J Obstet Gynecol. 2017;216(2):121-8.e2.
- Bartsch E, Medcalf KE, Park AL, Ray JG. Clinical risk factors for pre-eclampsia determined in early pregnancy: systematic review and meta-analysis of large cohort studies. BMJ. 2016;353:i1753.
- Ministry of Health. Diagnosis and Treatment of Hypertension and Pre-eclampsia in Pregnancy in New Zealand. Wellington: Ministry of Health,; 2018.
- Allotey J, Snell KI, Smuk M, Hooper R, Chan CL, Ahmed A, et al. Validation and development of models using clinical, biochemical and ultrasound markers for predicting pre-eclampsia: an individual participant data meta-analysis. Health Technol Assess. 2020;24(72):1-252.
- Antwi E, Amoakoh-Coleman M, Vieira DL, Madhavaram S, Koram KA, Grobbee DE, et al. Systematic review of prediction models for gestational hypertension and preeclampsia. PLoS One. 2020;15(4):e0230955.
- American College of Obstetricians and Gynecologists. Preeclampsia and Pregnancy. USA: ACOG; 2020.
- Velauthar L, Plana M, Kalidindi M, Zamora J, Thilaganathan B, Illanes S, et al. First‐trimester uterine artery Doppler and adverse pregnancy outcome: a meta‐analysis involving 55 974 women. Ultrasound in Obstetrics & Gynecology. 2014;43(5):500-7.
- Ministry of Health. Diagnosis and Treatment of Hypertension and Pre-eclampsia in Pregnancy in New Zealand: A clincial practice guideline. Wellington: Ministry of Health; 2018.
- Churchill D, Duley L, Thornton JG, Moussa M, Ali HS, Walker KF. Interventionist versus expectant care for severe pre-eclampsia between 24 and 34 weeks’ gestation. The Cochrane database of systematic reviews. 2018;10(10):Cd003106.
- Ministerio de Salud del Perú. Norma técnica de salud para la atención integral de salud materna. In: DGSP, editor. Perú: MINSA; 2013.
- American College of Obstetricians and Gynecologists. Low-Dose Aspirin Use During Pregnancy. USA: ACOG; 2018.
- Organisation WH. Recommendations on drug treatment for non-severe hypertension in pregnancy. Geneva: WHO; 2020.
- Instituto Nacional Materno Perinatal. Guía de Práctica Clínica para la prevención y manejo de la preeclampsia y eclampsia – Versión Extensa -. Lima: Unidad de Análisis y Geenración de Evidencia en Salud Pública; 2017.
- Abalos E, Duley L, Steyn DW, Gialdini C. Antihypertensive drug therapy for mild to moderate hypertension during pregnancy. Cochrane database of systematic reviews. 2018(10).
- Queensland Clinical Guidelines. Hypertension and pregnancy: Queensland Clinical Guidelines; 2021.
- National Institute for Health and Care Excellence. Hypertension in pregnancy: diagnosis and managment. London: NICE; 2019.
- Magee LA, Pels A, Helewa M, Rey E, von Dadelszen P. Diagnosis, evaluation, and management of the hypertensive disorders of pregnancy. Pregnancy hypertension. 2014;4(2):105-45.
- Magee LA, Yong PJ, Espinosa V, Côté AM, Chen I, von Dadelszen P. Expectant management of severe preeclampsia remote from term: a structured systematic review. Hypertension in pregnancy. 2009;28(3):312-47.
- Tukur J. The use of magnesium sulphate for the treatment of severe pre-eclampsia and eclampsia. Annals of African Medicine. 2009;8(2).
- Rodríguez C, Guevara B, Lobo G. Mecanismo de Acción de los Fármacos Antiepilépticos. Informe medico. 2010;12(6):321-6.
- Su Mark AA. Phenytoin poisoning: UpToDate; 2019 [
- Duley L, Gülmezoglu AM, Henderson‐Smart DJ, Chou D. Magnesium sulphate and other anticonvulsants for women with pre‐eclampsia. Cochrane database of systematic reviews. 2010(11).
- Shepherd E, Salam RA, Manhas D, Synnes A, Middleton P, Makrides M, et al. Antenatal magnesium sulphate and adverse neonatal outcomes: A systematic review and meta-analysis. PLoS medicine. 2019;16(12):e1002988.
- Khooshideh M, Ghaffarpour M, Bitarafan S. The comparison of anti-seizure and tocolytic effects of phenytoin and magnesium sulphate in the treatment of eclampsia and preeclampsia: a randomised clinical trial. Iranian journal of neurology. 2017;16(3):125.
- Duley L, Matar HE, Almerie MQ, Hall DR. Alternative magnesium sulphate regimens for women with pre-eclampsia and eclampsia. The Cochrane database of systematic reviews. 2010(8):Cd007388.
- Lu JF, Nightingale CH. Magnesium sulfate in eclampsia and pre-eclampsia: pharmacokinetic principles. Clinical pharmacokinetics. 2000;38(4):305-14.
- Magee LA, Abalos E, von Dadelszen P, Sibai B, Easterling T, Walkinshaw S, et al. How to manage hypertension in pregnancy effectively. Br J Clin Pharmacol. 2011;72(3):394-401.
- Magee LA, Abalos E, von Dadelszen P, Sibai B, Walkinshaw SA. Control of hypertension in pregnancy. Curr Hypertens Rep. 2009;11(6):429-36.
- Vandemecum. Perú: Vandemecum; 2016 [citado 20 set 2021] Labetalol [Available from: https://www.vademecum.es/principios-activos-labetalol-c07ag01-us.
- Vandemecum. Perú: Vandemecum; 2016 [citado 20 set 2021] Hidralazina [Available from: https://www.vademecum.es/principios-activos-hidralazina-c02db02.
- Vandemecum. Perú: Vandemecum; 2016 [citado 20 set 2021] Nifedipino [Available from: https://www.vademecum.es/principios-activos-nifedipino-c08ca05.
- Duley L, Meher S, Jones L. Drugs for treatment of very high blood pressure during pregnancy. Cochrane Database of Systematic Reviews. 2013(7).
- Shekhar S, Gupta N, Kirubakaran R, Pareek P. Oral nifedipine versus intravenous labetalol for severe hypertension during pregnancy: a systematic review and meta-analysis. BJOG : an international journal of obstetrics and gynaecology. 2016;123(1):40-7.
- Magee LA, Cham C, Waterman EJ, Ohlsson A, von Dadelszen P. Hydralazine for treatment of severe hypertension in pregnancy: meta-analysis. Bmj. 2003;327(7421):955-60.
- Duley L, Meher S, Jones L. Drugs for treatment of very high blood pressure during pregnancy. The Cochrane database of systematic reviews. 2013;2013(7):Cd001449.
- Firoz T, Magee LA, MacDonell K, Payne BA, Gordon R, Vidler M, et al. Oral antihypertensive therapy for severe hypertension in pregnancy and postpartum: a systematic review. BJOG : an international journal of obstetrics and gynaecology. 2014;121(10):1210-8; discussion 20.
- Alavifard S, Chase R, Janoudi G, Chaumont A, Lanes A, Walker M, et al. First-line antihypertensive treatment for severe hypertension in pregnancy: A systematic review and network meta-analysis. Pregnancy hypertension. 2019;18:179-87.
- Antza C, Dimou C, Doundoulakis I, Akrivos E, Stabouli S, Haidich AB, et al. The flipside of hydralazine in pregnancy: A systematic review and meta-analysis. Pregnancy hypertension. 2020;19:177-86.
- ACOG Committee Opinion No. 767: Emergent Therapy for Acute-Onset, Severe Hypertension During Pregnancy and the Postpartum Period. Obstet Gynecol. 2019;133(2):e174-e80.
- Guida JPdS, Surita FG, Parpinelli MA, Costa ML. Preterm preeclampsia and timing of delivery: a systematic literature review. Revista Brasileira de Ginecologia e Obstetrícia. 2017;39:622-31.
- World Health Organization. WHO recommendations Policy of interventionist versus expectant management of severe pre-eclampsia before term. Ginebra: WHO; 2018.
- Excellence NIfHaC. Hypertension in pregnancy: diagnosis and management. London: NICE; 2019.
- Duvekot JJ, Duijnhoven RG, van Horen E, Bax CJ, Bloemenkamp KW, Brussé IA, et al. Temporizing management vs immediate delivery in early-onset severe preeclampsia between 28 and 34 weeks of gestation (TOTEM study): An open-label randomized controlled trial. Acta obstetricia et gynecologica Scandinavica. 2021;100(1):109-18.
- Guevara Ríos E, Meza Santibáñez L. Manejo de la preeclampsia/eclampsia en el Perú. Revista Peruana de Ginecología y Obstetricia. 2014;60(4):385-94.
- Instituto de Evaluación de Tecnologías en Salud e Investigación. Guía de Práctica Clínica para la Prevención y Manejo del Parto Pretérmino. Lima: EsSalud; 2018.
- Broekhuijsen K, van Baaren G-J, Van Pampus MG, Ganzevoort W, Sikkema JM, Woiski MD, et al. Immediate delivery versus expectant monitoring for hypertensive disorders of pregnancy between 34 and 37 weeks of gestation (HYPITAT-II): an open-label, randomised controlled trial. The Lancet. 2015;385(9986):2492-501.
- Koopmans CM, Bijlenga D, Groen H, Vijgen SM, Aarnoudse JG, Bekedam DJ, et al. Induction of labour versus expectant monitoring for gestational hypertension or mild pre-eclampsia after 36 weeks’ gestation (HYPITAT): a multicentre, open-label randomised controlled trial. The Lancet. 2009;374(9694):979-88.
- Prejbisz A, Dobrowolski P, Kosiński P, Bomba-Opoń D, Adamczak M, Bekiesińska-Figatowska M, et al. Management of hypertension in pregnancy—prevention, diagnosis, treatment and long-term prognosis. Varia Medica. 2019;3(6):385-448.
- Amorim MM, Souza ASR, Katz L. Planned caesarean section versus planned vaginal birth for severe pre-eclampsia. The Cochrane database of systematic reviews. 2017;10(10):Cd009430.
- Norwitz E. Eclampsia: UptoDate; 2020 [cited 2021 16/07]. Available from: https://bibvirtual.upch.edu.pe:2050/contents/search.
- Duley L, Henderson‐Smart DJ, Chou D. Magnesium sulphate versus phenytoin for eclampsia. Cochrane Database of Systematic Reviews. 2010(10).
- Duley L, Henderson‐Smart DJ, Walker GJ, Chou D. Magnesium sulphate versus diazepam for eclampsia. Cochrane Database of Systematic Reviews. 2010(12).
- Norwitz E. Preeclampsia: Management and prognosis: UpToDate; 2021 [Available from: https://bibvirtual.upch.edu.pe:2050/contents/preeclampsia-management-and-prognosis?search=magnesium%20sulphate&source=search_result&selectedTitle=3~148&usage_type=default&display_rank=2#H17.
- van Geijn HP, Jongsma HW, Doesburg WH, Lemmens WA, de Haan J, Eskes TK. The effect of diazepam administration during pregnancy or labor on the heart rate variability of the newborn infant. European journal of obstetrics, gynecology, and reproductive biology. 1980;10(3):187-201.
- Woudstra DM, Chandra S, Hofmeyr GJ, Dowswell T. Corticosteroids for HELLP (hemolysis, elevated liver enzymes, low platelets) syndrome in pregnancy. Cochrane Database Syst Rev. 2010(9):Cd008148.
- Yang L, Ren C, Mao M, Cui S. Prognostic Factors of the Efficacy of High-dose Corticosteroid Therapy in Hemolysis, Elevated Liver Enzymes, and Low Platelet Count Syndrome During Pregnancy: A Meta-analysis. Medicine (Baltimore). 2016;95(13):e3203.
- Mao M, Chen C. Corticosteroid Therapy for Management of Hemolysis, Elevated Liver Enzymes, and Low Platelet Count (HELLP) Syndrome: A Meta-Analysis. Med Sci Monit. 2015;21:3777-83.
- Zapata Díaz BM, Orestes Ramírez Cabrera J. Diagnóstico y manejo oportunos del síndrome HELLP. Revista Peruana de Ginecología y Obstetricia. 2020;66:57-65.
- Burgess A, Gartrell K, Anderson T. Remote Monitoring of Blood Pressure After Preeclampsia. Journal of Obstetric, Gynecologic & Neonatal Nursing. 2020;49(6):S17-S8.
- Muijsers HEC, van der Heijden OWH, de Boer K, van Bijsterveldt C, Buijs C, Pagels J, et al. Blood pressure after PREeclampsia/HELLP by SELF monitoring (BP-PRESELF): rationale and design of a multicenter randomized controlled trial. BMC Women’s Health. 2020;20(1):41.
- National Institute for Health and Care Excellence. Hypertension in pregnancy: diagnosis and management. UK: NICE; 2019.
- Berks D, Steegers EAP, Molas M, Visser W. Resolution of hypertension and proteinuria after preeclampsia. Obstet Gynecol. 2009;114(6):1307-14.
- Furuta M, Sandall J, Bick D. Women’s perceptions and experiences of severe maternal morbidity–a synthesis of qualitative studies using a meta-ethnographic approach. Midwifery. 2014;30(2):158-69.
- Conti-Ramsden FI, Nathan HL, greeff AD, Hall DR, Seed PT, Chappell LC, et al. Pregnancy-Related Acute Kidney Injury in Preeclampsia. Hypertension. 2019;74(5):1144-51.
- Riaz H, Khan MS, Siddiqi TJ, Usman MS, Shah N, Goyal A, et al. Association Between Obesity and Cardiovascular Outcomes: A Systematic Review and Meta-analysis of Mendelian Randomization Studies. JAMA Network Open. 2018;1(7):e183788-e.
- Podymow T, August P. Postpartum course of gestational hypertension and preeclampsia. Hypertension in pregnancy. 2010;29(3):294-300.
- Kaze FF, Njukeng FA, Kengne A-P, Ashuntantang G, Mbu R, Halle MP, et al. Post-partum trend in blood pressure levels, renal function and proteinuria in women with severe preeclampsia and eclampsia in Sub-Saharan Africa: A 6-months cohort study. BMC Pregnancy and Childbirth. 2014;14(1):134.
- Unverdi S, Ceri M, Unverdi H, Yilmaz R, Akcay A, Duranay M. Postpartum persistent proteinuria after preeclampsia: a single-center experience. Wien Klin Wochenschr. 2013;125(3-4):91-5.
- Benschop L, Duvekot JJ, Versmissen J, Broekhoven Vv, Steegers EAP, Lennep JERv. Blood Pressure Profile 1 Year After Severe Preeclampsia. Hypertension. 2018;71(3):491-8.
- EsSalud. Documento Técnico Orientador: Atención Preconcepcional en el Seguro Social de Salud. In: Gerencia Central de Prestaciones de Salud, editor. Perú: EsSalud; 2020.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


