
GUÍA PRÁCTICA CLÍNICA:
PARA EL TAMIZAJE, DIAGNÓSTICO Y MANEJO DE LA ENFERMEDAD
RENAL CRÓNICA EN LOS ESTADIOS 1 AL 3 (2020)
DESCARGAR
VERSIÓN
ARTÍCULO
DESCARGAR
VERSIÓN
EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN
CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: personas mayores de 18 años con factores de riesgo para el desarrollo de ERC. o Personas mayores de 18 años con diagnóstico reciente de ERC en los estadios 1 al 3. No se incluyen pacientes con ERC en los estadios 4 al 5, pacientes con malformaciones renales, ni aborda el manejo de las complicaciones de ERC.
- Alcance: tamizaje, diagnóstico y tratamiento de ERC en los estadios 1 al 3.
Autores
Expertos clínicos:
- Bravo Zúñiga, Jessica Ivonne
- Hinostroza Sayas, Juana
- Pereda Vejarano, Carlos Yanar
- Medina Sal y Rosas, Carola
- Valdivia Vega, Renzo Pavel
- Gonzáles Haro, Fernando Mesías
- Livaque Gaona, Luzmila
- Cornetero Muro, Victor Manuel
- Ayllón Guerrero, Gabriela
- Huancco Cáceres, Nelly Patricia
- Loza Munarriz, César Antonio
- Hancco Saavedra, Jorge Arturo
Metodólogos:
- Goicochea Lugo Sergio André
- Dolores Maldonado, Gandy
- Carrera Acosta, Lourdes
- Failoc Rojas Virgilio
Coordinadores:
- Timaná Ruiz, Raúl Alonso
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
Flujograma 1. Tamizaje, diagnóstico y estadiaje de pacientes con ERC

Flujograma 2. Manejo no farmacológico y farmacológico de pacientes con ERC
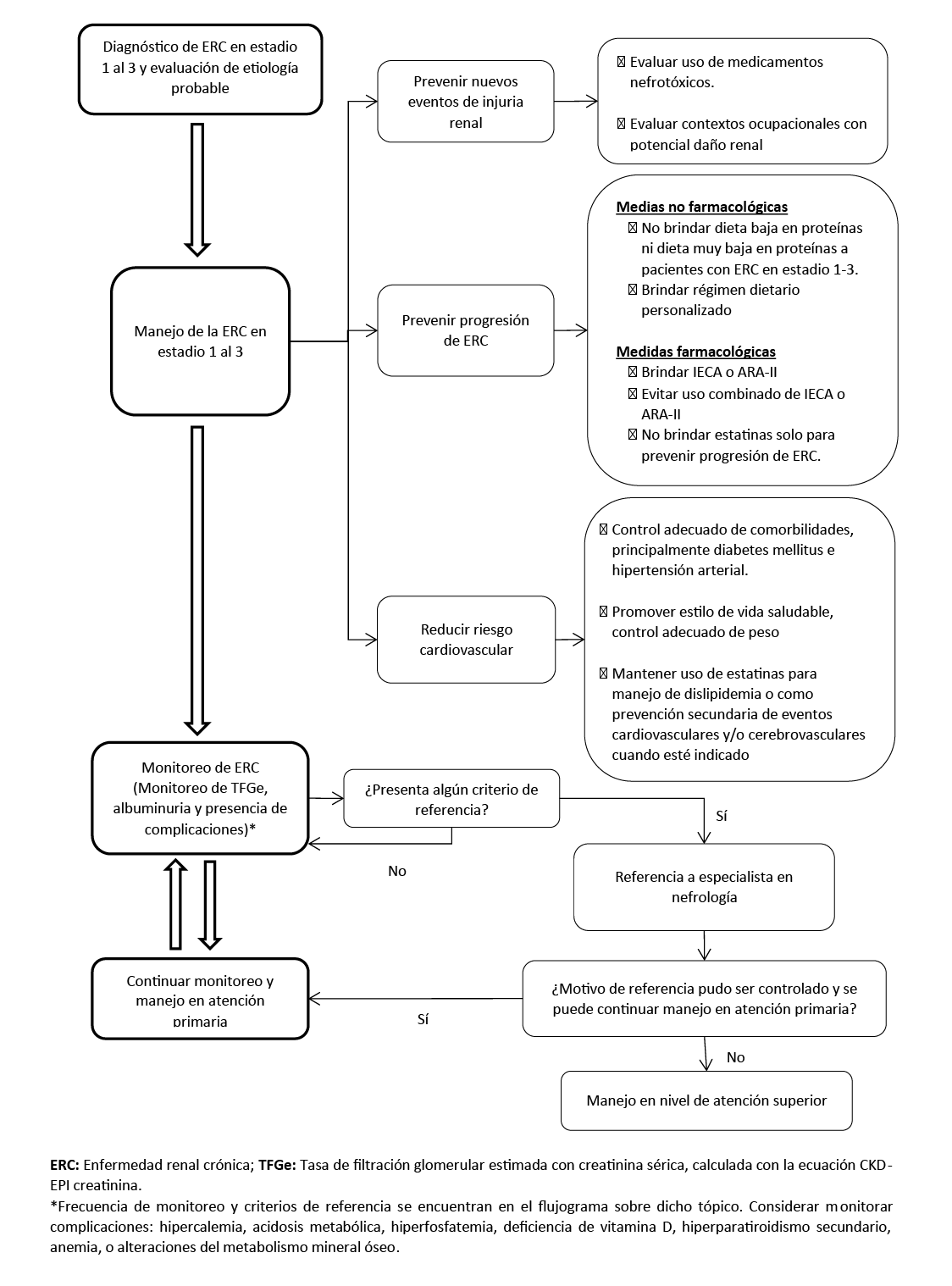
Flujograma 3. Monitoreo y referencia de pacientes con ERC
vacio
vacio
1. Tamizaje
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos, recomendamos realizar el tamizaje de enfermedad renal crónica dirigido a grupos de riesgo. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
En adultos, considerar como grupos de riesgo a: pacientes con diabetes mellitus tipo 1 o 2, hipertensión arterial, o mayores de 55 años.
BPC 2:
En adultos, considerar realizar el tamizaje a personas con otros factores de riesgo para ERC según criterio clínico. Entre los factores a considerar se encuentran:
- Antecedente de injuria renal aguda (IRA)
- Enfermedades cardiovasculares
- Enfermedades que alteren la estructura renal o el tracto urinario
- Enfermedades multisistémicas con potencial daño renal
- Historia familiar de falla renal
- Presencia de hematuria
- Escenarios laborales con potencial daño renal (por ejemplo, exposición a pesticidas, deshidratación)
BPC 3:
En adultos, utilizar el cálculo de la tasa de filtración glomerular estimada (TFGe) junto con la determinación de albuminuria mediante la relación albúminuria-creatinuria (RAC) para realizar el tamizaje de ERC [Ver pregunta 2 y 3]. Se definirá tamizaje positivo cuando se obtenga una TFGe ˂ 60 ml/min/1.73 m2 y/o RAC ≥ 30 mg/g.
BPC 4:
En adultos a quienes se realice el tamizaje de ERC y se obtenga una TFGe ˂ 60 ml/min/1.73 m2 con o sin criterios clínicos de IRA, realizar una nueva medición de la TFGe dentro de las siguientes dos semanas para confirmar el diagnóstico. En caso se confirme el diagnóstico de IRA, referir al especialista en nefrología.
BPC 5:
En adultos con un primer tamizaje positivo para ERC en quienes se haya descartado IRA, repetir el tamizaje luego de tres meses para confirmar el diagnóstico de ERC. El diagnóstico de ERC se confirmará cuando el paciente presente alguna de las siguientes condiciones:
- TFGe ≥ 60 ml/min/1.73 m2 y albuminuria (RAC ≥ 30 mg/g) ó
- TFGe ˂ 60 ml/min/1.73 m2
BPC 6:
En adultos con un primer tamizaje negativo para ERC, considerar repetir el tamizaje tomando en cuenta el valor de TFGe obtenido, los factores de riesgo del paciente y criterio del médico tratante. En caso se concluya que el tamizaje es negativo, repetir el tamizaje anualmente.
BPC 7:
En adultos con diagnóstico de ERC, realizar la clasificación del estadio de la enfermedad según los criterios del grupo de trabajo de enfermedad renal crónica publicados en 2012 (Kidney Disease: Improving Global Outcomes, KDIGO – 2012).
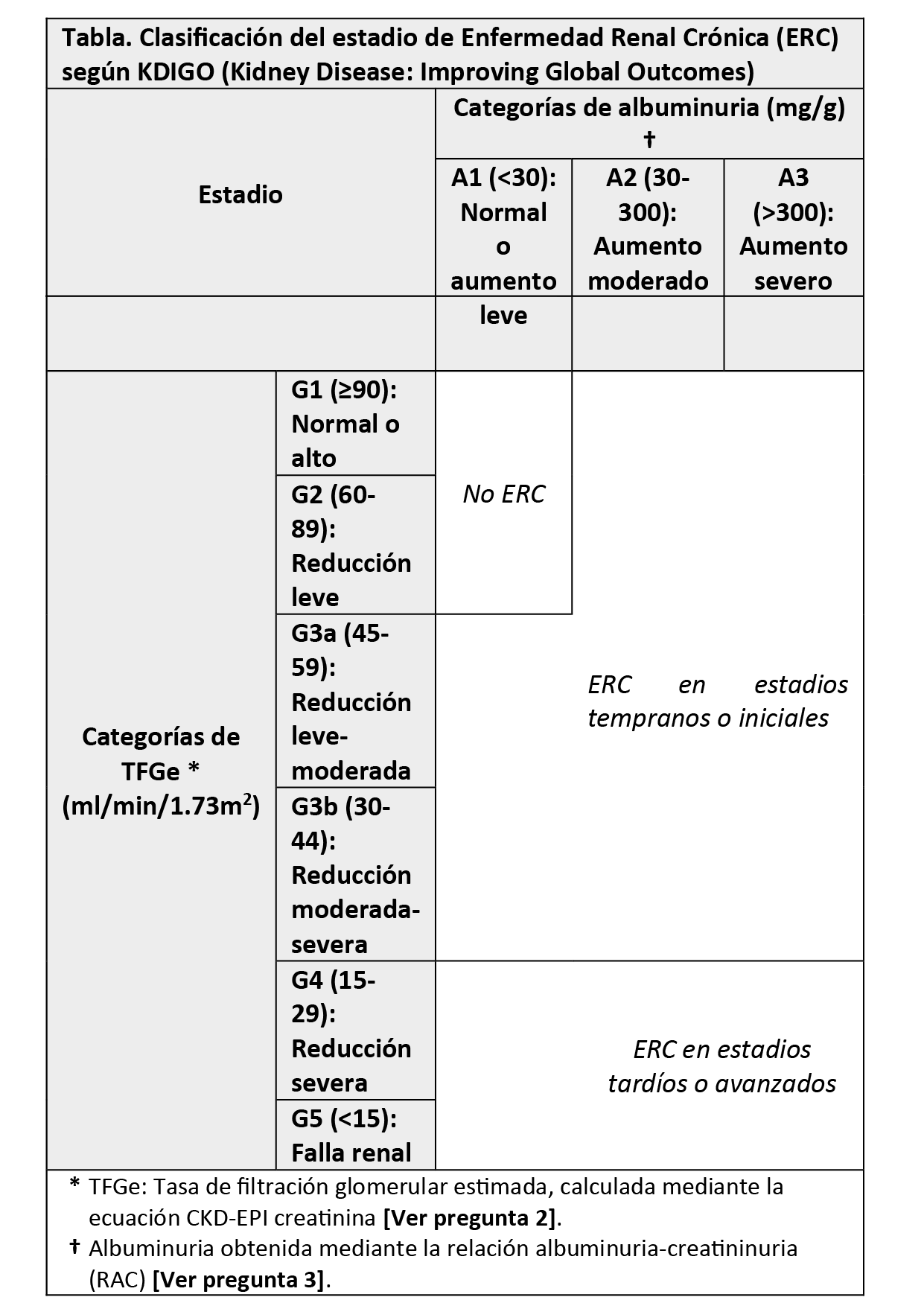
BPC 8:
En adultos con diagnóstico de ERC, establecer la etiología probable de la ERC con el fin de formular un plan de manejo integral.
2. Ecuaciones para la estimación de la Tasa de Filtración Glomerular (TFG)
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos, sugerimos utilizar la ecuación CKD-EPI creatinina para el cálculo de la tasa de filtración glomerular estimada (TFGe). (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En adultos en quienes se realice el cálculo de la TFGe, utilizar métodos enzimáticos para la determinación de creatinina que sean equiparables a la dilución isotópica y espectrometría de masas (Isotope Dilution Mass Spectrometry, IDMS).
BPC 2:
Cuando se solicite la evaluación de la función renal como examen auxiliar, el laboratorio debe reportar el valor de la TFGe en mililitros por minuto por 1.73 metros cuadrados (ml/min/1.73 m2) y el valor de la creatinina sérica en las unidades miligramos por decilitro (mg/dl).
3. Detección de albuminuria
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos, recomendamos utilizar la relación albuminuria-creatinuria (RAC) para la determinación de albuminuria. (Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
En adultos, considerar no utilizar el tipo de tira reactiva para examen rutinario de orina con el que cuenta el seguro social con el objetivo de determinar albuminuria. En lugar de ello, considerar su uso para descartar infección urinaria previo a la determinación de RAC en caso exista sospecha de infección.
BPC 2:
Cuando no se encuentre disponible la RAC en el centro de salud al que acuda inicialmente al paciente o en un laboratorio de referencia del seguro social, considerar el uso de la relación proteinuria-creatinuria (RPC) teniendo precaución en la interpretación de los resultados.
BPC 3:
En adultos en quienes se requiera una mayor precisión para determinar los niveles de albuminuria, considere medir la excreción urinaria de albúmina en una muestra de orina recolectada durante 24 horas como complemento de la RAC o RPC.
BPC 4:
En adultos en quienes se realice la detección de albuminuria con RAC o RPC, obtener estos valores a partir de una muestra que contenga la primera orina de la mañana o de una muestra de orina al azar, habiendo descartado el primer chorro de micción en ambos casos.
BPC 5:
Cuando se solicite la medición de albuminuria como examen auxiliar, el laboratorio debe reportar el valor de la RAC en miligramos de albumina por gramo de creatinina (mg/g).
4. Nutrición para pacientes con enfermedad renal crónica (ERC)
Descargar PDF con el desarrollo de la pregunta.
Pacientes con ERC sin diabetes mellitus
Recomendación 1:
En adultos con ERC en estadio 1 al 3 sin diabetes mellitus, sugerimos no ofrecer dieta baja en proteínas (DBP) para evitar la progresión de la ERC. (Recomendación en contra condicional, certeza muy baja de la evidencia)
Recomendación 2:
En adultos con ERC en estadio 1 al 3 sin diabetes mellitus, recomendamos no ofrecer dieta muy baja en proteínas (DMBP) para evitar la progresión de la ERC (Recomendación en contra fuerte, certeza muy baja de la evidencia)
BPC 1:
Respecto al uso de dietas con restricción en la cantidad de proteínas, considerar definir como DBP cuando se brinde ≤ 0.6 a 0.8 g/kg/día, y DMBP cuando se brinde < 0.4 g/kg/día.
BPC 2:
En adultos con ERC en estadio 1 al 3, considerar la interconsulta a profesionales de nutrición para realizar la valoración nutricional inicial, establecer un régimen dietario personalizado en el cual se consideren factores socioculturales, preferencias de alimentación del paciente y establecer la frecuencia de monitoreo del estado nutricional.
BPC 3:
En adultos con ERC en estadio 1 al 3, considerar establecer el consumo adecuado de calorías, proteínas, y sal de manera individualizada como parte de la formulación del régimen dietario, evitando ofrecer más de la cantidad de proteínas recomendada como normal y una dieta alta en sal.
BPC 4:
En adultos con ERC en estadio 1 al 3, aconsejar seguir un estilo de vida saludable que incluya el mantenimiento de peso adecuado, realización de ejercicio físico, evitar hábitos nocivos, y seguir un régimen dietario adecuado como parte integral del manejo de enfermedades crónicas.
Pacientes con ERC sin diabetes mellitus
Recomendación 1:
En adultos con ERC en estadio 1 al 3 y diabetes mellitus tipo 1 o 2, sugerimos no brindar dieta baja en proteínas (DBP) para evitar la progresión de la ERC. (Recomendación en contra condicional, certeza muy baja de la evidencia)
5. IECA o ARA II en ERC
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con ERC en estadio 1 al 3 con hipertensión arterial y/o diabetes mellitus que cursen con albuminuria, recomendamos brindar IECA o ARA-II para evitar la progresión de la ERC. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BCP 1:
En adultos con ERC en estadio 1 al 3 e hipertensión arterial, considerar incluir el uso de IECA o ARA-II como primera opción de esquema terapéutico antihipertensivo dados los beneficios adicionales en la prevención de progresión de la ERC.
BCP 2:
En adultos con ERC en estadio 1 al 3 normotensos, considerar realizar un examen clínico integral con el fin de confirmar o descartar hipertensión arterial que no haya sido diagnosticada previamente. En caso se descarte hipertensión arterial, considerar brindar IECA o ARA-II cuando se detecte albuminuria (A2 – A3).
BPC 3:
En adultos con ERC en estadio 1 al 3, considerar las preferencias del paciente, contraindicaciones al uso de IECA y/o presencia de tos luego del uso de IECA, para decidir iniciar o realizar el cambio de la terapia por ARA-II.
BPC 4:
En adultos con ERC en estadio 1 al 3, evitar el uso combinado de IECA y ARA-II para prevenir la progresión de ERC dado que su uso incrementa del riesgo de eventos adversos (tos, hipercalemia, hipotensión, IRA que requiere diálisis) sin ofrecer mayores beneficios en comparación con la monoterapia.
6. Estatinas en ERC
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con ERC en estadio 1 al 3 y dislipidemia, sugerimos no brindar estatinas solo para prevenir la progresión de la ERC. (Recomendación condicional en contra, certeza baja de la evidencia)
BPC 1:
En adultos con ERC en estadio 1 al 3 y dislipidemia, mantener el tratamiento con estatinas como parte del manejo de la dislipidemia cuando haya sido indicado.
BPC 2:
En adultos con ERC en estadio 1 al 3 y dislipidemia en quienes se haya presentado eventos cardiovasculares y/o cerebrovasculares, mantener el tratamiento preventivo de estos eventos con estatinas cuando haya sido indicado.
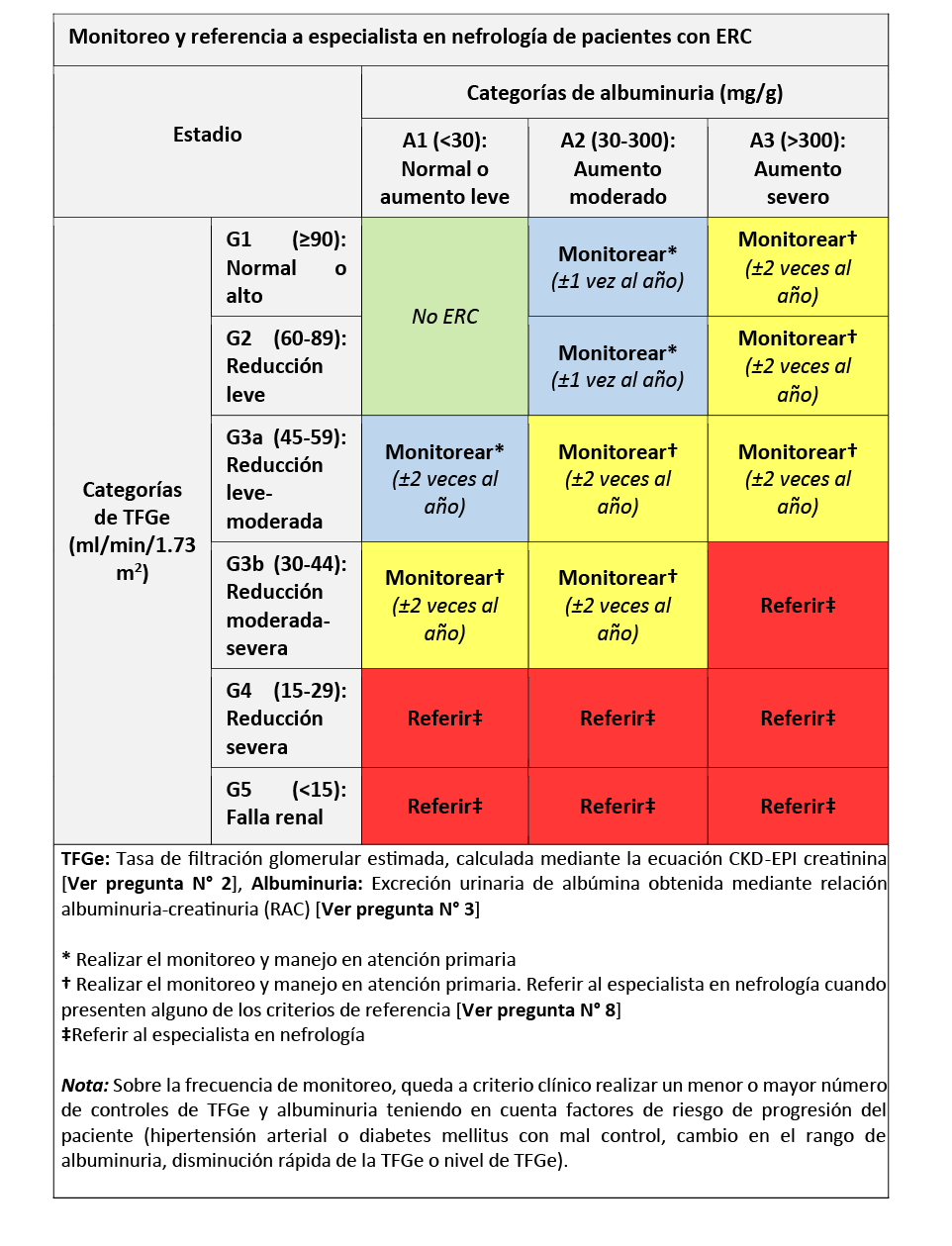
7. Monitoreo de TFG y albuminuria
Descargar PDF con el desarrollo de la pregunta.
BCP 1:
En adultos con ERC en estadios 1 al 2, considerar monitorear el cambio en la TFGe y albuminuria una vez al año.
BCP 2:
En adultos con ERC en estadio 3 o con albuminuria ≥ 300 mg/g (RAC o equivalente), considerar monitorear el cambio en la TFGe y albuminuria dos veces al año
BCP 3:
En adultos con ERC en estadio 1 al 3, queda a criterio clínico realizar un menor o mayor número de controles de TFGe y albuminuria teniendo en cuenta factores de riesgo de progresión del paciente (hipertensión arterial o diabetes mellitus con mal control, cambio en el rango de albuminuria, disminución rápida de la TFGe o nivel de TFGe).
BCP 4:
En adultos con ERC, monitorear la presencia de complicaciones de ERC tales como hipercalemia, acidosis metabólica, hiperfosfatemia, deficiencia de vitamina D, hiperparatiroidismo secundario, anemia, o alteraciones del metabolismo mineral óseo según el estadio de la enfermedad.
8. Criterios de referencia
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En adultos con ERC en estadio 1 al 3, considerar los siguientes criterios para referir a especialista en nefrología:
- Pacientes con TFGe < 30 mL/min/1.73 m2.
- Pacientes con TFGe ≥ 30 y ˂ 45 mL/min/1.73 m2 y albuminuria > 300 mg/g (RAC o equivalente).
- Pacientes con deterioro agudo de la función renal (descenso de la TFGe > 25% en un mes respecto a la TFGe basal o disminución mayor de 5 ml/min/1.73 m2 en un año).
- Pacientes con albuminuria > 300 mg/g (RAC o equivalente) y hematuria de etiología desconocida.
- Pacientes con ERC e injuria renal aguda.
- Pacientes hipertensos con inadecuado control de la presión arterial (presión arterial mayor de 130/80 mmHg) a pesar del uso de tres fármacos antihipertensivos a dosis plenas y al menos un diurético.
- Pacientes con ERC que presenten anemia normocítica normocrómica (hemoglobina < 10.5 g/dL) luego de haber corregido la ferropenia y habiendo descartado causas no renales de anemia.
- Pacientes con alteraciones persistentes en el potasio (>5.5 mEq/L o <3.5 mEq/L) en quienes no se haya brindado tratamiento con diuréticos.
- Manejo de enfermedades asociadas a ERC que requieran atención especializada (Estenosis de arteria renal, glomerulopatías, vasculitis, enfermedad renal hereditaria, alteraciones del metabolismo mineral óseo, entre otras).
Referencias bibliográficas
- Romagnani P, Remuzzi G, Glassock R, Levin A, Jager KJ, Tonelli M, et al. Chronic kidney disease. Nature reviews Disease primers. 2017;3:17088.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter. S. 2013;3:1-150.
- Saran R, Robinson B, Abbott KC, Agodoa LY, Albertus P, Ayanian J, et al. US renal data system 2016 annual data report: epidemiology of kidney disease in the United States. American journal of kidney diseases. 2017;69(3):A7-A8.
- Xie Y, Bowe B, Mokdad AH, Xian H, Yan Y, Li T, et al. Analysis of the Global Burden of Disease study highlights the global, regional, and national trends of chronic kidney disease epidemiology from 1990 to 2016. Kidney international. 2018;94(3):567-81.
- Francis ER, Kuo C-C, Bernabe-Ortiz A, Nessel L, Gilman RH, Checkley W, et al. Burden of chronic kidney disease in resource-limited settings from Peru: a population-based study. BMC nephrology. 2015;16(1):114.
- Herrera-Añazco P, Atamari-Anahui N, Flores-Benites V. Número de nefrólogos, servicios de hemodiálisis y tendencia de la prevalencia de enfermedad renal crónica en el Ministerio de Salud de Perú. Revista Peruana de Medicina Experimental y Salud Pública. 2019;36:62-7.
- Llanos RQ, Ramírez RR, Palacios MT, Flores CF, Borda-Olivas A, Castillo RA, et al. Encuesta de Salud en un sistema sanitario peruano (ENSSA): diseño, metodología y resultados generales. Revista de saúde pública. 2019;53:33.
- Carrillo-Larco RM, Bernabé-Ortiz A. Mortality from chronic kidney disease in Peru: national trends 2003-2015. 2018.
- Bravo-Zuniga J, Galvez-Inga J, Carrillo-Onofre P, Chavez-Gomez R, Castro-Monteverde P. Early detection of chronic renal disease: coordinated work between primary and specialized care in an ambulatory renal network of Peru. Jornal brasileiro de nefrologia : ‘orgao oficial de Sociedades Brasileira e Latino-Americana de Nefrologia. 2019;41(2):176-84.
- Chen TK, Knicely DH, Grams ME. Chronic Kidney Disease Diagnosis and Management: A Review. Jama. 2019;322(13):1294-304.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ (Clinical research ed). 2008;336(7650):924-6.
- Balshem H, Helfand M, Schünemann HJ, Oxman AD, Kunz R, Brozek J, et al. GRADE guidelines: 3. Rating the quality of evidence. Journal of clinical epidemiology. 2011;64(4):401-6.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Gheewala PA, Zaidi STR, Jose MD, Bereznicki L, Peterson GM, Castelino RL. Effectiveness of targeted screening for chronic kidney disease in the community setting: a systematic review. Journal of nephrology. 2018;31(1):27-36.
- Qaseem A, Hopkins RH, Sweet DE, Starkey M, Shekelle P. Screening, monitoring, and treatment of stage 1 to 3 chronic kidney disease: A clinical practice guideline from the American College of Physicians. Annals of internal medicine. 2013;159(12):835-47.
- Komenda P, Ferguson TW, Macdonald K, Rigatto C, Koolage C, Sood MM, et al. Cost-effectiveness of primary screening for CKD: a systematic review. American journal of kidney diseases : the official journal of the National Kidney Foundation. 2014;63(5):789-97.
- Weckmann GFC, Stracke S, Haase A, Spallek J, Ludwig F, Angelow A, et al. Diagnosis and management of non-dialysis chronic kidney disease in ambulatory care: a systematic review of clinical practice guidelines. BMC nephrology. 2018;19(1):258.
- Lunyera J, Mohottige D, Von Isenburg M, Jeuland M, Patel UD, Stanifer JW. CKD of Uncertain Etiology: A Systematic Review. Clinical journal of the American Society of Nephrology : CJASN. 2016;11(3):379-85.
- Valcke M, Levasseur M-E, da Silva AS, Wesseling C. Pesticide exposures and chronic kidney disease of unknown etiology: an epidemiologic review. Environmental Health. 2017;16(1):49.
- Department of Veterans Affairs (VA) and The Department of Defense (DoD). VA/DoD Clinical Practice Guideline for the management of Chronic Kidney Disease in Primary Care. 2014.
- National Institute for Health and Clinical Excellence (Great Britain). Chronic kidney disease: Early identification and management of chronic kidney disease in adults in primary and secondary care. London: NICE. 2015.
- Eriksen B, Ingebretsen O. The progression of chronic kidney disease: a 10-year population-based study of the effects of gender and age. Kidney international. 2006;69(2):375-82.
- Perrone RD, Madias NE, Levey AS. Serum creatinine as an index of renal function: new insights into old concepts. Clinical chemistry. 1992;38(10):1933-53.
- Ferguson TW, Komenda P, Tangri N. Cystatin C as a biomarker for estimating glomerular filtration rate. Current opinion in nephrology and hypertension. 2015;24(3):295-300.
- Levey A. A simplified equation to predict glomerular filtration rate from serum creatinine. J Am Soc Nephrol. 2000;11:A0828.
- Levey AS, Coresh J, Greene T, Marsh J, Stevens LA, Kusek JW, et al. Expressing the Modification of Diet in Renal Disease Study equation for estimating glomerular filtration rate with standardized serum creatinine values. Clinical chemistry. 2007;53(4):766-72.
- Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF, Feldman HI, et al. A new equation to estimate glomerular filtration rate. Annals of internal medicine. 2009;150(9):604-12.
- Veronese FV, Gomes EC, Chanan J, Carraro MA, Camargo EG, Soares AA, et al. Performance of CKD-EPI equation to estimate glomerular filtration rate as compared to MDRD equation in South Brazilian individuals in each stage of renal function. Clinical chemistry and laboratory medicine. 2014;52(12):1747-54.
- Lopes MB, Araújo LQ, Passos MT, Nishida SK, Kirsztajn GM, Cendoroglo MS, et al. Estimation of glomerular filtration rate from serum creatinine and cystatin C in octogenarians and nonagenarians. BMC nephrology. 2013;14(1):265.
- Camargo E, Soares A, Detanico A, Weinert L, Veronese F, Gomes E, et al. The Chronic Kidney Disease Epidemiology Collaboration (CKD‐EPI) equation is less accurate in patients with Type 2 diabetes when compared with healthy individuals. Diabetic medicine. 2011;28(1):90-5.
- David‐Neto E, Triboni AHK, Ramos F, Agena F, Galante NZ, Altona M, et al. Evaluation of MDRD 4, CKD‐EPI, BIS‐1, and modified Cockcroft–Gault equations to estimate glomerular filtration rate in the elderly renal‐transplanted recipients. Clinical transplantation. 2016;30(12):1558-63.
- Silveiro SP, Araújo GN, Ferreira MN, Souza FD, Yamaguchi HM, Camargo EG. Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) equation pronouncedly underestimates glomerular filtration rate in type 2 diabetes. Diabetes care. 2011;34(11):2353-5.
- Arreola-Guerra JM, Rincón-Pedrero R, Cruz-Rivera C, Belmont-Pérez T, Correa-Rotter R, Niño-Cruz JA. Performance of MDRD-IDMS and CKD-EPI equations in Mexican individuals with normal renal function. Nefrología (English Edition). 2014;34(5):591-8.
- Liu WS, Chung YT, Yang CY, Lin CC, Tsai KH, Yang WC, et al. Serum creatinine determined by Jaffe, enzymatic method, and isotope dilution‐liquid chromatography‐mass spectrometry in patients under hemodialysis. Journal of clinical laboratory analysis. 2012;26(3):206-14.
- Cheuiche AV, Soares AA, Camargo EG, Weinert LS, Camargo JL, Silveiro SP. Comparison between IDMS-traceable Jaffe and enzymatic creatinine assays for estimation of glomerular filtration rate by the CKD-EPI equation in healthy and diabetic subjects. Clinical biochemistry. 2013;46(15):1423-9.
- Küme T, Sağlam B, Ergon C, Sisman AR. Evaluation and comparison of Abbott Jaffe and enzymatic creatinine methods: Could the old method meet the new requirements? Journal of clinical laboratory analysis. 2018;32(1):e22168.
- Piéroni L, Bargnoux A-S, Cristol J-P, Cavalier E, Delanaye P. Did creatinine standardization give benefits to the evaluation of glomerular filtration rate? Ejifcc. 2017;28(4):251.
- Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI. Petitorio Nacional de Patología Clínica y Anatomía Patológica. EsSalud. Peru [Available from: http://www.essalud.gob.pe/ietsi/PETITORIO_DE_PATOLOGIA_CLINICA_Y_ANATOMIA_PATOLOGICA/.
- Coresh J, Heerspink HJL, Sang Y, Matsushita K, Arnlov J, Astor BC, et al. Change in albuminuria and subsequent risk of end-stage kidney disease: an individual participant-level consortium meta-analysis of observational studies. The lancet Diabetes & endocrinology. 2019;7(2):115-27.
- Wu H-Y, Huang J-W, Peng Y-S, Hung K-Y, Wu K-D, Lai M-S, et al. Microalbuminuria screening for detecting chronic kidney disease in the general population: a systematic review. Renal failure. 2013;35(5):607-14.
- Wu H-Y, Peng Y-S, Chiang C-K, Huang J-W, Hung K-Y, Wu K-D, et al. Diagnostic performance of random urine samples using albumin concentration vs ratio of albumin to creatinine for microalbuminuria screening in patients with diabetes mellitus: a systematic review and meta-analysis. JAMA internal medicine. 2014;174(7):1108-15.
- Price CP, Newall RG, Boyd JC. Use of protein: creatinine ratio measurements on random urine samples for prediction of significant proteinuria: a systematic review. Clinical chemistry. 2005;51(9):1577-86.
- Medina‐Rosas J, Yap KS, Anderson M, Su J, Touma Z. Utility of Urinary Protein‐Creatinine Ratio and Protein Content in a 24‐Hour Urine Collection in Systemic Lupus Erythematosus: A Systematic Review and Meta‐Analysis. Arthritis care & research. 2016;68(9):1310-9.
- McTaggart MP, Price CP, Pinnock RG, Stevens PE, Newall RG, Lamb EJ. The diagnostic accuracy of a urine albumin-creatinine ratio point-of-care test for detection of albuminuria in primary care. American journal of kidney diseases. 2012;60(5):787-94.
- Pathania M, Rathaur VK, Yadav N, Jayara A, Chaturvedi A. Quantitative Micro-albuminuria Assessment from ‘Random Voided Urinary Albumin: Creatinine Ratio’Versus ‘24 hours Urinary Albumin Concentration’for Screening of Diabetic Nephropathy. Journal of clinical and diagnostic research: JCDR. 2013;7(12):2828.
- Hasanato RM. Diagnostic efficacy of random albumin creatinine ratio for detection of micro and macro-albuminuria in type 2 diabetes mellitus. Saudi medical journal. 2016;37(3):268.
- Carter JL, Tomson CR, Stevens PE, Lamb EJ. Does urinary tract infection cause proteinuria or microalbuminuria? A systematic review. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association. 2006;21(11):3031-7.
- Kitada M, Ogura Y, Monno I, Koya D. A Low-Protein Diet for Diabetic Kidney Disease: Its Effect and Molecular Mechanism, an Approach from Animal Studies. Nutrients. 2018;10(5).
- Hahn D, Hodson EM, Fouque D. Low protein diets for non-diabetic adults with chronic kidney disease. Cochrane Database Syst Rev. 2018;10:CD001892.
- Fouque D, Mitch WE. Low-protein diets in chronic kidney disease: are we finally reaching a consensus? Nephrology Dialysis Transplantation. 2015;30(1):6-8.
- Shah BV, Patel ZM. Role of low protein diet in management of different stages of chronic kidney disease – practical aspects. BMC nephrology. 2016;17(1):156.
- Yan B, Su X, Xu B, Qiao X, Wang L. Effect of diet protein restriction on progression of chronic kidney disease: A systematic review and meta-analysis. PLoS One. 2018;13(11):e0206134.
- Rhee CM, Ahmadi SF, Kovesdy CP, Kalantar-Zadeh K. Low-protein diet for conservative management of chronic kidney disease: a systematic review and meta-analysis of controlled trials. J Cachexia Sarcopenia Muscle. 2018;9(2):235-45.
- Cheryl A HA. Nutrition education in the care of patients with chronic kidney disease and end-stage renal disease. Seminars in Dialysis. 2018;1(7).
- Mafra D LV. A practical approach to a low protein diet in Brazil. BMC nephrology. 2016;17(105).
- Kovesdy C KJ, Kalantar K. Management of protein-energy wasting in non-dialysis-dependent chronic kidney disease: reconciling low protein intake with nutritional therapy. The American Journal of Clinical Nutrition. 2013;90(6):1163–77.
- Huang M-C, Chen M-E, Hung H-C, Chen H-C, Chang W-T, Lee C-H, et al. Inadequate energy and excess protein intakes may be associated with worsening renal function in chronic kidney disease. Journal of Renal Nutrition. 2008;18(2):187-94.
- Kamper AL, Strandgaard S. Long-Term Effects of High-Protein Diets on Renal Function. Annual review of nutrition. 2017;37:347-69.
- Organization WH, University UN. Protein and amino acid requirements in human nutrition: World Health Organization; 2007.
- Garofalo C, Borrelli S, Provenzano M, De Stefano T, Vita C, Chiodini P, et al. Dietary Salt Restriction in Chronic Kidney Disease: A Meta-Analysis of Randomized Clinical Trials. Nutrients. 2018;10(6).
- Grupo de trabajo de la Guía de Práctica Clínica sobre la Detección y el Manejo de la Enfermedad Renal Crónica. Guía de Práctica Clínica sobre la Detección y el Manejo de la Enfermedad Renal Crónica. Ministerio de Sanidad, Servicios Sociales e Igualdad. Instituto Aragonés de Ciencias de la Salud; 2016. Guías de Práctica Clínica en el SNS.
- Rughooputh MS, Zeng R, Yao Y. Protein Diet Restriction Slows Chronic Kidney Disease Progression in Non-Diabetic and in Type 1 Diabetic Patients, but Not in Type 2 Diabetic Patients: A Meta-Analysis of Randomized Controlled Trials Using Glomerular Filtration Rate as a Surrogate. PLoS One. 2015;10(12):e0145505.
- Zhu HG, Jiang ZS, Gong PY, Zhang DM, Zou ZW, Qian Z, et al. Efficacy of low-protein diet for diabetic nephropathy: a systematic review of randomized controlled trials. Lipids Health Dis. 2018;17(1):141.
- Kalaitzidis RG, Elisaf MS. Treatment of hypertension in chronic kidney disease. Current hypertension reports. 2018;20(8):64.
- Henry TY. Progression of chronic renal failure. Archives of internal medicine. 2003;163(12):1417-29.
- Sharma P, Blackburn RC, Parke CL, McCullough K, Marks A, Black C. Angiotensin‐converting enzyme inhibitors and angiotensin receptor blockers for adults with early (stage 1 to 3) non‐diabetic chronic kidney disease. Cochrane Database of Systematic Reviews. 2011(10).
- Fink HA, Ishani A, Taylor BC, Greer NL, MacDonald R, Rossini D, et al. Screening for, monitoring, and treatment of chronic kidney disease stages 1 to 3: a systematic review for the US Preventive Services Task Force and for an American College of Physicians Clinical Practice Guideline. Annals of internal medicine. 2012;156(8):570-81.
- Geng D-f, Sun W-f, Yang L, En G, Wang J-f. Antiproteinuric effect of angiotensin receptor blockers in normotensive patients with proteinuria: A meta-analysis of randomized controlled trials. Journal of the Renin-Angiotensin-Aldosterone System. 2014;15(1):44-51.
- Wang K, Hu J, Luo T, Wang Y, Yang S, Qing H, et al. Effects of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers on all-cause mortality and renal outcomes in patients with diabetes and albuminuria: a systematic review and meta-analysis. Kidney and Blood Pressure Research. 2018;43(3):768-79.
- Mishima E, Haruna Y, Arima H. Renin-angiotensin system inhibitors in hypertensive adults with non-diabetic CKD with or without proteinuria: a systematic review and meta-analysis of randomized trials. Hypertension Research. 2019;42(4):469-82.
- Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). European heart journal. 2020;41(1):111-88.
- Wong MG, Perkovic V. Knowing what we do not know: statin therapy in advanced chronic kidney disease. The lancet Diabetes & endocrinology. 2016;4(10):801-3.
- Douglas K, O’Malley PG, Jackson JL. Meta-analysis: the effect of statins on albuminuria. Annals of internal medicine. 2006;145(2):117-24.
- Sandhu S, Wiebe N, Fried LF, Tonelli M. Statins for improving renal outcomes: a meta-analysis. Journal of the American Society of Nephrology. 2006;17(7).
- Herrington W, Emberson J, Mihaylova B, Blackwell L, Reith C, Haynes R, et al. Impact of renal function on the effects of LDL cholesterol lowering with statin-based regimens: a meta-analysis of individual participant data from 28 randomised trials. Lancet Diabetes and Endocrinology. 2016;4(10).
- Su X, Zhang L, Lv J, Wang J, Hou W, Xie X, et al. Effect of statins on kidney disease outcomes: a systematic review and meta-analysis. American Journal of Kidney Diseases. 2016;67(6):881-92.
- Zhang Z, Wu P, Zhang J, Wang S, Zhang G. The effect of statins on microalbuminuria, proteinuria, progression of kidney function, and all-cause mortality in patients with non-end stage chronic kidney disease: A meta-analysis. Pharmacological research. 2016;105:74-83.
- Qin X, Dong H, Fang K, Lu F. The effect of statins on renal outcomes in patients with diabetic kidney disease: A systematic review and meta-analysis. Diabetes/metabolism research and reviews. 2017;33(6).
- He Y, Li X, Gasevic D, Brunt E, McLachlan F, Millenson M, et al. Statins and Multiple Noncardiovascular Outcomes: Umbrella Review of Meta-analyses of Observational Studies and Randomized Controlled Trials. Ann Intern Med. 2018;169(8):543-53.
- National CGCU. Lipid modification: cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease. 2014.
- Webster AC, Nagler EV, Morton RL, Masson P. Chronic Kidney Disease. Lancet (London, England). 2017;389(10075):1238-52.
- Caravaca-Fontan F, Azevedo L, Luna E, Caravaca F. Patterns of progression of chronic kidney disease at later stages. Clin Kidney J. 2018;11(2):246-53.
- Abeysekera RA, Healy HG, Wang Z, Cameron AL, Hoy WE. Heterogeneity in patterns of progression of chronic kidney disease. Internal medicine journal. 2020.
- Naimark DM, Grams ME, Matsushita K, Black C, Drion I, Fox CS, et al. Past Decline Versus Current eGFR and Subsequent Mortality Risk. J Am Soc Nephrol. 2016;27(8):2456-66.
- Kovesdy CP, Coresh J, Ballew SH, Woodward M, Levin A, Naimark DM, et al. Past Decline Versus Current eGFR and Subsequent ESRD Risk. J Am Soc Nephrol. 2016;27(8):2447-55.
- Badve SV, Palmer SC, Hawley CM, Pascoe EM, Strippoli GF, Johnson DW. Glomerular filtration rate decline as a surrogate end point in kidney disease progression trials. Nephrology Dialysis Transplantation. 2016;31(9):1425-36.
- Heerspink HJL, Greene T, Tighiouart H, Gansevoort RT, Coresh J, Simon AL, et al. Change in albuminuria as a surrogate endpoint for progression of kidney disease: a meta-analysis of treatment effects in randomised clinical trials. The lancet Diabetes & endocrinology. 2019;7(2):128-39.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. Cochrane Database Syst Rev. 2014(6):Cd007333.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com

