DESCARGAR
VERSIÓN
ARTÍCULO
DESCARGAR
VERSIÓN
EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN
CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: pacientes adultos con fibrilación auricular
- Alcance: manejo de pacientes con fibrilación auricular
Autores
Expertos clínicos:
- Richard Soto Becerra
- Carolina Guevara Caicedo
- Gladys Espinoza Rivas
- Mario Cabrera Saldaña
- Pío Zelaya Castro
- Ricardo Zegarra Carhuaz
Metodólogos:
- Jessica Zafra Tanaka
- Sergio Goicochea Lugo
- Kevin Pacheco Barrios
- Alvaro Taype Rondán
- Adrián V. Hernández
- Alejandro Piscoya Rivera
Coordinadores:
-
Raúl Alonso Timaná Ruiz
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
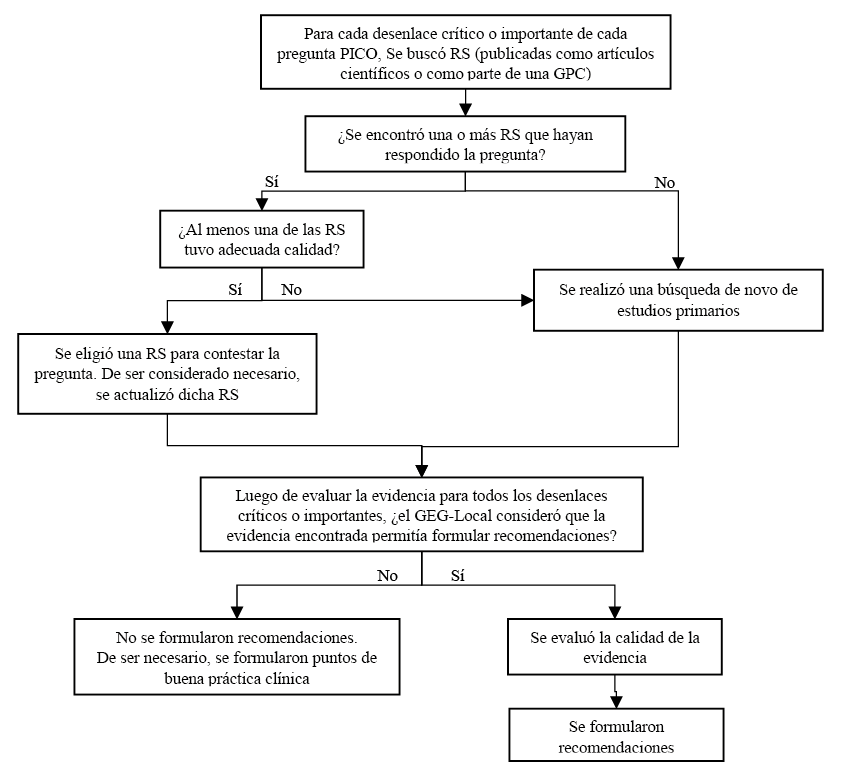
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
vacio
vacio
1. Índice de riesgo para predecir eventos tromboembólicos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con FA no valvular, recomendamos usar el índice de riesgo CHA2DS2-VASc para evaluar el riesgo de eventos tromboembólicos. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
Utilizar el índice de riesgo CHA2DS2-VASc en pacientes con FA no valvular, sin importar la presencia de síntomas y el tipo (paroxística, persistente o permanente).
2. Terapia antitrombótica
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con FA no valvular en quienes se decida iniciar anticoagulación, sugerimos emplear el anticoagulante oral disponible en la institución que mejor se adapte a las características clínicas del paciente. (Recomendación Débil a favor, certeza muy baja de la evidencia)
Recomendación 2:
En pacientes con FA no valvular, recomendamos no ofrecer monoterapia con antiagregantes plaquetarios sólo como medida de prevención de eventos tromboembólicos. (Recomendación fuerte en contra, certeza muy baja de la evidencia)
BPC 1:
En pacientes con FA no valvular y CHA2DS2-VASc de 0 para varones y 1 para mujeres, no ofrecer terapia para prevención de eventos tromboembólicos.
BPC 2:
En pacientes varones con FA no valvular y CHA2DS2-VASc de 1, considerar iniciar anticoagulación, tomando en cuenta el riesgo de sangrado.
BPC 3:
En pacientes con FA no valvular y CHA2DS2-VASc de 2 o más, iniciar anticoagulación tomando en cuenta el riesgo de sangrado.
BPC 4:
En pacientes con FA valvular (portadores de prótesis valvular mecánica o padecen de estenosis mitral moderada o severa), iniciar anticoagulación con warfarina sin considerar el puntaje del índice de riesgo CHA2DS2-VASc.
BPC 5:
En pacientes usuarios de warfarina, calcule el tiempo en rango terapéutico (TTR) en cada visita. Cuando calcule el TTR:
a. Use un método validado de medida como el método Rosendaal para la dosificación ayudada por computadora o las proporciones de pruebas en rango para las dosis manuales (INR).
b. Excluya las medidas tomadas durante las 6 primeras semanas de tratamiento.
c. Calcule el TTR en un periodo de mantenimiento de al menos 6 meses.
d. Debe realizarse el control del INR en períodos cercanos hasta alcanzar un nivel óptimo y estable, y luego debe ser mensualmente.
e. Cuando se inicia la anticoagulación debe crearse una tarjeta de control de INR única para el seguimiento.
BPC 6:
Reevalúe la anticoagulación con warfarina de un paciente con pobre control de anticoagulación representado por cualquiera de los siguientes:
a. 2 valores de INR mayores de 5, o 1 INR mayor de 8 en los últimos 6 meses
b. 2 valores de INR menores a 1.5 dentro de los últimos 6 meses
c. TTR menor a 65%
BPC 7:
Si el pobre control de anticoagulación con warfarina no se puede mejorar, evalúe los riesgos y beneficios de las estrategias alternativas disponibles en la institución (Incluyendo los anticoagulantes orales directos [ACOD] o la oclusión de la orejuela de la aurícula izquierda [OOAI]) para la prevención de eventos tromboembólicos y discútalas con el paciente.
BPC 8:
Para los pacientes que no están tomando anticoagulación, reevalúe el riesgo de eventos tromboembólicos cuando alcancen los 65 años de edad o si desarrollan cualquiera de los siguientes eventos a cualquier edad:
a. Diabetes mellitus
b. Hipertensión arterial
c. Insuficiencia cardiaca
d. Enfermedad arterial periférica
e. Enfermedad coronaria
f. DCV, TIA o tromboembolismo sistémico
BPC 9:
Para los pacientes que no toman anticoagulación debido al riesgo de sangrado u otros factores, revise los riesgos de eventos tromboembólicos y sangrado en cada visita de control, y asegúrese que todas las evaluaciones y decisiones estén documentadas.
BPC 10:
Para los pacientes que toman anticoagulación, revise al menos anualmente la necesidad y la calidad de anticoagulación, o más frecuentemente si ocurren eventos clínicamente relevantes que afecten la anticoagulación o el riesgo de sangrado.
3. Índice de riesgo para predecir sangrado
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con FA que están empezando o han empezado anticoagulación, sugerimos utilizar el índice HAS-BLED para evaluar el riesgo de sangrado. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BCP 1:
En pacientes con alto riesgo de sangrado, brinde anticoagulación y controle los factores que aumenten dicho riesgo.
BCP 2:
Al discutir los beneficios y riesgos de la anticoagulación, explique al paciente que:
a. Para la mayoría de los pacientes, el beneficio de la anticoagulación sobrepasa al riesgo de sangrado.
b. Para los pacientes con riesgo de sangrado incrementado, el beneficio de la anticoagulación puede no siempre sobrepasar al riesgo de sangrado, por lo que es importante un monitoreo cuidadoso del riesgo de sangrado.
BCP 3:
No evite la anticoagulación solo por el riesgo de caídas.
4. Oclusión de la orejuela de la aurícula izquierda
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Si existe alguna contraindicación absoluta para el uso de anticoagulantes a largo plazo, sugerimos considerar la OOAI. (Recomendación débil a favor, certeza muy baja de la evidencia)
BPC 1:
Cuando se considere realizar OOAI, discutir sus beneficios y riesgos con el paciente.
5. Estrategias de control de ritmo o estrategias de control de frecuencia
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Para la terapia de mantenimiento en pacientes con FA, sugerimos brindar control de la frecuencia como la estrategia de primera línea. (Recomendación débil a favor, certeza muy baja de la evidencia)
BPC 1:
En pacientes con FA, considere brindar estrategias de control de ritmo cuando cumpla con alguna de las siguientes características:
a. FA de reciente inicio (menor de 48 horas).
b. Presencia de síntomas (escala EHRA) a pesar de que la frecuencia cardiaca está controlada o en quienes la estrategia de control de frecuencia no ha sido exitosa.
c. Presenta insuficiencia cardíaca que se sospecha es causada principalmente por la FA.
d. Es decidido en función del juicio clínico, considerando: tiempo de aparición menor de un año, crecimiento auricular no severo y ausencia de fragilidad.
6. Estrategia de control de frecuencia
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con FA en quienes se elija una estrategia de control de frecuencia a largo plazo, sugerimos utilizar beta-bloqueadores o bloqueadores de canales de calcio no dihidropiridínicos. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
En pacientes con FA en quienes se elija una estrategia de control de frecuencia, ofrezca un beta-bloqueador estándar como monoterapia inicial.
BPC 2:
En pacientes con FA en quienes se elija una estrategia de control de frecuencia y tengan FEVI < 40%, no utilizar bloqueadores de los canales de calcio no dihidropiridínico (Verapamilo o Diltiazem).
BPC 3:
En pacientes sedentarios con FA no paroxística en quienes se elija una estrategia de control de frecuencia, puede considerar la monoterapia con digoxina.
BPC 4:
En pacientes con FA, si la monoterapia no cesa los síntomas debido al control deficiente de la frecuencia ventricular, considere brindar terapia combinada con cualquiera de los siguientes:
a. Beta-bloqueador
b. Bloqueador de canales de calcio no dihidropiridínicos (Verapamilo o Diltiazem)
c. Digoxina
BPC 5:
En pacientes con FA, no ofrezca amiodarona para control de frecuencia a largo plazo.
BPC 6:
En pacientes con FA, elija el tratamiento farmacológico considerando los síntomas, la frecuencia cardíaca, las comorbilidades y las preferencias del paciente.
BPC 7:
En pacientes con FA permanente muy sintomáticos, en quienes el tratamiento farmacológico ha fracasado o no es tolerado, o presentan síntomas de disfunción ventricular izquierda que se sospecha son originados por la respuesta ventricular alta, considerar la ablación del nodo aurículo-ventricular y estimulación cardiaca (marcapasos o resincronizador).
7. Estrategia de control de ritmo
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con FA en quienes se elija una estrategia de control de ritmo a largo plazo, sugerimos brindar un beta-bloqueador (excepto sotalol) como tratamiento inicial. (Recomendación débil a favor, certeza muy baja de la evidencia)
Recomendación 2:
En pacientes con FA en quienes se elija una estrategia de control de ritmo a largo plazo, sugerimos no brindar fármacos antiarrítmicos de clase Ic como propafenona a personas con cardiopatía conocida. (Recomendación débil en contra, certeza muy baja de la evidencia)
BCP 1:
Si los beta-bloqueadores están contraindicados o no tienen éxito, evalúe la idoneidad de los fármacos alternativos disponibles para el control del ritmo (antiarritmicos clase Ic o III), teniendo en cuenta las comorbilidades.
BCP 2:
Considere la amiodarona en personas con disfunción ventricular izquierda o insuficiencia cardíaca.
BCP 3:
Administrar la estrategia “Pill in the pocket” con propafenona en carga para aquellos pacientes con FA paroxística que cumplen con todos los siguientes criterios:
a. Cuando esta terapia ha sido efectiva al ser administrada bajo monitoreo médico.
b. No tienen antecedentes de disfunción ventricular izquierda, o enfermedad cardíaca valvular significativa o isquémica.
c. Tener un historial de episodios sintomáticos infrecuentes (no más de 6 episodios por año) de FA paroxística.
d. Tener una presión arterial sistólica mayor a 100 mmHg y una frecuencia cardíaca en reposo por encima de 70 lpm.
e. Ser capaces de entender cómo y cuándo tomar el medicamento.
BCP 4:
Para personas con FA de más de 48 horas de duración en quienes está indicada la cardioversión electiva, la cardioversión guiada por ecocardiografía transesofágica (ETE) o la cardioversión convencional (sin ETE y rangos óptimos de anticoagulación oral) deben considerarse igualmente seguras.
8. Ablación mediante cateterismo
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con FA paroxística sintomática que, a pesar del tratamiento farmacológico óptimo, o cuando el tratamiento farmacológico no sea tolerado por el paciente, recomendamos ofrecer ablación mediante cateterismo de los puntos gatillo ubicados en las venas pulmonares. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 2:
En pacientes con FA persistente sintomática que, a pesar del tratamiento farmacológico óptimo, o cuando el tratamiento farmacológico no sea tolerado por el paciente, sugerimos ofrecer ablación mediante cateterismo de los puntos gatillo ubicados en las venas pulmonares. (Recomendación débil a favor, certeza muy baja de la evidencia)
BCP 1:
En pacientes con FA sintomática (paroxística o persistente), considere la ablación quirúrgica concomitante a otra cirugía cardiotorácica.
9. Cardioversión eléctrica de emergencia
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con FA con respuesta ventricular rápida en quienes se detecte inestabilidad hemodinámica, recomendamos usar cardioversión eléctrica de emergencia. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BCP 1:
En pacientes con FA de más de 48 horas de duración que se encuentren hemodinámicamente estables, en quienes se considere estrategia de control de ritmo, considerar la realización de cardioversión guiada por ecocardiografía transesofágica (ETE).
Referencias bibliográficas
- Nkomo VT, Gardin JM, Skelton TN, Gottdiener JS, Scott CG, Enriquez-Sarano M. Burden of valvular heart diseases: a population-based study. The Lancet. 2006;368(9540):1005-11.
- Otto CM, Prendergast B. Aortic-valve stenosis—from patients at risk to severe valve obstruction. New England Journal of Medicine. 2014;371(8):744-56.
- Varadarajan P, Kapoor N, Bansal RC, Pai RG. Clinical profile and natural history of 453 nonsurgically managed patients with severe aortic stenosis. The Annals of thoracic surgery. 2006;82(6):2111-5.
- Pellikka PA, Nishimura RA, Bailey KR, Tajik AJ. The natural history of adults with asymptomatic, hemodynamically significant aortic stenosis. Journal of the American College of Cardiology. 1990;15(5):1012-7.
- Schwarz F, Baumann P, Manthey J, Hoffmann M, Schuler G, Mehmel HC, et al. The effect of aortic valve replacement on survival. Circulation. 1982;66(5):1105-10.
- Pellikka PA, Sarano ME, Nishimura RA, Malouf JF, Bailey KR, Scott CG, et al. Outcome of 622 adults with asymptomatic, hemodynamically significant aortic stenosis during prolonged follow-up. Circulation. 2005;111(24):3290-5.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, 3rd, Fleisher LA, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135(25):e1159-e95.
- Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, 3rd, Guyton RA, et al. 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;129(23):e521-643.
- Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. European heart journal. 2017;38(36):2739-91.
- Tarasoutchi F, Montera MW, Grinberg M, Barbosa MR, Piñeriro DJ, Sánchez CRM, et al. Diretriz Brasileira de Valvopatias – SBC 2011 / I Diretriz Interamericana de Valvopatias – SIAC 2011. Arq Bras Cardiol. 2011;97(5 supl. 1):1-67.
- Lancellotti P, Magne J, Donal E, Davin L, O’Connor K, Rosca M, et al. Clinical outcome in asymptomatic severe aortic stenosis: insights from the new proposed aortic stenosis grading classification. Journal of the American College of Cardiology. 2012;59(3):235-43.
- Bonow RO, Carabello BA, Kanu C, de Leon AC, Jr., Faxon DP, Freed MD, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Valvular Heart Disease). Circulation. 2006;114(5):e84-231.
- Nashef SA, Roques F, Sharples LD, Nilsson J, Smith C, Goldstone AR, et al. EuroSCORE II. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 2012;41(4):734-44; discussion 44-5.
- O’Brien SM, Shahian DM, Filardo G, Ferraris VA, Haan CK, Rich JB, et al. The Society of Thoracic Surgeons 2008 cardiac surgery risk models: part 2–isolated valve surgery. The Annals of thoracic surgery. 2009;88(1 Suppl):S23-42.
- Biancari F, Juvonen T, Onorati F, Faggian G, Heikkinen J, Airaksinen J, et al. Meta-analysis on the performance of the EuroSCORE II and the Society of Thoracic Surgeons Scores in patients undergoing aortic valve replacement. Journal of cardiothoracic and vascular anesthesia. 2014;28(6):1533-9.
- Wang TKM, Wang MTM, Gamble GD, Webster M, Ruygrok PN. Performance of contemporary surgical risk scores for transcatheter aortic valve implantation: A meta-analysis. International journal of cardiology. 2017;236:350-5.
- Singh K, Carson K, Rashid MK, Jayasinghe R, AlQahtani A, Dick A, et al. Transcatheter Aortic Valve Implantation in Intermediate Surgical Risk Patients With Severe Aortic Stenosis: A Systematic Review and Meta-Analysis. Heart, lung & circulation. 2017;27(2):227-34.
- Ad N, Holmes SD, Patel J, Pritchard G, Shuman DJ, Halpin L. Comparison of EuroSCORE II, Original EuroSCORE, and The Society of Thoracic Surgeons Risk Score in Cardiac Surgery Patients. The Annals of thoracic surgery. 2016;102(2):573-9.
- Arangalage D, Cimadevilla C, Alkhoder S, Chiampan A, Himbert D, Brochet E, et al. Agreement between the new EuroSCORE II, the Logistic EuroSCORE and the Society of Thoracic Surgeons score: Implications for transcatheter aortic valve implantation. Archives of Cardiovascular Diseases. 2014;107(6-7):353-60.
- Lim WY, Ramasamy A, Lloyd G, Bhattacharyya S. Meta-analysis of the impact of intervention versus symptom-driven management in asymptomatic severe aortic stenosis. Heart. 2017;103(4):268-72.
- Généreux P, Stone GW, O’Gara PT, Marquis-Gravel G, Redfors B, Giustino G, et al. Natural history, diagnostic approaches, and therapeutic strategies for patients with asymptomatic severe aortic stenosis. Journal of the American College of Cardiology. 2016;67(19):2263-88.
- Zhao Y, Owen A, Henein M. Early valve replacement for aortic stenosis irrespective of symptoms results in better clinical survival: a meta-analysis of the current evidence. International journal of cardiology. 2013;168(4):3560-3.
- Agatston AS, Janowitz WR, Hildner FJ, Zusmer NR, Viamonte M, Detrano R. Quantification of coronary artery calcium using ultrafast computed tomography. Journal of the American College of Cardiology. 1990;15(4):827-32.
- Brown JM, O’brien SM, Wu C, Sikora JAH, Griffith BP, Gammie JS. Isolated aortic valve replacement in North America comprising 108,687 patients in 10 years: changes in risks, valve types, and outcomes in the Society of Thoracic Surgeons National Database. The Journal of thoracic and cardiovascular surgery. 2009;137(1):82-90.
- Cribier A, Eltchaninoff H, Bash A, Borenstein N, Tron C, Bauer F, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002;106(24):3006-8.
- Cribier A, Eltchaninoff H, Tron C, Bauer F, Agatiello C, Sebagh L, et al. Early experience with percutaneous transcatheter implantation of heart valve prosthesis for the treatment of end-stage inoperable patients with calcific aortic stenosis. Journal of the American College of Cardiology. 2004;43(4):698-703.
- Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. The New England journal of medicine. 2010;363(17):1597-607.
- Kapadia SR, Leon MB, Makkar RR, Tuzcu EM, Svensson LG, Kodali S, et al. 5-year outcomes of transcatheter aortic valve replacement compared with standard treatment for patients with inoperable aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet. 2015;385(9986):2485-91.
- Arora S, Strassle PD, Ramm CJ, Rhodes JA, Vaidya SR, Caranasos TG, et al. Transcatheter Versus Surgical Aortic Valve Replacement in Patients With Lower Surgical Risk Scores: A Systematic Review and Meta-Analysis of Early Outcomes. Heart, lung & circulation. 2017;26(8):840-5.
- Witberg G, Lador A, Yahav D, Kornowski R. Transcatheter versus surgical aortic valve replacement in patients at low surgical risk: A meta-analysis of randomized trials and propensity score matched observational studies. Catheterization and cardiovascular interventions : official journal of the Society for Cardiac Angiography & Interventions. 2018.
- Arora S, Misenheimer JA, Jones W, Bahekar A, Caughey M, Ramm CJ, et al. Transcatheter versus surgical aortic valve replacement in intermediate risk patients: a meta-analysis. Cardiovascular diagnosis and therapy. 2016;6(3):241-9.
- Sardar P, Kundu A, Chatterjee S, Feldman DN, Owan T, Kakouros N, et al. Transcatheter versus surgical aortic valve replacement in intermediate-risk patients: Evidence from a meta-analysis. Catheterization and cardiovascular interventions : official journal of the Society for Cardiac Angiography & Interventions. 2017;90(3):504-15.
- Panchal HB, Ladia V, Desai S, Shah T, Ramu V. A meta-analysis of mortality and major adverse cardiovascular and cerebrovascular events following transcatheter aortic valve implantation versus surgical aortic valve replacement for severe aortic stenosis. The American journal of cardiology. 2013;112(6):850-60.
- Takagi H, Niwa M, Mizuno Y, Goto SN, Umemoto T, All-Literature Investigation of Cardiovascular Evidence G. A meta-analysis of transcatheter aortic valve implantation versus surgical aortic valve replacement. The Annals of thoracic surgery. 2013;96(2):513-9.
- Smith CR, Leon MB, Mack MJ, Miller DC, Moses JW, Svensson LG, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. New England Journal of Medicine. 2011;364(23):2187-98.
- Deeb GM, Reardon MJ, Chetcuti S, Patel HJ, Grossman PM, Yakubov SJ, et al. 3-year outcomes in high-risk patients who underwent surgical or transcatheter aortic valve replacement. Journal of the American College of Cardiology. 2016;67(22):2565-74.
- Mack MJ, Leon MB, Smith CR, Miller DC, Moses JW, Tuzcu EM, et al. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): a randomised controlled trial. The Lancet. 2015;385(9986):2477-84.
- Makkar RR, Fontana GP, Jilaihawi H, Kapadia S, Pichard AD, Douglas PS, et al. Transcatheter aortic-valve replacement for inoperable severe aortic stenosis. The New England journal of medicine. 2012;366(18):1696-704.
- Kapadia SR, Tuzcu EM, Makkar RR, Svensson LG, Agarwal S, Kodali S, et al. Long-term outcomes of inoperable patients with aortic stenosis randomly assigned to transcatheter aortic valve replacement or standard therapy. Circulation. 2014;130(17):1483-92.
- Nishimura RA HD, Jr., Reeder GS. . Percutaneous balloon valvuloplasty. Mayo Clin Proc. 1990;65:198-220.
- Lieberman EB BT, Hermiller JB, et al. Balloon aortic valvuloplasty in adults: failure of procedure to improve long-term survival. J Am Coll Cardiol. 1995;26:1522-8.
- Gil Albarova O, Juez M, Berenguer A, Sanmiguel D, Sirgo Gonzalez J. Implante de válvula aórtica transcatéter. Una revisión de las vías de abordaje. Cirugía Cardiovascular. 2016;23(4):199-204.
- Cheung A, Lichtenstein KM. Illustrated techniques for transapical aortic valve implantation. Annals of Cardiothoracic Surgery. 2012;1(2):231-9.
- Walther T, Dewey T, Borger MA, Kempfert J, Linke A, Becht R, et al. Transapical aortic valve implantation: step by step. The Annals of thoracic surgery. 2009;87(1):276-83.
- Schofer N, Deuschl F, Conradi L, Lubos E, Schirmer J, Reichenspurner H, et al. Preferential short cut or alternative route: the transaxillary access for transcatheter aortic valve implantation. Journal of thoracic disease. 2015;7(9):1543-7.
- Castillo Y, Manrique R, Mainar V, Bordes P, Climent V, Arenas J, et al. Implantación de prótesis aórtica transcatéter por vía transaórtica. Experiencia inicial. Cirugía Cardiovascular. 2013;20(1):35-8.
- Gilmanov D, Farneti PA, Ferrarini M, Santarelli F, Murzi M, Miceli A, et al. Full sternotomy versus right anterior minithoracotomy for isolated aortic valve replacement in octogenarians: a propensity-matched study dagger. Interactive cardiovascular and thoracic surgery. 2015;20(6):732-41; discussion 41.
- Modine T, Sudre A, Amr G, Delhaye C, Koussa M. Implantation of a Sapien XT aortic bioprosthesis through the left carotid artery. Journal of cardiac surgery. 2014;29(3):337-9.
- Hajaj M, Karim A, Pascaline S, Noor L, Patel S, Dakka M. Impact of MRI on high grade Ductal Carcinoma Insitu (HG DCIS) management, are we using the full scope of MRI? Eur J Radiol. 2017;95:271-7.
- Amat-Santos IJ, Rojas P, Gutierrez H, Vera S, Castrodeza J, Tobar J, et al. Transubclavian approach: A competitive access for transcatheter aortic valve implantation as compared to transfemoral. Catheterization and cardiovascular interventions : official journal of the Society for Cardiac Angiography & Interventions. 2018.
- Thongprayoon C, Cheungpasitporn W, Gillaspie EA, Greason KL, Kashani KB. The risk of acute kidney injury following transapical versus transfemoral transcatheter aortic valve replacement: a systematic review and meta-analysis. Clinical kidney journal. 2016;9(4):560-6.
- Liu Z, He R, Wu C, Xia Y. Transfemoral versus transapical aortic implantation for aortic stenosis based on no significant difference in logistic EuroSCORE: a meta-analysis. The Thoracic and cardiovascular surgeon. 2016;64(05):374-81.
- Chandrasekhar J, Hibbert B, Ruel M, Lam B-K, Labinaz M, Glover C. Transfemoral vs Non-transfemoral Access for Transcatheter Aortic Valve Implantation: A Systematic Review and Meta-analysis. Canadian Journal of Cardiology. 2015;31(12):1427-38.
- Conrotto F, D’ascenzo F, Francesca G, Colaci C, Sacciatella P, BIONDI‐ZOCCAI G, et al. Impact of Access on TAVI Procedural and Midterm Follow‐Up: A Meta‐Analysis of 13 Studies and 10,468 Patients. Journal of interventional cardiology. 2014;27(5):500-8.
- Ghatak A, Bavishi C, Cardoso RN, Macon C, Singh V, Badheka AO, et al. Complications and Mortality in Patients Undergoing Transcatheter Aortic Valve Replacement With Edwards SAPIEN & SAPIEN XT Valves: A Meta-Analysis of World-Wide Studies and Registries Comparing the Transapical and Transfemoral Accesses. J Interv Cardiol. 2015;28(3):266-78.
- Panchal HB, Ladia V, Amin P, Patel P, Veeranki SP, Albalbissi K, et al. A meta-analysis of mortality and major adverse cardiovascular and cerebrovascular events in patients undergoing transfemoral versus transapical transcatheter aortic valve implantation using edwards valve for severe aortic stenosis. The American journal of cardiology. 2014;114(12):1882-90.
- Ashley E, Niebauer J. Cardiology Explained. London: Remedica; 2004.
- Paradis J-M, Fried J, Nazif T, Kirtane A, Harjai K, Khalique O, et al. Aortic stenosis and coronary artery disease: What do we know? What don’t we know? A comprehensive review of the literature with proposed treatment algorithms. European heart journal. 2014;35(31):2069-82.
- Montalescot G, Andersen HR, Antoniucci D, Betriu A, de Boer MJ, Grip L, et al. Recommendations on percutaneous coronary intervention for the reperfusion of acute ST elevation myocardial infarction. Heart. 2004;90(6):e37-e.
- Blumenstein J, Kim WK, Liebetrau C, Gaede L, Kempfert J, Walther T, et al. Challenges of coronary angiography and intervention in patients previously treated by TAVI. Clinical research in cardiology : official journal of the German Cardiac Society. 2015;104(8):632-9.
- Kotronias RA, Kwok CS, George S, Capodanno D, Ludman PF, Townend JN, et al. Transcatheter Aortic Valve Implantation With or Without Percutaneous Coronary Artery Revascularization Strategy: A Systematic Review and Meta-Analysis. Journal of the American Heart Association. 2017;6(6).
- Bajaj A, Pancholy S, Sethi A, Rathor P. Safety and feasibility of PCI in patients undergoing TAVR: A systematic review and meta-analysis. Heart & lung : the journal of critical care. 2017;46(2):92-9.
- Yang Y, Huang FY, Huang BT, Xiong TY, Pu XB, Chen SJ, et al. The safety of concomitant transcatheter aortic valve replacement and percutaneous coronary intervention: A systematic review and meta-analysis. Medicine. 2017;96(48):e8919.
- Griese DP, Reents W, Toth A, Kerber S, Diegeler A, Babin-Ebell J. Concomitant coronary intervention is associated with poorer early and late clinical outcomes in selected elderly patients receiving transcatheter aortic valve implantation. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 2014;46(1):e1-7.
- Ever D Grech. ABC of interventional cardiology. London: BMJ Publishing Group; 2004.
- Khawaja MZ, Wang D, Pocock S, Redwood SR, Thomas MR. The percutaneous coronary intervention prior to transcatheter aortic valve implantation (ACTIVATION) trial: study protocol for a randomized controlled trial. Trials. 2014;15:300.
- Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, Guyton RA, et al. 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2014.
- Jacques L, Jensen TS, Schafer J, Fulton S, Schott L, Baldwin J. Decision Memo for Transcatheter Aortic Valve Replacement (TAVR) (CAG-00430N). Centers for Medicare and Medicaid Services. 2012.
- Sintek M, Zajarias A. Patient evaluation and selection for transcatheter aortic valve replacement: the heart team approach. Progress in cardiovascular diseases. 2014;56(6):572-82.
- Martinez GJ, Seco M, Jaijee SK, Adams MR, Cartwright BL, Forrest P, et al. Introduction of an interdisciplinary heart team-based transcatheter aortic valve implantation programme: short and mid-term outcomes. Internal medicine journal. 2014;44(9):876-83.
- Parma R, Zembala MO, Dabrowski M, Jagielak D, Witkowski A, Suwalski P, et al. Transcatheter aortic valve implantation. Expert Consensus of the Association of Cardiovascular Interventions of the Polish Cardiac Society and the Polish Society of Cardio-Thoracic Surgeons, approved by the Board of the Polish Cardiac Society. Kardiologia polska. 2017;75(9):937-64.
- Iglesias D, Salinas P, Moreno R, Garcia-Blas S, Calvo L, Jimenez-Valero S, et al. Prognostic impact of decisions taken by the heart team in patients evaluated for transcatheter aortic valve implantation. Rev Port Cardiol. 2015;34(10):587-95.
- Coylewright M, Mack MJ, Holmes DR, Jr., O’Gara PT. A call for an evidence-based approach to the Heart Team for patients with severe aortic stenosis. Journal of the American College of Cardiology. 2015;65(14):1472-80.
82. Showkathali R, Chelliah R, Brickham B, Dworakowski R, Alcock E, Deshpande R, et al. Multi-disciplinary clinic: next step in «Heart team» approach for TAVI. International journal of cardiology. 2014;174(2):453-5.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com