
GUÍA DE PRÁCTICA CLÍNICA
PARA EL DIAGNÓSTICO Y TRATAMIENTO DE LA INFECCIÓN CRÓNICA POR EL VIRUS DE HEPATITIS C (2019)
DESCARGAR
VERSIÓN
ARTÍCULO
DESCARGAR
VERSIÓN
EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN
CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: pacientes con hepatitis C.
- Alcance: diagnóstico y tratamiento de infección crónica por Hepatitis C.
Autores
Expertos clínicos:
- Dávalos Moscol Milagros Beatriz
- Cabrera Cabrejos María Cecilia
- García Delgado César
- Padilla Machaca Pedro Martin
- Pereda Vejarano Carlos Yanar
- Vera Mujica Romina
Metodólogos:
- Huaringa Marcelo Jorge
- Montes Alvis José
- Goicochea Lugo Sergio
- Becerra Chauca Naysha
- Nieto Gutiérrez Wendy
- García Gomero David
- Chávez Rimache Lesly
- Failoc Rojas Virgilio
- Hernández Díaz Adrián Vladimir
- Piscoya Rivera José Alejandro
Coordinadores:
- Raúl Timaná Ruiz
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
vacio
vacio
Flujogramas que resumen el contenido de la GPC
Flujogramas del tamizaje, diagnóstico, evaluación y manejo de la infección crónica por VHC
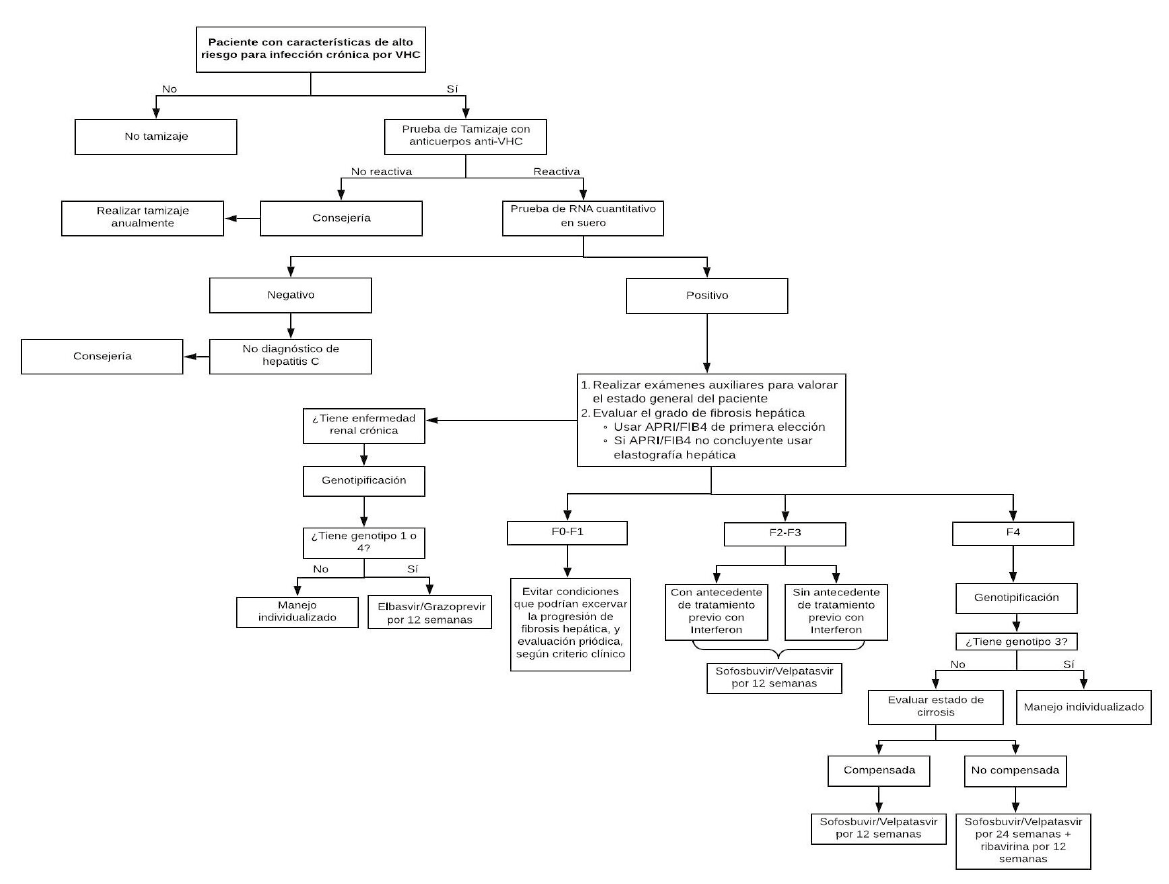
1. Tamizaje
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con alto riesgo de infección crónica por VHC (pacientes con una historia de exposición o comportamiento de alto riesgo para adquirir la infección por VHC), se recomienda realizar una prueba de tamizaje para identificar a los pacientes que han sido expuestos al VHC. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BPC 1:
Los pacientes con una prueba de tamizaje positiva serán referidos a gastroenterólogos, infectologos, nefrólogos y médicos internistas con capacitación en hepatitis C.
BPC 2:
Se considerarán pacientes con factores de alto riesgo de infección por VHC a:
- Los receptores de productos sanguíneos infectados con VHC y los pacientes sometidos a procedimientos invasivos en centros sanitarios cuyas prácticas de control de la infección por VHC no sean las óptimas.
- Pacientes con enfermedad renal crónica en diálisis
- Personas infectadas por el VIH o VHB
- Los niños nacidos de madres infectadas por el VHC
- Personas cuyas parejas sexuales están infectadas por el VHC
- Los usuarios de drogas inyectables o por vía nasal
- Reclusos o exreclusos
- Personas que hayan tenido tatuajes o perforaciones ornamentales (piercings).
- Paciente con sospecha de enfermedad hepática crónica
Personal de salud expuesto a contacto con fluidos de pacientes con HVC
BPC 3:
Los pacientes con una prueba de tamizaje positiva serán referidos a gastroenterólogos, infectologos, nefrólogos y médicos internistas con capacitación en hepatitis C.
BPC 4:
Los pacientes con una historia de exposición o comportamiento de alto riesgo para adquirir la infección por VHC y cuya prueba de tamizaje fue negativa, deben recibir consejería y tener un nuevo tamizaje anualmente.
2. Diagnóstico
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con una prueba de tamizaje de anticuerpos positiva para virus de hepatitis C, se sugiere realizar la prueba cuantitativa de RNA viral para confirmar la infección del VHC y cuantificar la carga viral. (Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
Los pacientes con una historia de exposición o comportamiento de alto riesgo para adquirir la infección por VHC y cuya prueba confirmatoria fue negativa, deben recibir consejería y tener una prueba confirmatoria anualmente.
3. Estadiaje
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con infección crónica por el VHC, recomendamos realizar la evaluación del grado de fibrosis hepática usando el índice APRI o FIB-4 como pruebas de primera elección. (Recomendación fuerte a favor, certeza baja de la evidencia)
Recomendación 1:
En pacientes con infección crónica por el VHC en quienes exista duda del resultado del APRI y/o del FIB-4 o existiera alguna condición clínica que altere sus resultados, se sugiere realizar la evaluación del grado de fibrosis
hepática usando elastografía hepática. (Recomendación condicional a favor, certeza baja de la evidencia)
4. Tratamiento médico
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con infección crónica por VHC genotipos 1 al 6, sin cirrosis (F2 a F3) o con cirrosis compensada (F4 y Child-Pugh A), y nunca antes tratados; recomendamos usar Sofosbuvir/Velpatasvir durante 12 semanas. (Recomendación fuerte a favor, certeza moderada de la evidencia)
Recomendación 2:
En pacientes con infección crónica por VHC genotipos 1 al 6, sin cirrosis (F2 a F3) o con cirrosis compensada (F4 y Child-Pugh A), antes tratados; recomendamos usar Sofosbuvir/Velpatasvir por 12 semanas. (Recomendación débil a favor, certeza baja de la evidencia)
Recomendación 3:
En pacientes con infección crónica por VHC genotipos 1 o 4, sin cirrosis (F2 a F3) o con cirrosis compensada (F4 y Child-Pugh A), y con enfermedad renal crónica (TFG < 30 ml/min por 1.73m2) o diálisis; recomendamos usar el esquema Grazoprevir/Elbasvir por 12 semanas. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 4:
En pacientes con infección crónica por VHC con cirrosis descompensada (Child-Pugh B o C), genotipos 1 al 6; recomendamos usar tratamiento con Velpatasvir/Sofosbuvir por 24 semanas. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 5:
En pacientes con infección crónica por VHC con cirrosis descompensada (Child-Pugh B o C), genotipos 1 al 6; sugerimos usar tratamiento con Velpatasvir/Sofosbuvir más ribavirina por 12 semanas. (Recomendación condicional a favor, certeza baja de la evidencia)
Recomendación 6:
En pacientes adultos postrasplante hepático con infección crónica por el VHC genotipos 1 al 6 sin cirrosis (F2 a F3) o con cirrosis compensada (F4 y Child-Pugh A); sugerimos administrar sofosbuvir/velpatasvir por 12 semanas o manejo individualizado de cada caso. (Recomendación condicional a favor, certeza muy baja de la evidencia)
Recomendación 7:
En pacientes adultos postrasplante renal con infección crónica por el VHC genotipos 1 y 4, sin cirrosis (F2 a F3) o con cirrosis compensada (F4 y Child-Pugh A); sugerimos administrar sofosbuvir/velpatasvir por 12 semanas o manejo individualizado de cada caso. (Recomendación condicional a favor, certeza muy baja de la evidencia)
Recomendación 8:
En pacientes adultos con infección crónica por el VHC (F2 a F4) y con coinfección por VIH; se recomienda tratar de la misma manera que los pacientes sin VIH, siguiendo las recomendaciones antes mencionadas según antecedente de tratamiento previo, enfermedad renal crónica y estatus de cirrosis. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 9:
En pacientes con coinfección de VHB/VHC, se recomienda usar los esquemas antes mencionados según antecedente de tratamiento previo, enfermedad renal crónica y estatus de cirrosis. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
En pacientes adultos con infección crónica por el VHC, se debe evaluar las comorbilidades y el uso de medicación actual.
BPC 2:
En pacientes adultos con infección crónica por el VHC, se debe solicitar los siguientes exámenes auxiliares antes de iniciar el tratamiento.
- Hemograma completo
- Perfil hepático completo
- Perfil de coagulación completo más INR
- Pruebas de función renal (creatinina sérica para cálculo de la TFG)
- Dosaje de alfa-fetoproteína
- Serología para VHB (HBsAg y anti-HBc)
- Serología para VIH
- Prueba de embarazo en mujer en edad fértil
- Ecografía abdominal
BPC 3:
Para determinar la TFG se usará la formula CKD-EPI y/o según criterio médico se hará uso de estimación de TFG a través de depuración de creatinina en orina de 24hrs.
BPC 4:
En pacientes adultos con infección crónica por el VHC, se debe realizar genotipificación en los pacientes con cirrosis hepática y enfermedad renal crónica severa (TFG < 30 ml/min por 1.73m2) o diálisis, con el fin de optimizar el tratamiento, pero esto no debería retrasar el inicio del mismo.
BPC 5:
Los pacientes con manifestaciones extrahepáticas clínicamente significativas, debida a la infección crónica por VHC; serán evaluados y tratados según el grado de fibrosis hepática y función renal. El tratamiento será individualizado y se priorizará según el estado clínico del paciente.
BPC 6:
En pacientes con infección crónica por VHC genotipo 3, con cirrosis compensada (F4 y Child-Pugh A), y nunca antes tratado; se debe realizar el manejo de manera individualizada.
BPC 7:
En pacientes con infección crónica por VHC genotipo 3, con cirrosis compensada (F4 y Child A), y antes tratados; se debe realizar el manejo de manera individualizada.
BPC 8:
En pacientes adultos con infección crónica por VHC genotipo 1a o 4, con carga viral > 800 000 UI/ml, y con enfermedad renal crónica (TFG < 30 ml/min por 1.73m2) o diálisis; se debe usar el esquema Grazoprevir/Elbasvir por 16 semanas.
BPC 9:
En pacientes adultos con infección crónica por VHC genotipo 1a o 4 pero con carga viral ≤ 800 000 UI/ml, y con enfermedad renal crónica (TFG < 30 ml/min por 1.73m2) o diálisis; se debe usar el esquema Grazoprevir/Elbasvir por 12 semanas.
BPC 10:
En pacientes candidatos a ribavirina, la dosis inicial de ribavirina puede ser 600 mg al día, e ir aumentando según tolerancia.
BPC 11:
La dosis de ribavirina debe ser basada en el peso del paciente: en los pacientes con peso <75 kg la dosis debe ser de 1000 mg al día; y si el peso es ≥75 kg la dosis debe ser 1200 mg al día.
BPC 12:
En pacientes con cirrosis descompensada o en pacientes con antecedentes de descompensación no se debe indicar tratamientos que contengan un inhibidor de proteasa.
BPC 13:
En los pacientes con cirrosis descompensada con indicación de trasplante de hígado y con un puntaje MELD ≥ 18, se debe trasplantar primero y tratar después del trasplante; pero si el tiempo de lista de espera estimado será mayor a 6 meses, se puede tratar antes del transplante.
BPC 14:
Estos pacientes deben ser manejados en hospitales nivel III y IV.
BPC 15:
En pacientes adultos postrasplante hepático con infección crónica por el VHC, el momento óptimo de tratamiento debe ser individualizado según condición clínica y
BPC 16:
El tratamiento con sofosbuvir/velpatasvir puede prescribirse con la mayoría de los antirretrovirales. Sin embargo, está contraindicado con los siguientes antirretrovirales: efavirenz, nevirapina, etravirina.
BPC 17:
El Tratamiento con Grazoprevir/Elbasvir no debe ser prescrito con cobicistat, efavirenz, etravirina, nevirapina, ni con algún inhibidor de proteasa.
BPC 18:
La Ribavirina no debe ser empleado con los siguientes fármacos: didanosina, estavudina, ni zidovudina.
BPC 19:
Debido a que la terapia de sofosbuvir/velpatasvir aumenta los niveles de tenofovir. Esto significa que los pacientes con un régimen farmacológico que contenga fumarato de tenofovir disoproxil deben ser monitoreados por los eventos adversos renales.
BPC 20:
En todos los pacientes con infección de VHC, se debe realizar pruebas de VHB por riesgo de activación de este último, ante el uso de antivirales de acción directa para VHC.
BPC 21:
En pacientes con coinfección de VHB/VHC con cirrosis, administrar terapia dual para VHB en caso tenga ADN de VHB detectable.
BPC 22:
En pacientes con coinfección de VHB/VHC sin cirrosis con HBAgs positivo, monitorizar ADN de VHB cada 4 a 8 semanas, y dar tratamiento para VHB en caso de reactivación.
BPC 23:
En pacientes con coinfección de VHB/VHC sin cirrosis con anti-VHBc positivo, monitorizar transaminasas cada cuatro semanas y solicitar ADN viral en caso de elevación dos veces del valor normal y antígeno de superficie positivo.
Referencias bibliográficas
- Organization Global hepatitis report. Geneva. 2017.
- Colichon Yerosh A, Figueroa R, Moreno A, Zumaeta E, Ferrandiz J, Busalleu A, et al. [Serologic prevalence of HCV antibodies in health personnel in Peru]. Revista de gastroenterologia del Peru : organo oficial de la Sociedad de Gastroenterologia del 2004;24(1):13-20.
- Davalos Moscol [Epidemiology of hepatitis C virus in Peru and Latin America]. Revista de gastroenterologia del Peru : organo oficial de la Sociedad de Gastroenterologia del Peru. 2009;29(4):347-54.
- Farfan G, Cabezas [Prevalence of viral hepatitis type C in blood donors in Peru]. Revista de gastroenterologia del Peru : organo oficial de la Sociedad de Gastroenterologia del Peru. 2003;23(3):171-6.
- Sanchez JL, Sjogren MH, Callahan JD, Watts DM, Lucas C, Abdel-Hamid M, et Hepatitis C in Peru: risk factors for infection, potential iatrogenic transmission, and genotype distribution. The American journal of tropical medicine and hygiene. 2000;63(5-6):242-8.
- Bustios Sanchez C, Diaz Ferrer J, Roman Vargas R, Davalos Moscol M, Zumaeta Villena [Clinical – Epidemiological characteristics of the Hepatocellular Carcinoma and treatment in the departament of digestive system diseases of the National Hospital «Eduardo Rebagliatti Martins» (HNERM) – ESSALUD]. Revista de gastroenterologia del Peru : organo oficial de la Sociedad de Gastroenterologia del Peru. 2009;29(1):17-23.
- El-Serag Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology. 2012;142(6):1264-73.e1.
- Poynard T, Bedossa P, Opolon P. Natural history of liver fibrosis progression in patients with chronic hepatitis The OBSVIRC, METAVIR, CLINIVIR, and DOSVIRC groups. Lancet (London, England). 1997;349(9055):825-32.
- Sarin SK, Kumar Natural history of HCV infection. Hepatology international. 2012;6(4):684-95.
- Thein HH, Yi Q, Dore GJ, Krahn Estimation of stage-specific fibrosis progression rates in chronic hepatitis C virus infection: a meta-analysis and meta-regression. Hepatology (Baltimore, Md). 2008;48(2):418-31.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised Bmj. 2011;343:d5928.
- Slim K, Nini E, Forestier D, Kwiatkowski F, Panis Y, Chipponi J. Methodological index for non-randomized studies (minors): development and validation of a new ANZ journal of surgery. 2003;73(9):712-6.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of Journal of clinical epidemiology. 2013;66(7):719-25.
- Gower E, Estes C, Blach S, Razavi-Shearer K, Razavi Global epidemiology and genotype distribution of the hepatitis C virus infection. Journal of hepatology. 2014;61(1 Suppl):S45-57.
- Gretch DR. Use and interpretation of HCV diagnostic tests in the clinical setting. Clinics in liver disease. 1997;1(3):543-57,
- Gretch Diagnostic tests for hepatitis C. Hepatology (Baltimore, Md). 1997;26(3 Suppl 1):43s-7s.
- Aspinall EJ, Doyle JS, Corson S, Hellard ME, Hunt D, Goldberg D, et Targeted hepatitis C antibody testing interventions: a systematic review and meta-analysis. European journal of epidemiology. 2015;30(2):115-29.
- Colin C, Lanoir D, Touzet S, Meyaud-Kraemer L, Bailly F, Trepo Sensitivity and specificity of third-generation hepatitis C virus antibody detection assays: an analysis of the literature. Journal of viral hepatitis. 2001;8(2):87-95.
- Chou R, Cottrell EB, Wasson N, Rahman B, Guise JM. Screening for hepatitis C virus infection in adults: a systematic review for the U.S. Preventive Services Task Force. Ann Intern 2013;158(2):101-8.
- Tang W, Chen W, Amini A, Boeras D, Falconer J, Kelly H, et al. Diagnostic accuracy of tests to detect Hepatitis C antibody: a meta-analysis and review of the BMC infectious diseases. 2017;17(Suppl 1):695.
- Health Screening for Hepatitis C Virus: A Systematic Review [Internet]. 2017 Mar.
- WHO Hepatitis C diagnostic technology landscape. 2015.
- Guidelines on hepatitis B and C testing. . Geneva: World Health Organization. 2017.
- Yamane D, McGivern DR, Masaki T, Lemon SM. Liver injury and disease pathogenesis in chronic hepatitis Current topics in microbiology and immunology. 2013;369:263-88.
- Bedossa P, Poynard An algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group. Hepatology (Baltimore, Md). 1996;24(2):289-93.
- Ishak K, Baptista A, Bianchi L, Callea F, De Groote J, Gudat F, et al. Histological grading and staging of chronic hepatitis. Journal of hepatology. 1995;22(6):696-9.
- Kim SU, Oh HJ, Wanless IR, Lee S, Han KH, Park YN. The Laennec staging system for histological sub-classification of cirrhosis is useful for stratification of prognosis in patients with liver Journal of hepatology. 2012;57(3):556-63.
- Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active Hepatology (Baltimore, Md). 1981;1(5):431-5.
- Rastogi A, Maiwall R, Bihari C, Ahuja A, Kumar A, Singh T, et al. Cirrhosis histology and Laennec staging system correlate with high portal Histopathology. 2013;62(5):731-41.
- Kutami R GN, Wanless I, et al. . The Laennec grading system for assessment of hepatic fibrosis: validation by correlation with wedged hepatic vein pressure and clinical features. Hepatology 2000;32:407A.
- Gaiani S, Gramantieri L, Venturoli N, Piscaglia F, Siringo S, D’Errico A, et al. What is the criterion for differentiating chronic hepatitis from compensated cirrhosis? A prospective study comparing ultrasonography and percutaneous liver Journal of hepatology. 1997;27(6):979-85.
- Wai CT, Greenson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology (Baltimore, Md). 2003;38(2):518-26.
- Sheth SG, Flamm SL, Gordon FD, Chopra S. AST/ALT ratio predicts cirrhosis in patients with chronic hepatitis C virus The American journal of gastroenterology. 1998;93(1):44-8.
- Sterling RK, Lissen E, Clumeck N, Sola R, Correa MC, Montaner J, et al. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology (Baltimore, Md). 2006;43(6):1317-25.
- Vallet-Pichard A, Mallet V, Nalpas B, Verkarre V, Nalpas A, Dhalluin-Venier V, et al. FIB- 4: an inexpensive and accurate marker of fibrosis in HCV comparison with liver biopsy and fibrotest. Hepatology (Baltimore, Md). 2007;46(1):32-6.
- Halfon P, Imbert-Bismut F, Messous D, Antoniotti G, Benchetrit D, Cart-Lamy P, et al. A prospective assessment of the inter-laboratory variability of biochemical markers of fibrosis (FibroTest) and activity (ActiTest) in patients with chronic liver Comparative hepatology. 2002;1(1):3-.
- Boursier J, Isselin G, Fouchard-Hubert I, Oberti F, Dib N, Lebigot J, et Acoustic radiation force impulse: a new ultrasonographic technology for the widespread noninvasive diagnosis of liver fibrosis. European journal of gastroenterology & hepatology. 2010;22(9):1074- 84.
- Gao Y, Zheng J, Liang P, Tong M, Wang J, Wu C, et Liver Fibrosis with Two-dimensional US Shear-Wave Elastography in Participants with Chronic Hepatitis B: A Prospective Multicenter Study. Radiology. 2018;289(2):407-15.
- Huwart L, Sempoux C, Vicaut E, Salameh N, Annet L, Danse E, et Magnetic resonance elastography for the noninvasive staging of liver fibrosis. Gastroenterology. 2008;135(1):32-40.
- Ophir J, Cespedes I, Ponnekanti H, Yazdi Y, Li Elastography: a quantitative method for imaging the elasticity of biological tissues. Ultrasonic imaging. 1991;13(2):111-34.
- Singh S, Venkatesh SK, Wang Z, Miller FH, Motosugi U, Low RN, et Diagnostic performance of magnetic resonance elastography in staging liver fibrosis: a systematic review and meta-analysis of individual participant data. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2015;13(3):440-51.e6.
- Stanaway JD, Flaxman AD, Naghavi M, Fitzmaurice C, Vos T, Abubakar I, et The global burden of viral hepatitis from 1990 to 2013: findings from the Global Burden of Disease Study 2013. Lancet (London, England). 2016;388(10049):1081-8.
- Neumann-Haefelin C, Thimme Adaptive immune responses in hepatitis C virus infection. Current topics in microbiology and immunology. 2013;369:243-62.
- van der Meer AJ, Veldt BJ, Feld JJ, Wedemeyer H, Dufour JF, Lammert F, et Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis. Jama. 2012;308(24):2584-93.
- Swain MG, Lai MY, Shiffman ML, Cooksley WG, Zeuzem S, Dieterich DT, et A sustained virologic response is durable in patients with chronic hepatitis C treated with peginterferon alfa- 2a and ribavirin. Gastroenterology. 2010;139(5):1593-601.
- Manns MP, Pockros PJ, Norkrans G, Smith CI, Morgan TR, Haussinger D, et Long-term clearance of hepatitis C virus following interferon alpha-2b or peginterferon alpha-2b, alone or in combination with ribavirin. Journal of viral hepatitis. 2013;20(8):524-9.
- Pawlotsky Hepatitis C Virus Resistance to Direct-Acting Antiviral Drugs in Interferon- Free Regimens. Gastroenterology. 2016;151(1):70-86.
- Negro F, Forton D, Craxi A, Sulkowski MS, Feld JJ, Manns Extrahepatic morbidity and mortality of chronic hepatitis C. Gastroenterology. 2015;149(6):1345-60.
- Penin F, Dubuisson J, Rey FA, Moradpour D, Pawlotsky Structural biology of hepatitis C virus. Hepatology (Baltimore, Md). 2004;39(1):5-19.
- Pisaturo M, Russo A, Onorato L, Coppola Efficacy of 12-weeks velpatasvir plus sofosbuvir-based regimen in hcv-naive subjects with mild fibrosis: a meta-analysis. Acta Bio Medica Atenei Parmensis. 2019;90(2).
- Wang X, Fan X, Deng H, Zhang X, Zhang K, Li N, et Efficacy and safety of glecaprevir/pibrentasvir for chronic hepatitis C virus genotypes 1-6 infection: a systematic review and meta-analysis. International journal of antimicrobial agents. 2019.
- Zoratti M, Organization Guidelines for the care and treatment of persons diagnosed with chronic hepatitis C virus infection: web annex 3.1: adult hepatitis C virus treatment systematic review. World Health Organization; 2018.
- Hepatitis C guidance 2018 update: AASLD-IDSA recommendations for testing, managing, and treating hepatitis C virus Clinical Infectious Diseases. 2018;67(10):1477-92.
- Organization WH. Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection: World Health Organization;
- Pisaturo M, Russo A, Onorato L, Coppola Efficacy of 12-weeks velpatasvir plus sofosbuvir-based regimen in HCV-naive subjects with mild fibrosis: a meta-analysis. Acta bio- medica : Atenei Parmensis. 2019;90(2):187-96.
- Wang X, Fan X, Deng H, Zhang X, Zhang K, Li N, et Efficacy and safety of glecaprevir/pibrentasvir for chronic hepatitis C virus genotypes 1-6 infection: a systematic review and meta-analysis. International journal of antimicrobial agents. 2019.
- Worl Health Organization. Guidelines for the care and treatment of persons diagnosed with chronic hepatitis C virus infection. In: WHO, editor. Ginebra WHO;
- Treatment Action Genotipos del VHC. In: TAG, editor. USA: TAG; 2019.
- Kidney D, Improving KDIGO clinical practice guidelines for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease. Kidney international Supplement. 2008(109):S1.
- Gane E, Lawitz E, Pugatch D, Papatheodoridis G, Brau N, Brown A, et Glecaprevir and Pibrentasvir in Patients with HCV and Severe Renal Impairment. The New England journal of medicine. 2017;377(15):1448-55.
- Kumada H, Watanabe T, Suzuki F, Ikeda K, Sato K, Toyoda H, et al. Efficacy and safety of glecaprevir/pibrentasvir in HCV-infected Japanese patients with prior DAA experience, severe renal impairment, or genotype 3 Journal of gastroenterology. 2018;53(4):566-75.
- Bruchfeld A, Roth D, Martin P, Nelson DR, Pol S, Londono MC, et al. Elbasvir plus grazoprevir in patients with hepatitis C virus infection and stage 4-5 chronic kidney disease: clinical, virological, and health-related quality-of-life outcomes from a phase 3, multicentre, randomised, double-blind, placebo-controlled trial. The lancet Gastroenterology & hepatology. 2017;2(8):585-94.
- Roth D, Nelson DR, Bruchfeld A, Liapakis A, Silva M, Monsour H, Jr., et al. Grazoprevir plus elbasvir in treatment-naive and treatment-experienced patients with hepatitis C virus genotype 1 infection and stage 4-5 chronic kidney disease (the C-SURFER study): a combination phase 3 Lancet (London, England). 2015;386(10003):1537-45.
- Pockros PJ, Reddy KR, Mantry PS, Cohen E, Bennett M, Sulkowski MS, et al. Efficacy of Direct-Acting Antiviral Combination for Patients With Hepatitis C Virus Genotype 1 Infection and Severe Renal Impairment or End-Stage Renal Gastroenterology. 2016;150(7):1590-8.
- SOVALDI® (sofosbuvir), (2013).
- IETSI-EsSalud. Análisis de Impacto Presupuestal de esquemas combinados de antivirales de acción directa para el tratamiento de la infección crónica por el virus de la hepatitis C. . Perú2018
- IETSI-ESSALUD. EFICACIA Y SEGURIDAD DE ANTIVIRALES DE ACCIÓN DIRECTA (AAD) EN LOS PACIENTES CON HEPATITIS C CRÓNICA. Dictamen Preliminar de Evaluación de Tecnología Sanitaria ° 027-SDEPFyOTS-DETS-IETSI-2019. Lima2019.
- Serfaty L, Jacobson I, Rockstroh J, Altice FL, Hwang P, Barr E, et al. The accuracy of baseline viral load for predicting the efficacy of elbasvir/grazoprevir in participants with hepatitis C virus genotype 1a infection: An integrated analysis. Journal of viral hepatitis. 2019;26(3):329-
- Yabluchansky M, Bogun L, Martymianova L, Bychkova O, Lysenko N, Brynza Cirrhosis of the Liver. 2017.
- National Clinical Guideline Centre (NICE). Atrial Atrial fibrillation: the management of atrial fibrillation – Clinical guideline: NICE; 2014.
- Guarino M, Morisco F, Valvano MR, Ippolito AM, Librandi M, Andriulli N, et Systematic review: interferon-free regimens for patients with HCV-related Child C cirrhosis. Alimentary pharmacology & therapeutics. 2017;45(9):1193-200.
- Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, Fried MW, Segal JB, Sulkowski MS. Oral Direct-Acting Agent Therapy for Hepatitis C Virus Infection: A Systematic Review. Ann Intern 2017;166(9):637-48.
- Manns M, Samuel D, Gane EJ, Mutimer D, McCaughan G, Buti M, et al. Ledipasvir and sofosbuvir plus ribavirin in patients with genotype 1 or 4 hepatitis C virus infection and advanced liver disease: a multicentre, open-label, randomised, phase 2 The Lancet Infectious Diseases. 2016;16(6):685-97.
- Charlton M, Everson GT, Flamm SL, Kumar P, Landis C, Brown Jr RS, et al. Ledipasvir and sofosbuvir plus ribavirin for treatment of HCV infection in patients with advanced liver disease. 2015;149(3):649-59.
- Peng Y, Qi X, Tang S, Deng H, Li J, Ning Z, et al. Child-Pugh, MELD, and ALBI scores for predicting the in-hospital mortality in cirrhotic patients with acute-on-chronic liver failure. Expert review of gastroenterology & 2016;10(8):971-80.
- EASL Recommendations on Treatment of Hepatitis C Journal of hepatology. 2018;69(2):461-511.
- Gane EJ, Portmann BC, Naoumov NV, Smith HM, Underhill JA, Donaldson PT, et Long- term outcome of hepatitis C infection after liver transplantation. New England Journal of Medicine. 1996;334(13):815-21.
- Reau N, Kwo PY, Rhee S, Brown RS, , Agarwal K, Angus P, et al. Glecaprevir/Pibrentasvir Treatment in Liver or Kidney Transplant Patients With Hepatitis C Virus Infection. Hepatology (Baltimore, Md). 2018;68(4):1298-307.
- Agarwal K, Castells L, Müllhaupt B, Rosenberg WM, McNabb B, Arterburn S, et al. Sofosbuvir/velpatasvir for 12 weeks in genotype 1-4 HCV-infected liver transplant recipients. Journal of hepatology.
- Poordad F, Schiff ER, Vierling JM, Landis C, Fontana RJ, Yang R, et al. Daclatasvir with sofosbuvir and ribavirin for hepatitis C virus infection with advanced cirrhosis or post-liver transplantation Hepatology (Baltimore, Md). 2016;63(5):1493-505.
- Liver EAfTSoT. EASL recommendations on treatment of hepatitis C 2018. Journal of 2018;69(2):461-511.
- Coca SG, Yusuf B, Shlipak MG, Garg AX, Parikh Long-term risk of mortality and other adverse outcomes after acute kidney injury: a systematic review and meta-analysis. American Journal of Kidney Diseases. 2009;53(6):961-73.
- Chen K, Lu P, Song R, Zhang J, Tao R, Wang Z, et al. Direct-acting antiviral agent efficacy and safety in renal transplant recipients with chronic hepatitis C virus infection: a PRISMA- compliant Medicine. 2017;96(30).
- Colombo M, Aghemo A, Liu H, Zhang J, Dvory-Sobol H, Hyland R, et al. Treatment with ledipasvir–sofosbuvir for 12 or 24 weeks in kidney transplant recipients with chronic hepatitis C virus genotype 1 or 4 infection: a randomized Annals of internal medicine. 2017;166(2):109-17.
- Reau NA-O, Kwo PY, Rhee S, Brown RS, , Agarwal KA-OX, Angus P, et al. Glecaprevir/Pibrentasvir Treatment in Liver or Kidney Transplant Patients With Hepatitis C Virus Infection. (1527-3350 (Electronic)).
- Duerr MA-OX, Schrezenmeier EV, Lehner LJ, Bergfeld L, Glander P, Marticorena Garcia SR, et al. A prospective study of daclatasvir and sofosbuvir in chronic HCV-infected kidney transplant (1471-2369 (Electronic)).
- Instituto de evaluación de tecnología en salud e investigación. Análisis de impacto Esquemas combinados de antivirales de acción directa para el tratamiento de infección crónica por el virus de hepatitis C. 2018.
- Liu CH, Sun HY, Liu CJ, Sheng WH, Hsieh SM, Lo YC, et al. Generic velpatasvir plus sofosbuvir for hepatitis C virus infection in patients with or without human immunodeficiency virus Alimentary pharmacology & therapeutics. 2018;47(12):1690-8.
- Wyles DL, Ruane PJ, Sulkowski MS, Dieterich D, Luetkemeyer A, Morgan TR, et al. Daclatasvir plus Sofosbuvir for HCV in Patients Coinfected with HIV-1. New England Journal of 2015;373(8):714-25.
- Osinusi A, Townsend K, Kohli A, Nelson A, Seamon C, Meissner EG, et al. Virologic response following combined ledipasvir and sofosbuvir administration in patients with HCV genotype 1 and HIV co-infection. 2015;313(12):1232-9.
- Milazzo L, Lai A, Calvi E, Ronzi P, Micheli V, Binda F, et al. Direct-acting antivirals in hepatitis C virus (HCV)-infected and HCV/HIV-coinfected patients: real-life safety and efficacy. HIV 2017;18(4):284-91.
- Wyles D, Brau N, Kottilil S, Daar ES, Ruane P, Workowski K, et Sofosbuvir and Velpatasvir for the Treatment of Hepatitis C Virus in Patients Coinfected With Human Immunodeficiency Virus Type 1: An Open-Label, Phase 3 Study. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2017;65(1):6-12.
- Rockstroh JK, Lacombe K, Viani RM, Orkin C, Wyles D, Luetkemeyer AF, et Efficacy and Safety of Glecaprevir/Pibrentasvir in Patients Coinfected With Hepatitis C Virus and Human Immunodeficiency Virus Type 1: The EXPEDITION-2 Study. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2018;67(7):1010-7.
- Rockstroh JK, Nelson M, Katlama C, Lalezari J, Mallolas J, Bloch M, et al. Efficacy and safety of grazoprevir (MK-5172) and elbasvir (MK-8742) in patients with hepatitis C virus and HIV co-infection (C-EDGE CO-INFECTION): a non-randomised, open-label trial. The lancet HIV. 2015;2(8):e319-27.
- Naggie S, Cooper C, Saag M, Workowski K, Ruane P, Towner WJ, et al. Ledipasvir and Sofosbuvir for HCV in Patients Coinfected with HIV-1. New England Journal of 2015;373(8):705-13.
- Sulkowski MS, Eron JJ, Wyles D, Trinh R, Lalezari J, Wang C, et Ombitasvir, paritaprevir co-dosed with ritonavir, dasabuvir, and ribavirin for hepatitis C in patients co-infected with HIV- 1: a randomized trial. (1538-3598 (Electronic)).
- Guidelines for the care and treatment of persons diagnosed with chronic hepatitis C virus World Health Organization. 2018.
- Clinical Practice Guidelines: European Association for the Study of the Liver. EASL Recommendations on treatment oh Hepatitis C Journal of 2018.
- The American Association for the study of liver diseases and the infectious diseases Society of America Present. HVC Guidance: Recommendations for testing, managing, and treatment Hepatitis C.
- Paul S Fau – Saxena A, Saxena A Fau – Terrin N, Terrin N Fau – Viveiros K, Viveiros K Fau – Balk EM, Balk Em Fau – Wong JB, Wong Hepatitis B Virus Reactivation and Prophylaxis During Solid Tumor Chemotherapy: A Systematic Review and Meta-analysis. (1539-3704 (Electronic)).
- Chen G, Wang C, Chen J, Ji D, Wang Y, Wu V, et Hepatitis B reactivation in hepatitis B and C coinfected patients treated with antiviral agents: a systematic review and meta‐analysis. Hepatology (Baltimore, Md). 2017;66(1):13-26.
- Balagopal A, Thio Editorial Commentary: Another Call to Cure Hepatitis B. (1537- 6591 (Electronic)).
- AASLD/IDSA HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis Clin Liver Dis (Hoboken). 2018;12(5):117-.
- Sagnelli EA-Ohoo, Sagnelli CA-Ohoo, Macera M, Pisaturo M, Coppola An update on the treatment options for HBV/HCV coinfection. (1744-7666 (Electronic)).
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com

