
GUÍA PRÁCTICA CLÍNICA: PARA EL DIAGNÓSTICO Y EL MANEJO DE LA INFECCIÓN POR HELICOBACTER PYLORI EN ENFERMEDADES GASTRODUODENALES (2020)
DESCARGAR
VERSIÓN
ARTÍCULO
DESCARGAR
VERSIÓN
EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN
CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: adultos con sospecha o diagnóstico de infección por H Pylori.
- Alcance: diagnóstico y manejo de pacientes con infección por H Pylori.
Autores
Expertos clínicos:
- Guillermo Otoya Moreno
- Harold Eduardo Benites Goñi
- César Alberto García Delgado
- Eduardo Alexis Ruiz Gárate
Metodólogos:
- Naysha Yamilet Becerra Chauca
- David Santiago García Gomero
- Lesly Karem Chávez Rimache
- Carolina Jaqueline Delgado Flores
- David Victorino Jumpa Armas
Coordinadores:
- Stefany Salvador Salvador
- Vladimir Ernesto Santos Sánchez
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
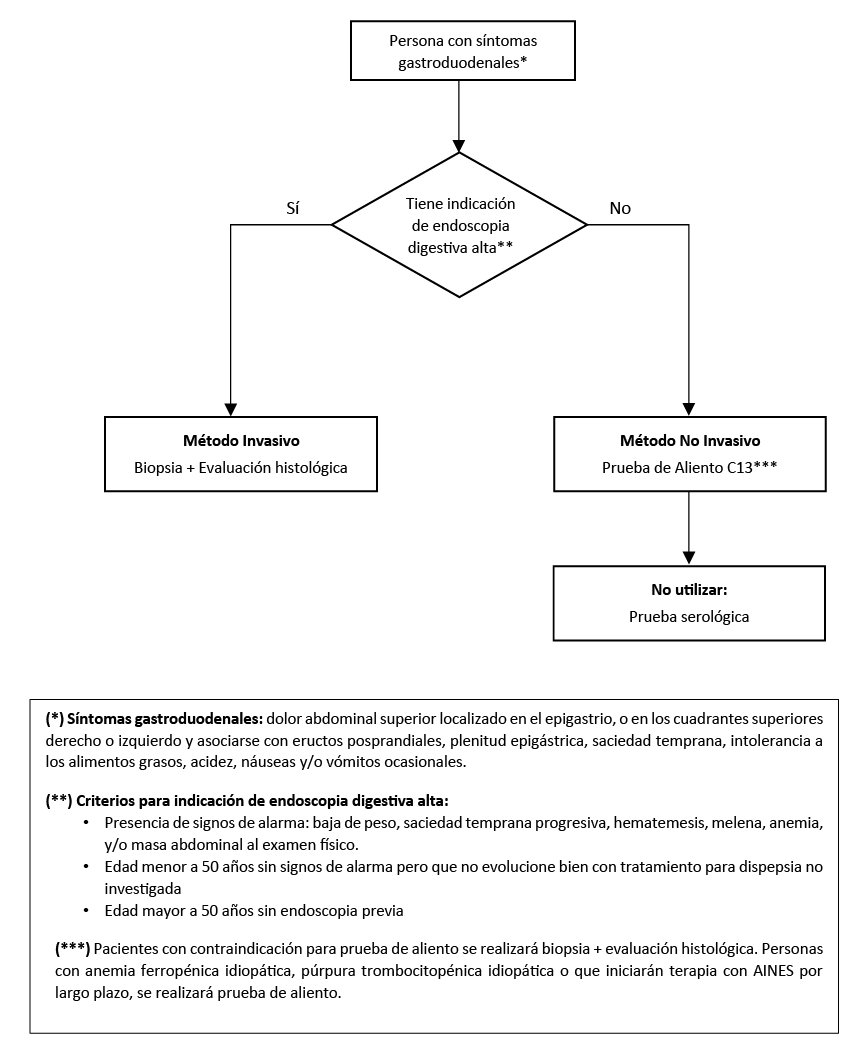
Flujograma 1. Flujograma para diagnóstico de infección por Helicobacter pylori
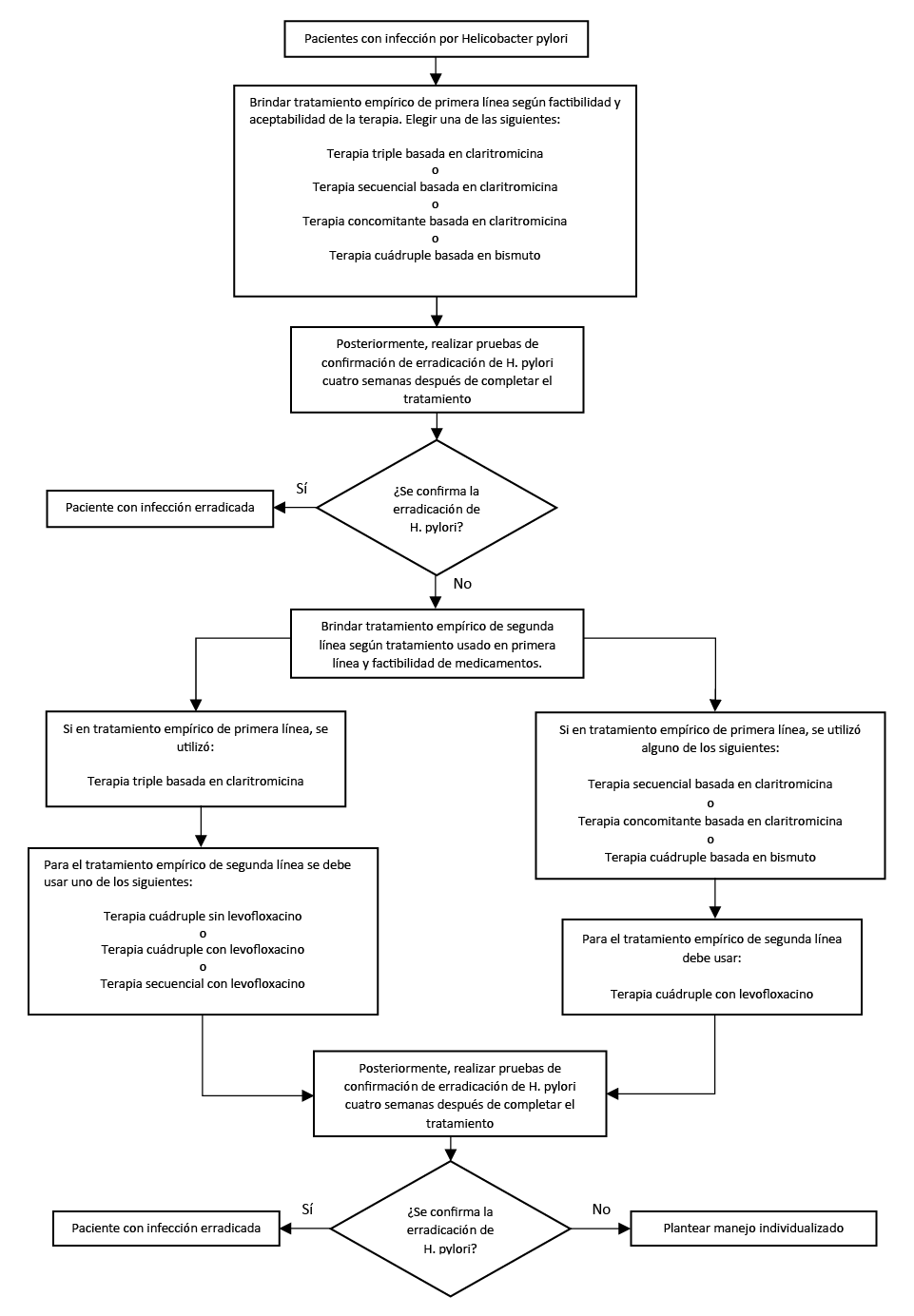
Flujograma 2. Flujograma para el manejo de infección por Helicobacter pylori
vacio
vacio
1. Diagnóstico
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En personas con síntomas gastroduodenales, sin indicación de endoscopia alta diagnóstica, recomendamos realizar la prueba de aliento C13 para el diagnóstico de infección por H. pylori (Recomendación fuerte a favor, certeza baja de la evidencia)
Recomendación 1:
En personas con síntomas gastroduodenales, sugerimos no realizar la prueba serológica para el diagnóstico de infección por H. pylori. (Recomendación condicional en contra, certeza muy baja de la evidencia)
BPC 1:
En adultos, se sospecha de infección por H. pylori cuando el paciente presenta: dolor abdominal superior localizado en el epigastrio, o en los cuadrantes superiores derecho o izquierdo asociado a eructos posprandiales, plenitud epigástrica, saciedad temprana, intolerancia a los alimentos grasos, acidez, náuseas y/o vómitos ocasionales.
BPC 2:
En personas con síntomas gastroduodenales, los criterios para indicación de endoscopía alta diagnóstica son:
- Presencia de signos de alarma: baja de peso, saciedad temprana progresiva, hematemesis, melena, anemia, y/o masa abdominal al examen físico.
- Edad menor a 40 años sin signos de alarma pero que no evolucione bien con tratamiento para dispepsia no investigada
- Edad mayor a 40 años sin endoscopia previa.
BPC 3:
En personas con indicación de prueba de aliento, considerar lo siguiente:
- Suspender el uso de inhibidores de bomba de protones (IBP) y bismuto dos semanas antes de la prueba diagnóstica.
- Suspender el uso de cualquier antibiótico, al menos cuatro semanas antes de la prueba diagnóstica.
BPC 4:
En personas con síntomas gastroduodenales y criterios para endoscopia alta diagnóstica, realizar biopsia y evaluación histológica en busca de H. pylori.
BPC 5:
En personas a las que se les realice biopsia para detección de H. pylori, se deberá extraer dos muestras del antro, dos del cuerpo y una en el ángulo.
BPC 6:
En personas con indicación de endoscopía digestiva alta y antecedente de gastrectomía parcial, realizar biopsia y evaluación histológica en busca de H. pylori.
BPC 7:
En personas sin síntomas gastrointestinales, pero con anemia idiopática, púrpura trombocitopénica idiopática, o que iniciarán terapia con antiinflamatorios no esteroideos (AINEs) por largo plazo, realizar prueba de aliento para detectar H. pylori.
BPC 8:
En personas con reflujo gastroesofágico sin otros síntomas gastroduodenales, no se investigará la presencia de H. pylori.
2. Tratamiento de erradicación en dispepsia
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En personas con dispepsia e infección por H. pylori, sugerimos dar tratamiento de erradicación de H. pylori. (Recomendación condicional a favor, certeza muy baja de la evidencia)
3. Tratamiento de erradicación en úlcera péptica
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En personas con úlcera péptica e infección por H. pylori, recomendamos dar tratamiento de erradicación de H. pylori. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
4. Tratamiento de erradicación en MALT
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En personas con linfoma MALT gástrico estadios I-II e infección por H. pylori, sugerimos dar tratamiento de erradicación para H. pylori. (Recomendación condicional a favor, certeza muy baja de la evidencia)
5. Esquema de tratamiento
Descargar PDF con el desarrollo de la pregunta.
En personas con infección por H. pylori, sugerimos optar por una de las siguientes terapias de primera línea, en base a la factibilidad y aceptabilidad de la terapia:
Recomendación 1:
Terapia triple basada en claritromicina de 10 a 14 días (Recomendación condicional a favor, certeza moderada de la evidencia)
Recomendación 2:
Terapia secuencial basada en claritromicina de 14 días (Recomendación condicional a favor, certeza moderada de la evidencia)
Recomendación 3:
Terapia concomitante basada en claritromicina de 10 a 14 días (Recomendación condicional a favor, certeza moderada de la evidencia)
Recomendación 4:
Terapia cuádruple basada en bismuto de 10 o 14 días (Recomendación condicional a favor, certeza moderada de la evidencia)
BCP 1:
Los esquemas de tratamiento de primera línea sugeridos en base a las terapias recomendadas son: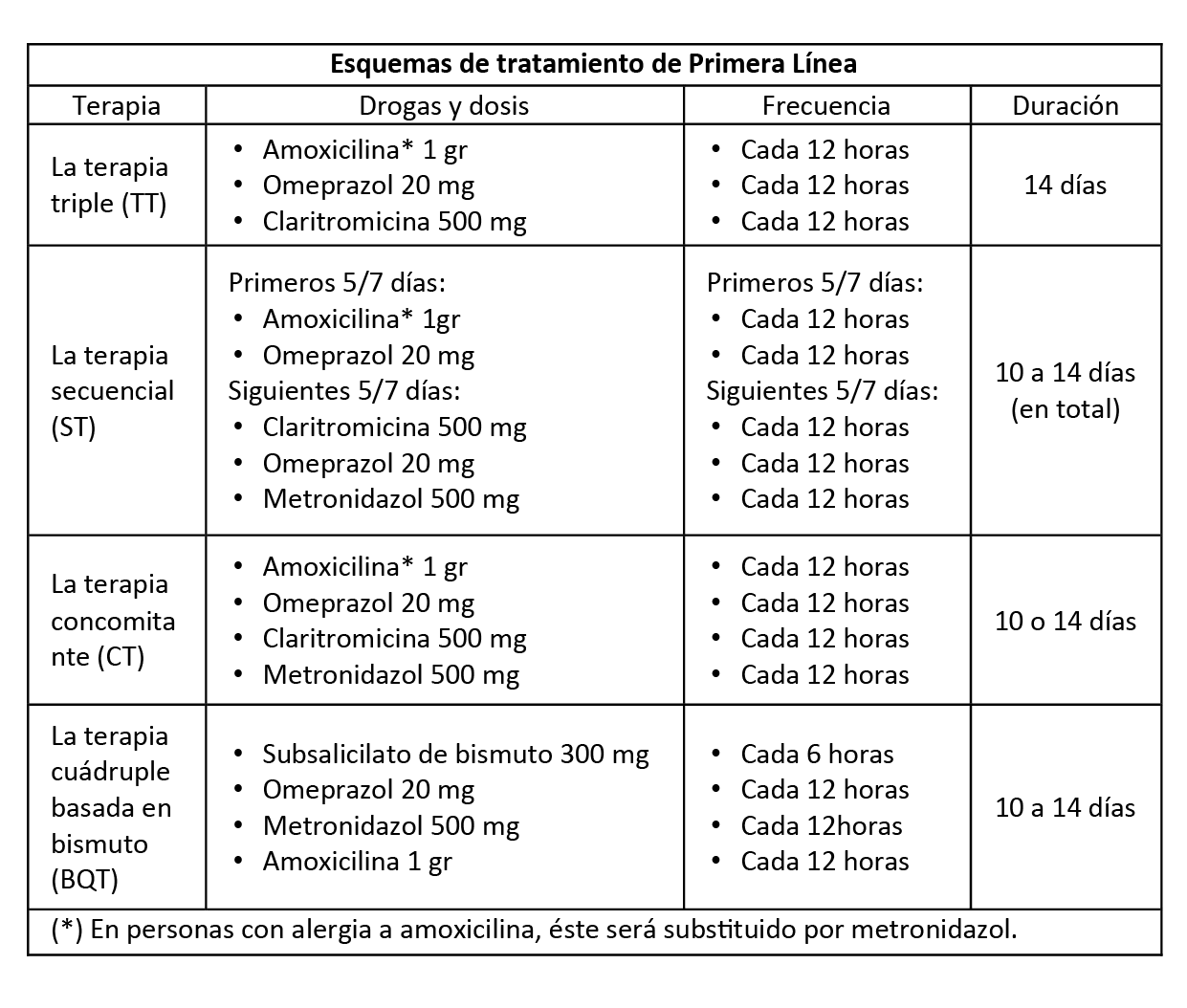 BCP 2:
BCP 2:
En personas con infección por H. pylori, se deberá tener en cuenta, la exposición previa a macrólidos y a nitroimidazoles del paciente para la elección de la terapia a administrar.
6. Tratamiento de segunda línea
Descargar PDF con el desarrollo de la pregunta.
En personas con infección por H. pylori que no respondieron al tratamiento de primera línea, sugerimos optar por una de las siguientes terapias de segunda línea, en base a terapia de primera línea utilizada y factibilidad de medicamentos:
Recomendación 1:
Terapia cuádruple sin levofloxacino de 10 o 14 días (Recomendación fuerte a favor, certeza alta de la evidencia)
Recomendación 2:
Terapia cuádruple con levofloxacino de 10 o 14 días (Recomendación fuerte a favor, certeza alta de la evidencia)
Recomendación 3:
Terapia secuencial con levofloxacino de 10 días (Recomendación fuerte a favor, certeza baja de la evidencia)
BCP 1:
Los esquemas de tratamiento de segunda línea sugeridos en base a las terapias recomendadas son:
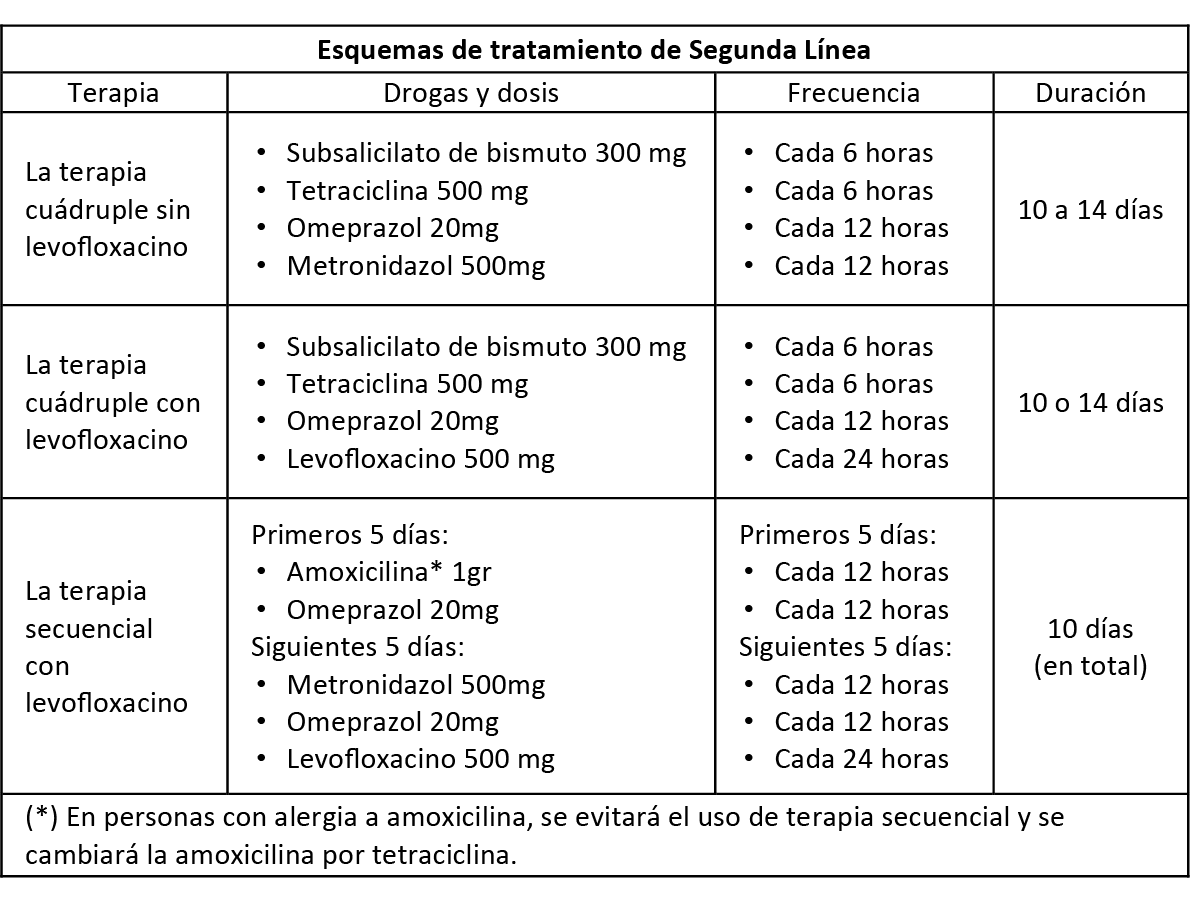
BCP 2:
En personas que necesiten terapia de segunda línea, evitar los antibióticos previamente usados en la terapia de primera línea, a excepción de la amoxicilina y tetraciclina. Si se administra terapia secuencial o concomitante como tratamiento de primera línea, se debería usar, como segunda línea, un tratamiento que incluya quinolona; mientras que, si se usa terapia triple como primera línea, se podría usar terapia con o sin levofloxacino.
BCP 3:
En personas con infección por H. pylori que no respondieron al tratamiento de segunda línea, se planteará manejo individualizado a criterio médico.
7. Confirmar erradicación
Descargar PDF con el desarrollo de la pregunta.
BCP 1:
En personas con infección por H. pylori que completaron el tratamiento de erradicación, se deberá demostrar la erradicación de la infección mediante la prueba de aliento con C13, al menos cuatro semanas después de completar el tratamiento. En los casos donde se necesite realizar endoscopia en las personas que completaron el tratamiento de erradicación, se podrá demostrar la erradicación de la infección mediante una biopsia más evaluación histológica, al menos cuatro semanas después de completar el tratamiento.
BCP 2:
En personas con infección por H. pylori que completaron el tratamiento de erradicación, no se deben realizar pruebas serológicas para confirmar la erradicación.
BCP 3:
En personas con erradicación de H. pylori confirmada, se realizará referencia al servicio de odontología para una evaluación periodontal.
BCP 4:
En personas con erradicación de H. pylori confirmada, se les informará sobre las medidas higiénicas básicas en la preparación e ingesta de alimentos para evitar reinfección.
Referencias bibliográficas
- Cave DR. Transmission and epidemiology of Helicobacter pylori. The American journal of medicine. 1996;100(5a):12S-7S; discussion 7S-8S.
- Pounder RE, Ng D. The prevalence of Helicobacter pylori infection in different countries. Alimentary pharmacology & therapeutics. 1995;9 Suppl 2:33-9.
- Goodwin CS, Worsley BW. Microbiology of Helicobacter pylori. Gastroenterology clinics of North America. 1993;22(1):5-19.
- Amieva MR, El-Omar EM. Host-bacterial interactions in Helicobacter pylori infection. Gastroenterology. 2008;134(1):306-23.
- Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC monographs on the evaluation of carcinogenic risks to humans. 1994;61:1-241.
- Diaconu S, Predescu A, Moldoveanu A, Pop CS, Fierbințeanu-Braticevici C. Helicobacter pylori infection: old and new. J Med Life. 2017;10(2):112-7.
- Joo M. Rare Gastric Lesions Associated with Helicobacter pylori Infection: A Histopathological Review. Journal of pathology and translational medicine. 2017;51(4):341-51.
- Castillo Contreras O, Maguiña Quispe J, Benites Goñi H, Chacaltana Mendoza A, Guzmán Calderón E, Dávalos Moscol M, et al. Prevalencia de Helicobacter pylori en pacientes sintomáticos de consulta externa de la Red Rebagliati (EsSalud), Lima, Perú, en el período 2010-2013. Revista de Gastroenterología del Perú. 2016;36(1):49-55.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Ministros PdCd. DS Nº 156-2020-PCM Decreto Supremo que modifica el Decreto Supremo N° 116-2020-PCM, Decreto supremo que establece las medidas que debe seguir la ciudadanía en la nueva convivencia social y prorroga el Estado de Emergencia Nacional por las graves circunstancias que afectan la vida de la Nación a consecuencia del COVID-19, modificado por los Decretos Supremos N° 129-2020-PCM, N° 135-2020-PCM, N° 139-2020-PCM, N° 146-2020-PCM y N° 151-2020-PCM. Lima: Presidencia del Consejo de Ministros; 2020.
- Best LM, Takwoingi Y, Siddique S, Selladurai A, Gandhi A, Low B, et al. Non‐invasive diagnostic tests for Helicobacter pylori infection. Cochrane Database of Systematic Reviews. 2018(3).
- Early DS, Ben-Menachem T, Decker GA, Evans JA, Fanelli RD, Fisher DA, et al. Appropriate use of GI endoscopy. Gastrointestinal endoscopy. 2012;75(6):1127-31.
- Hudak L, Jaraisy A, Haj S, Muhsen K. An updated systematic review and meta‐analysis on the association between H elicobacter pylori infection and iron deficiency anemia. Helicobacter. 2017;22(1):e12330.
- Kim BJ, Kim HS, Jang HJ, Kim JH. Helicobacter pylori eradication in idiopathic thrombocytopenic purpura: a meta-analysis of randomized trials. Gastroenterology research and practice. 2018;2018.
- Otero W, Trespalacios AA, Otero L, Vallejo MT, Amaya MT, Pardo R, et al. Guía de práctica clínica para el diagnóstico y tratamiento de la infección por Helicobacter pylori en adultos. Revista Colombiana de Gastroenterología. 2016;30(1):17-33.
- Ling D. Carbon-13 urea breath test for Helicobacter pylori infection in patients with uninvestigated ulcer-like dyspepsia: an evidence-based analysis. Ontario health technology assessment series. 2013;13(19):1.
- Ferwana M, Abdulmajeed I, Alhajiahmed A, Madani W, Firwana B, Hasan R, et al. Accuracy of urea breath test in Helicobacter pylori infection: meta-analysis. World journal of gastroenterology: WJG. 2015;21(4):1305.
- Mock T, Yatscoff R, Foster R, Hyun J-H, Chung I-S, Shim C-S, et al. Clinical validation of the Helikit™: a 13C urea breath test used for the diagnosis of Helicobacter Pylori infection. Clinical biochemistry. 1999;32(1):59-63.
- Talebi Bezmin Abadi A. Diagnosis of Helicobacter pylori using invasive and noninvasive approaches. Journal of pathogens. 2018;2018.
- Lee JY, Kim N. Diagnosis of Helicobacter pylori by invasive test: histology. Annals of translational medicine. 2015;3(1).
- National Institute for Health and Care Excellence. Dyspepsia and gastro-oesophageal reflux disease: investigation and management of dyspepsia, symptoms suggestive of gastro-oesophageal reflux disease, or both: National Institute for Health and Care Excellence; 2014.
- Uehara G, Nago A, Espinoza R, Vargas G, Astete M, Morán L, et al. Edad óptima para el despistaje endoscópico de cáncer gástrico en pacientes con dispepsia sin síntomas de alarma. Revista de Gastroenterología del Perú. 2007;27(4):339-48.
- Bravo LE, Realpe JL, Campo C, Mera R, Correa P. Effects of acid suppression and bismuth medications on the performance of diagnostic tests for Helicobacter pylori infection. The American journal of gastroenterology. 1999;94(9):2380-3.
- Laine L, Estrada R, Trujillo M, Knigge K, Fennerty MB. Effect of proton-pump inhibitor therapy on diagnostic testing for Helicobacter pylori. Annals of internal medicine. 1998;129(7):547-50.
- Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis: the updated Sydney system. The American journal of surgical pathology. 1996;20(10):1161-81.
- Genta RM, Graham DY. Comparison of biopsy sites for the histopathologic diagnosis of Helicobacter pylori: a topographic study of H. pylori density and distribution. Gastrointestinal endoscopy. 1994;40(3):342-5.
- Tian X-Y, Zhu H, Zhao J, She Q, Zhang G-X. Diagnostic performance of urea breath test, rapid urea test, and histology for Helicobacter pylori infection in patients with partial gastrectomy: a meta-analysis. Journal of clinical gastroenterology. 2012;46(4):285-92.
- Tang CL, Ye F, Liu W, Pan XL, Qian J, Zhang GX. Eradication of Helicobacter pylori Infection Reduces the Incidence of Peptic Ulcer Disease in Patients using Nonsteroidal Anti‐Inflammatory Drugs: A Meta‐Analysis. Helicobacter. 2012;17(4):286-96.
- Saad AM, Choudhary A, Bechtold ML. Effect of Helicobacter pylori treatment on gastroesophageal reflux disease (GERD): meta-analysis of randomized controlled trials. Scandinavian journal of gastroenterology. 2012;47(2):129-35.
- Zullo A, Hassan C, De Francesco V, Repici A, Manta R, Tomao S, et al. Helicobacter pylori and functional dyspepsia: an unsolved issue? World Journal of Gastroenterology: WJG. 2014;20(27):8957.
- Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG clinical guideline: treatment of Helicobacter pylori infection. American Journal of Gastroenterology. 2017;112(2):212-39.
- Du L-J, Chen B-R, Kim JJ, Kim S, Shen J-H, Dai N. Helicobacter pylori eradication therapy for functional dyspepsia: Systematic review and meta-analysis. World journal of gastroenterology. 2016;22(12):3486.
- Kang SJ, Park B, Shin CM. Helicobacter pylori eradication therapy for functional dyspepsia: A meta-analysis by region and H. pylori prevalence. Journal of clinical medicine. 2019;8(9):1324.
- Zhao B, Zhao J, Cheng W-F, Shi W-J, Liu W, Pan X-L, et al. Efficacy of Helicobacter pylori eradication therapy on functional dyspepsia: a meta-analysis of randomized controlled studies with 12-month follow-up. Journal of clinical gastroenterology. 2014;48(3):241-7.
- Nieto YB. Úlcera péptica. Medicine-Programa de Formación Médica Continuada Acreditado. 2012;11(3):137-41.
- Ford AC, Delaney B, Forman D, Moayyedi P. Eradication therapy for peptic ulcer disease in Helicobacter pylori positive patients. Cochrane Database of Systematic Reviews. 2006(2).
- Zullo A, Hassan C Fau – Ridola L, Ridola L Fau – De Francesco V, De Francesco V Fau – Rossi L, Rossi L Fau – Tomao S, Tomao S Fau – Vaira D, et al. Eradication therapy in Helicobacter pylori-negative, gastric low-grade mucosa-associated lymphoid tissue lymphoma patients: a systematic review. (1539-2031 (Electronic)).
- Crowe MD. Treatment regimens for Helicobacter pylori. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. https://www.uptodate.com (Accessed on September 30, 2020.).
- Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, et al. The Toronto Consensus for the Treatment of Helicobacter pylori Infection in Adults. Gastroenterology. 2016;151(1):51-69.e14.
- Li B-Z, Threapleton DE, Wang J-Y, Xu J-M, Yuan J-Q, Zhang C, et al. Comparative effectiveness and tolerance of treatments for Helicobacter pylori: systematic review and network meta-analysis. bmj. 2015;351.
- Guzmán J, Castillo D, Ojeda M, Sauvain M. Susceptibilidad antimicrobiana y mutaciones en el gen ARNr 23S de Helicobacter pylori en pacientes dispépticos. Revista peruana de medicina experimental y salud publica. 2019;36:270-4.
- Vasquez A, Valdez Y, Gilman RH, McDonald J, Westblom T, Berg D, et al. Metronidazole and clarithromycin resistance in Helicobacter pylori determined by measuring MICs of antimicrobial agents in color indicator egg yolk agar in a miniwell format. The Gastrointestinal Physiology Working Group of Universidad Peruana Cayetano Heredia and the Johns Hopkins University. Journal of clinical microbiology. 1996;34(5):1232-4.
- Yeo YH, Shiu S-I, Ho HJ, Zou B, Lin J-T, Wu M-S, et al. First-line Helicobacter pylori eradication therapies in countries with high and low clarithromycin resistance: a systematic review and network meta-analysis. Gut. 2018;67(1):20-7.
- Jung YS, Park CH, Park JH, Nam E, Lee HL. Efficacy of Helicobacter pylori eradication therapies in Korea: a systematic review and network meta‐analysis. Helicobacter. 2017;22(4):e12389.
- Xin Y, Manson J, Govan L, Harbour R, Bennison J, Watson E, et al. Pharmacological regimens for eradication of Helicobacter pylori: an overview of systematic reviews and network meta-analysis. BMC gastroenterology. 2016;16(1):80.
- Camargo MC, García A, Riquelme A, et al. The problem of Helicobacter pylori resistance to antibiotics: a systematic review in Latin America. Am J Gastroenterol. 2014;109(4):485-495. doi:10.1038/ajg.2014.24.
- Savoldi A, Carrara E, Graham DY, Conti M, Tacconelli E. Prevalence of antibiotic resistance in Helicobacter pylori: a systematic review and meta-analysis in World Health Organization regions. Gastroenterology. 2018;155(5):1372-82. e17.
- Pajares García J. M., Pajares-Villarroya R., Gisbert J. P.. Helicobacter pylori: resistencia a los antibióticos. Rev. esp. enferm. dig. [Internet]. 2007 Feb [citado 2020 Oct 01] ; 99( 2 ): 63-70. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1130-01082007000200001&lng=es.
- De Francesco V, Margiotta M, Zullo A, Hassan C, Troiani L, Burattini O, et al. Clarithromycin-resistant genotypes and eradication of Helicobacter pylori. Annals of internal medicine. 2006;144(2):94-100.
- Suzuki T, Matsuo K, Sawaki A, Ito H, Hirose K, Wakai K, et al. Systematic review and meta‐analysis: importance of CagA status for successful eradication of Helicobacter pylori infection. Alimentary pharmacology & therapeutics. 2006;24(2):273-80.
- van Der Hulst RW, Keller JJ, Rauws EA, Tytgat GN. Treatment of Helicobacter pylori infection: a review of the world literature. Helicobacter. 1996;1(1):6-19.
- Mochizuki Tamayo H, Noriega Aldave AP. Determinación de la susceptibilidad de cepas de Helicobacter pylori a Levofloxacino en formato pequeño y método de difusión en disco usando Agar yema de huevo. Revista de Gastroenterología del Perú. 2011;31(3):224-9.
- Revoredo F, Huamán EH, Zegarra S, Auris H, Valderrama R. Perfil microbiológico de las infecciones intra abdominales en el Servicio de Cirugía de Emergencia del Hospital Nacional Guillermo Almenara Irigoyen, Lima, Perú. Revista de Gastroenterología del Perú. 2016;36(2):115-22.
- Yeo YH, Hsu CC, Lee CC, Ho HJ, Lin JT, Wu MS, et al. Systematic review and network meta-analysis: Comparative effectiveness of therapies for second-line Helicobacter pylori eradication. Journal of gastroenterology and hepatology. 2019;34(1):59-67.
- Di Caro S, Fini L, Daoud Y, Grizzi F, Gasbarrini A, De Lorenzo A, et al. Levofloxacin/amoxicillin-based schemes vs quadruple therapy for Helicobacter pylori eradication in second-line. World J Gastroenterol. 2012;18(40):5669-78.
- Li Y, Huang X, Yao L, Shi R, Zhang G. Advantages of Moxifloxacin and Levofloxacin-based triple therapy for second-line treatments of persistent Helicobacter pylori infection: a meta analysis. Wiener klinische Wochenschrift. 2010;122(13-14):413-22.
- Liu X, Wang H, Lv Z, Wang Y, Wang B, Xie Y, et al. Rescue Therapy with a Proton Pump Inhibitor Plus Amoxicillin and Rifabutin for Helicobacter pylori Infection: A Systematic Review and Meta-Analysis. Gastroenterol Res Pract. 2015;2015:415648.
- Marin AC, McNicholl AG, Gisbert JP. A review of rescue regimens after clarithromycin-containing triple therapy failure (for Helicobacter pylori eradication). Expert opinion on pharmacotherapy. 2013;14(7):843-61.
- Muñoz N, Sánchez-Delgado J, Baylina M, Puig I, López-Góngora S, Suarez D, et al. Systematic review, meta-analysis, and meta-regression: Successful second-line treatment for Helicobacter pylori. Helicobacter. 2018;23(3):e12488.
- Wu C, Chen X, Liu J, Li MY, Zhang ZQ, Wang ZQ. Moxifloxacin-containing triple therapy versus bismuth-containing quadruple therapy for second-line treatment of Helicobacter pylori infection: a meta-analysis. Helicobacter. 2011;16(2):131-8.
- Boehnke KF, Valdivieso M, Bussalleu A, Sexton R, Thompson KC, Osorio S, et al. Antibiotic resistance among Helicobacter pylori clinical isolates in Lima, Peru. Infection and drug resistance. 2017;10:85-90.
- Fernández HP-P, G. Campylobacter: fluoroquinolone resistance in Latin-American countries. Arch Med Vet. 2016;48:255-9.
- Palma N, Pons MJ, Gomes C, Mateu J, Riveros M, García W, et al. Resistance to quinolones, cephalosporins and macrolides in Escherichia coli causing bacteraemia in Peruvian children. Journal of global antimicrobial resistance. 2017;11:28-33.
- Pons MJ, Mosquito S, Ochoa TJ, Vargas M, Molina M, Lluque A, et al. [Levels of quinolones resistance and other antimicrobial in non-pathogenic Escherichia coli strains in children from the periurban area of Lima, Peru]. Revista peruana de medicina experimental y salud publica. 2012;29(1):82-6.
- Quino W, Hurtado CV, Escalante-Maldonado O, Flores-León D, Mestanza O, Vences-Rosales F, et al. [Multidrug resistance of Salmonella infantis in Peru: a study through next generation sequencing]. Revista peruana de medicina experimental y salud publica. 2019;36(1):37-45.
- Hunt RX, S; Megraud, F; Leon-Barua, R; Bazzoli, F; van der Merwe, S; Vaz Coelho, L; Fock, M; Fedail, S; Cohen, H; Malfertheiner, P; Vakil N; Hamid, S; Goh, K; Wong, B; Krabshuis, J; Le Mair, A. Helicobacter pylori en los países en desarrollo: Organización Mundial de Gastroenterología; 2010.
- Shiota S, Reddy R, Alsarraj A, El-Serag HB, Graham DY. Antibiotic Resistance of Helicobacter pylori Among Male United States Veterans. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2015;13(9):1616-24.
- Kayali SM, Marco; Gaiani, Federica; Bianchi, Laura; Bizzarri, Barbara; Leandro, Gioacchino; di Mario, Francesco; de’Angelis, Gian Luigi. Helicobacter pylori, transmission routes and recurrence of infection: state of the art. Acta Biomed. 2018;89(8):72-6.
- Navabi N, Aramon M, Mirzazadeh A. Does the presence of the Helicobacter pylori in the dental plaque associate with its gastric infection? A meta-analysis and systematic review. Dent Res J (Isfahan). 2011;8(4):178-82.
- Bürgers R, Schneider-Brachert W, Reischl U, Behr A, Hiller KA, Lehn N, et al. Helicobacter pylori in human oral cavity and stomach. European journal of oral sciences. 2008;116(4):297-304.
- Ren Q, Yan X, Zhou Y, Li WX. Periodontal therapy as adjunctive treatment for gastric Helicobacter pylori infection. The Cochrane database of systematic reviews. 2016;2:Cd009477.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com

