DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: Pacientes con infección del tracto urinario baja o alta no complicada.
- Alcance: Manejo de infección del tracto urinario no complicada.
Autores
Expertos clínicos:
- Ulises Ortega Estacio
- José Luis Elescano Rojas
- Doris Karin Acuña Cervantes
- César Cruzalegui Gómez
- Martín Gómez Luján
- Alberto Ríos Palomino
Metodólogos:
- Claudia Patricia Matos Miranda
- César Augusto Ugarte Gil
Coordinador:
- Raúl Alonso Timaná Ruiz
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
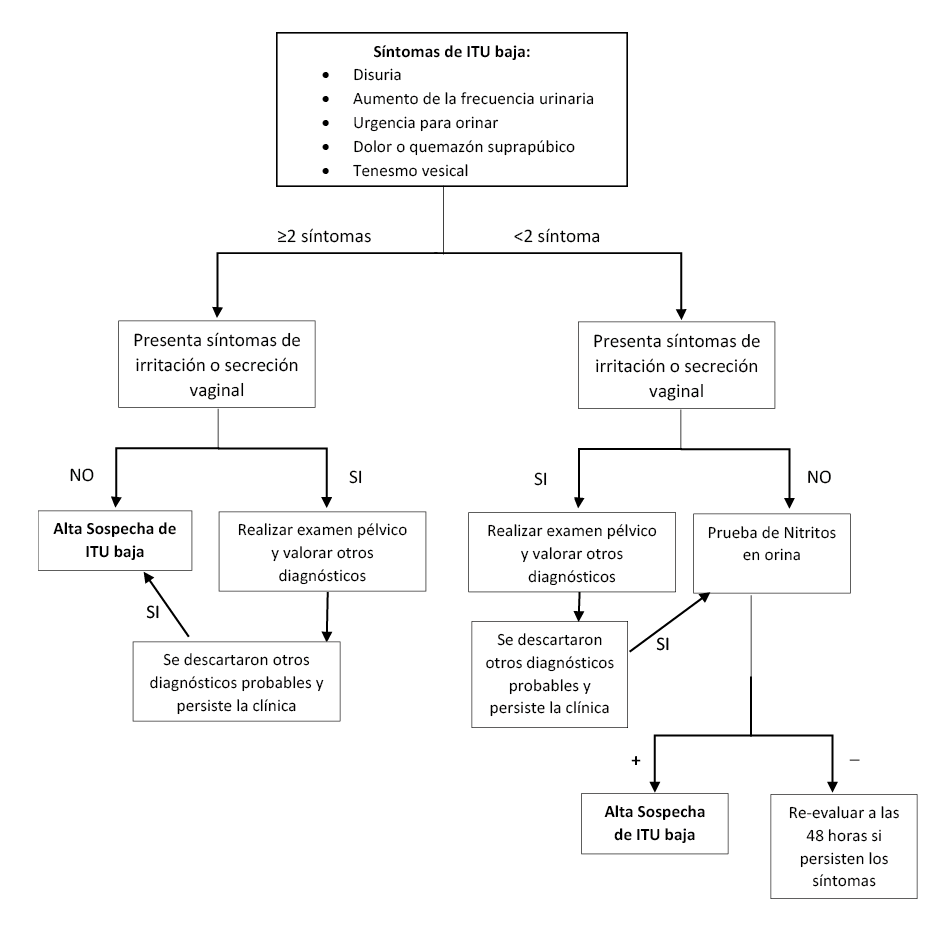
Diagnóstico de ITU baja
Manejo de ITU baja no complicada
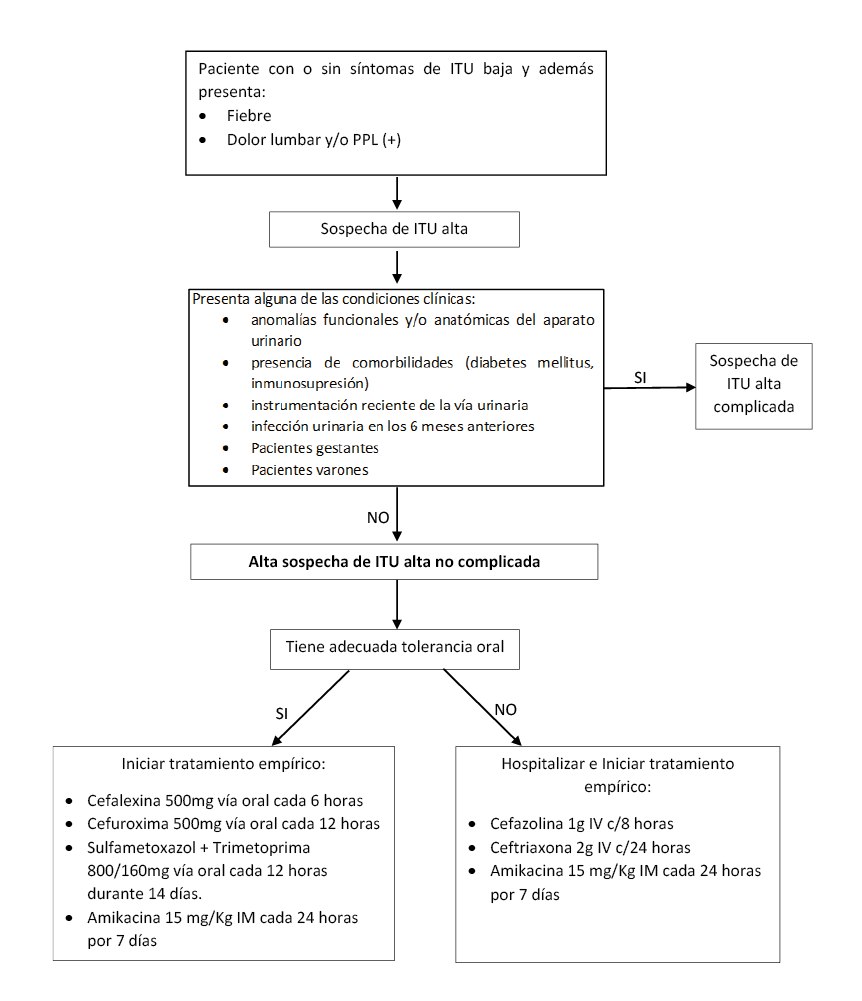

Diagnóstico y Manejo de ITU alta no complicada

vacio
vacio
1. Evaluación inicial
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres adultas que presenten 2 ó más síntomas de ITU baja (disuria, aumento de la frecuencia al urinaria, urgencia para orinar, dolor o quemazón suprapúbico y tenesmo vesical) y no presentan prurito o flujo vaginal, se considerará como una alta sospecha de ITU baja; pero si presentan prurito o flujo vaginal, realizar examen pélvico y valorar otros diagnósticos. (Recomendación débil a favor, certeza muy baja de la evidencia)
Recomendación 2:
En mujeres adultas que presenten < 2 síntomas de ITU baja y sin presencia de prurito o flujo vaginal, realizar un test de nitrito en orina y si este es positivo, se considerará como una alta sospecha de ITU baja; pero si presentan prurito o flujo vaginal, realizar examen pélvico y valorar otros diagnósticos; si persiste la sospecha clínica se realizará un test de nitrito en orina y si este es positivo, se considerará como una alta sospecha de ITU baja. (Recomendación débil a favor, certeza muy baja de la evidencia)
BPC 1:
En mujeres adultas que tengan < 2 síntomas de ITU baja y test de nitrito negativo; se re-evaluará a la paciente luego de 48 horas si persisten los síntomas.
BPC 2:
Considerar la posibilidad de ITU alta en pacientes que presenten síntomas tales como: fiebre o dolor lumbar; ya sea que presenten o no los síntomas de ITU baja.
BPC 3:
En mujeres con alta sospecha ITU se sugiere realizar cultivos de orina en las siguientes condiciones:
- Paciente con sospecha de ITU alta
- Pacientes cuyos síntomas se repiten o no se resuelven después de la finalización del tratamiento empírico
- Que tenga síntomas de ITU y que tengan el antecedente de al menos un episodio previo de ITU no complicada en el último año
- Que hayan recibido tratamiento antibiótico en los últimos 3 meses por cualquier causa.
2. Antibióticos para ITU baja
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con alta sospecha de ITU baja no complicada, se recomienda iniciar nitrofurantoína 100mg vía oral cada 6 horas por 5 – 7 días como tratamiento de primera línea. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
En pacientes que sean alérgicos a nitrofurantoína o no la toleren por los efectos adversos, se debería administrar:
- Sulfametoxazol + Trimetoprima 800/160mg vía oral cada 12 horas durante 5 días
- Cefalexina 500 mg vía oral cada 8 horas por 5 días
- Amoxicilina 500 mg cada 8 horas por 5 días
BPC 2:
En pacientes con ITU baja que no toleren o sean alérgicos a nitrofurantoína y tengan además una alta probabilidad de ITU baja por bacteria BLEE (uso reciente de antibióticos en los últimos 3 meses, hospitalización previa en los últimos 3 meses, personal de salud, presencia de catéter urinario), considerar administrar fosfomicina 3 gramos por vía oral una sola dosis.
BPC 3:
Pacientes con ITU baja, en el cual los síntomas no se resuelvan luego de 48 horas, se debe solicitar urocultivo.
3. Antibióticos para ITU alta
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con ITU alta no complicada se recomienda iniciar el tratamiento antibiótico empírico en base al perfil de sensibilidad antimicrobiana local de la institución. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
Recomendación 2:
En centros que no dispongan información del perfil de sensibilidad, las pacientes con sospecha de ITU alta no complicada y que tengan una adecuada tolerancia oral, se sugiere iniciar tratamiento antibiótico empírico ambulatorio con alguna de las siguientes opciones:
- Cefalexina 500 mg vía oral cada 6 horas por 7 días
- Cefuroxima 500mg vía oral cada 12 horas por 7 días
- Sulfametoxazol + Trimetoprima 800/160mg vía oral cada 12 horas durante 14 días.
- Amikacina 15 mg/kg IM cada 24horas por 7 días (dosis máxima 1.5 gr por día.
(Recomendación débil a favor, certeza muy baja de la evidencia)
Recomendación 3:
En centros que no dispongan información del perfil de sensibilidad, las pacientes con alta sospecha de ITU alta no complicada que tengan indicación de hospitalización, se sugiere iniciar tratamiento antibiótico empírico con alguna de las siguientes opciones:
- Cefazolina 1g IV cada 8 horas
- Ceftriaxona 2g IV cada 24 horas
- Amikacina 15 mg/kg IM cada 24horas por 7 días (dosis máxima 1.5 gr por día)
(Recomendación débil a favor, certeza muy baja de la evidencia)
Recomendación 4:
En pacientes con ITU alta no complicada se recomienda no administrar fluoroquinolonas como tratamiento empírico ambulatorio, sólo usarlas cuando el germen causante sea sensible a este antibiótico. (Recomendación fuerte en contra, certeza muy baja de la evidencia)
BPC 1:
En pacientes con ITU alta no complicada, el tratamiento empírico deberá ser evaluado luego de 72 horas y/o con el resultado del urocultivo, con el objetivo de mantener o cambiar el tratamiento antibiótico según el resultado de sensibilidad del agente microbiano.
BPC 2:
En pacientes con TFG < 50ml/kg/m2, la dosis de los antibióticos deberá ajustarse según sea el caso.
4. Hospitalización en ITU alta
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
Las pacientes con ITU alta no complicada serán hospitalizadas si presentan alguna de las siguientes condiciones clínicas:
- Si no hay mejoría clínica luego de 72 horas después del inicio del antibiótico empírico.
- Cuando la paciente presente sospecha de sepsis (sospecha de infección más un score de qSOFA ³ 2 ó SIRS ³ 2).
- Cuando exista intolerancia oral.
5. Prevención de recurrencia
Descargar PDF con el desarrollo de la pregunta.
BCP 1:
En todas las pacientes que sean tratadas por ITU no complicada, se deben explicar los factores de riesgo de recurrencia a fin de evitarla. Estos factores son: no tomar suficiente agua, higiene íntima excesiva y contenerse las ganas de orinar.
BCP 2:
Si se presenta recurrencia de ITU, se debe hacer una anamnesis a profundidad y exámenes auxiliares pertinentes, con el objetivo de identificar la causa y evitar otra recurrencia.
6: En pacientes que han sido tratadas por una ITU no complicada, ¿cuáles serían las medidas de seguimiento clínico?
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En pacientes que han terminado el tratamiento antibiótico y se encuentran asintomáticas, no solicitar examen o cultivo de orina.
BPC 2:
En pacientes con ITU no complicada cuyos síntomas no mejoren en 3 días, o en aquellas pacientes que resuelven sus síntomas, pero que reaparecen en 2 semanas; se deben realizar cultivos de orina con pruebas de sensibilidad antimicrobiana y exámenes auxiliares adicionales según criterio clínico.
BPC 3:
Las pacientes con ITU alta que fueron hospitalizadas, deben ser reevaluadas luego de 48 a 72 horas posterior al alta hospitalaria.
BPC 4:
Los mapas microbiológicos de cada IPRESS deberán ser difundidos de forma periódica y actualizada, por el servicio de Microbiología o quien cumpla su función en el establecimiento; y deben ser discutidos con el personal encargado del uso racional de antibióticos.
Referencias bibliográficas
- Nicolle LE. Uncomplicated urinary tract infection in adults including uncomplicated pyelonephritis. The Urologic clinics of North America. 2008;35(1):1-12, v.
- Patton JP, Nash DB, Abrutyn E. Urinary tract infection: economic considerations. The Medical clinics of North America. 1991;75(2):495-513.
- Gonzales Camarena DE, Solórzano J, Fortunato J, Egoávil T, Zoraida E, Samalvides Cuba F. Sensibilidad antibiótica de bacterias causantes de infecciones del tracto urinario en un hospital general: Enero-junio del año 2008. Revista Medica Herediana. 2009;20(1):11-5.
- Wagenlehner FM, Weidner W, Naber KG. An update on uncomplicated urinary tract infections in women. Current opinion in urology. 2009;19(4):368-74.
- Kang CI, Kim J, Park DW, Kim BN, Ha US, Lee SJ, et al. Clinical Practice Guidelines for the Antibiotic Treatment of Community-Acquired Urinary Tract Infections. Infection & chemotherapy. 2018;50(1):67-100.
- Warren JW, Abrutyn E, Hebel JR, Johnson JR, Schaeffer AJ, Stamm WE. Guidelines for antimicrobial treatment of uncomplicated acute bacterial cystitis and acute pyelonephritis in women. Infectious Diseases Society of America (IDSA). Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 1999;29(4):745-58.
- Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Disease-a-month : DM. 2003;49(2):53-70.
- Updated risk assessment on the spread of New Delhi metallo-β- lactamase and its variants within Europe. ECDC Web site. 2011.
- Bjerklund Johansen TE, Cek M, Naber K, Stratchounski L, Svendsen MV, Tenke P. Prevalence of Hospital-Acquired Urinary Tract Infections in Urology Departments. European Urology. 2007;51(4):1100-12.
- Zweigner J, Meyer E, Gastmeier P, Schwab F. Rate of antibiotic prescriptions in German outpatient care – are the guidelines followed or are they still exceeded? GMS hygiene and infection control. 2018;13:Doc04.
- Lindback H, Lindback J, Melhus A. Inadequate adherence to Swedish guidelines for uncomplicated lower urinary tract infections among adults in general practice. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica. 2017;125(9):816-21.
- Zatorski C, Zocchi M, Cosgrove SE, Rand C, Brooks G, May L. A single center observational study on emergency department clinician non-adherence to clinical practice guidelines for treatment of uncomplicated urinary tract infections. BMC infectious diseases. 2016;16(1):638.
- Gupta K, Hooton TM, Naber KG, Wullt B, Colgan R, Miller LG, et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. Clinical infectious diseases. 2011;52(5):e103-e20.
- SIGN. SIGN 88 • Management of suspected bacterial urinary tract infection in adults. Edinburgh: Scottish Intercollegiate Guidelines Network; 2012.
- CENETEC. Diagnóstico y tratamiento de la pielonefritis aguda no complicada en el adulto Mexico2014 [Available from: http://www.cenetec-difusion.com/CMGPC/SS-185-10/ER.pdf.
- Prieto L, Esteban M, Salinas J, Adot JM, Arlandis S, Peri L, et al. Consensus document of the Spanish Urological Association on the management of uncomplicated recurrent urinary tract infections. Actas Urológicas Españolas (English Edition). 2015;39(6):339-48.
- Cortés JA, Perdomo D, Morales RA, Álvarez CA, Cuervo SI, Leal AL, et al. Guía de práctica clínica sobre diagnóstico y tratamiento de infección de vías urinarias no complicada en mujeres adquirida en la comunidad. Revista de la Facultad de Medicina. 2015;63(4):565.
- Choe HS, Lee SJ, Yang SS, Hamasuna R, Yamamoto S, Cho YH, et al. Summary of the UAA‐AAUS guidelines for urinary tract infections. International Journal of Urology. 2017.
- de Cueto M, Aliaga L, Alos JI, Canut A, Los-Arcos I, Martinez JA, et al. Executive summary of the diagnosis and treatment of urinary tract infection: Guidelines of the Spanish Society of Clinical Microbiology and Infectious Diseases (SEIMC). Enfermedades infecciosas y microbiologia clinica. 2017;35(5):314-20.
- Kranz J, Schmidt S, Lebert C, Schneidewind L, Mandraka F, Kunze M, et al. The 2017 Update of the German Clinical Guideline on Epidemiology, Diagnostics, Therapy, Prevention, and Management of Uncomplicated Urinary Tract Infections in Adult Patients. Part II: Therapy and Prevention. Urologia internationalis. 2018;100(3):271-8.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Schmiemann G, Kniehl E, Gebhardt K, Matejczyk MM, Hummers-Pradier E. The diagnosis of urinary tract infection: a systematic review. Deutsches Arzteblatt international. 2010;107(21):361-7.
- Bent S, Nallamothu BK, Simel DL, Fihn SD, Saint S. Does this woman have an acute uncomplicated urinary tract infection? Jama. 2002;287(20):2701-10.
- Giesen LG, Cousins G, Dimitrov BD, van de Laar FA, Fahey T. Predicting acute uncomplicated urinary tract infection in women: a systematic review of the diagnostic accuracy of symptoms and signs. BMC family practice. 2010;11:78.
- Meister L, Morley EJ, Scheer D, Sinert R. History and physical examination plus laboratory testing for the diagnosis of adult female urinary tract infection. Academic emergency medicine : official journal of the Society for Academic Emergency Medicine. 2013;20(7):631-45.
- Little P, Turner S, Rumsby K, Warner G, Moore M, Lowes JA, et al. Dipsticks and diagnostic algorithms in urinary tract infection: development and validation, randomised trial, economic analysis, observational cohort and qualitative study. Health technology assessment (Winchester, England). 2009;13(19):iii-iv, ix-xi, 1-73.
- Bosmans JE, Coupe VMH, Knottnerus BJ, Geerlings SE, Moll van Charante EP, Ter Riet G. Cost-effectiveness of different strategies for diagnosis of uncomplicated urinary tract infections in women presenting in primary care. PloS one. 2017;12(11):e0188818.
- Hullegie S, Wootton M, Verheij TJM, Thomas-Jones E, Bates J, Hood K, et al. Clinicians’ interpretations of point of care urine culture versus laboratory culture results: analysis from the four-country POETIC trial of diagnosis of uncomplicated urinary tract infection in primary care. Family practice. 2017;34(4):392-9.
- Lopez Vargas JA, Cuartas Trujillo MC, Molina Upegui OL, Restrepo Ceballos AC, Maya Carmona CY, Jaramillo Velásquez S, et al. Utilidad del citoquímico y la coloración de Gram en muestras de orina en el diagnóstico de las infecciones del tracto urinario en pacientes hospitalizados. Iatreia. 2005;18(4):377-84.
- Stamm WE, Counts GW, Running KR, Fihn S, Turck M, Holmes KK. Diagnosis of coliform infection in acutely dysuric women. The New England journal of medicine. 1982;307(8):463-8.
- Borderon E, Tescher M, Du Rouchet E, Lemaire B, Desroche A, Megier P. [Urinary tract infection in gynecology-obstetrics: resistance to beta-lactam antibiotics and previous antibiotic therapy]. Pathologie-biologie. 1990;38(5 ( Pt 2)):538-42.
- Tenney J, Hudson N, Alnifaidy H, Li JTC, Fung KH. Risk factors for aquiring multidrug-resistant organisms in urinary tract infections: A systematic literature review. Saudi pharmaceutical journal : SPJ : the official publication of the Saudi Pharmaceutical Society. 2018;26(5):678-84.
- Bergman M, Huikko S, Huovinen P, Paakkari P, Seppala H. Macrolide and azithromycin use are linked to increased macrolide resistance in Streptococcus pneumoniae. Antimicrobial agents and chemotherapy. 2006;50(11):3646-50.
- Neuman MI, Kelley M, Harper MB, File TM, Jr., Camargo CA, Jr. Factors associated with antimicrobial resistance and mortality in pneumococcal bacteremia. The Journal of emergency medicine. 2007;32(4):349-57.
- Matzneller P, Krasniqi S, Kinzig M, Sorgel F, Huttner S, Lackner E, et al. Blood, tissue, and intracellular concentrations of azithromycin during and after end of therapy. Antimicrobial agents and chemotherapy. 2013;57(4):1736-42.
- Kuster SP, Rudnick W, Shigayeva A, Green K, Baqi M, Gold WL, et al. Previous antibiotic exposure and antimicrobial resistance in invasive pneumococcal disease: results from prospective surveillance. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2014;59(7):944-52.
- Zalmanovici Trestioreanu A, Green H, Paul M, Yaphe J, Leibovici L. Antimicrobial agents for treating uncomplicated urinary tract infection in women. The Cochrane database of systematic reviews. 2010(10):Cd007182.
- Huttner A, Verhaegh EM, Harbarth S, Muller AE, Theuretzbacher U, Mouton JW. Nitrofurantoin revisited: a systematic review and meta-analysis of controlled trials. The Journal of antimicrobial chemotherapy. 2015;70(9):2456-64.
- Ceran N, Mert D, Kocdogan FY, Erdem I, Adalati R, Ozyurek S, et al. A randomized comparative study of single-dose fosfomycin and 5-day ciprofloxacin in female patients with uncomplicated lower urinary tract infections. Journal of infection and chemotherapy : official journal of the Japan Society of Chemotherapy. 2010;16(6):424-30.
- Palou J, Angulo JC, Ramon de Fata F, Garcia-Tello A, Gonzalez-Enguita C, Boada A, et al. [Randomized comparative study for the assessment of a new therapeutic schedule of fosfomycin trometamol in postmenopausal women with uncomplicated lower urinary tract infection]. Actas urologicas espanolas. 2013;37(3):147-55.
- de Jong Z, Pontonnier F, Plante P. Single-dose fosfomycin trometamol (Monuril) versus multiple-dose norfloxacin: results of a multicenter study in females with uncomplicated lower urinary tract infections. Urologia internationalis. 1991;46(4):344-8.
- Elhanan G, Tabenkin H, Yahalom R, Raz R. Single-dose fosfomycin trometamol versus 5-day cephalexin regimen for treatment of uncomplicated lower urinary tract infections in women. Antimicrobial agents and chemotherapy. 1994;38(11):2612-4.
- Minassian MA, Lewis DA, Chattopadhyay D, Bovill B, Duckworth GJ, Williams JD. A comparison between single-dose fosfomycin trometamol (Monuril) and a 5-day course of trimethoprim in the treatment of uncomplicated lower urinary tract infection in women. International journal of antimicrobial agents. 1998;10(1):39-47.
- Hooton TM, Roberts PL, Stapleton AE. Cefpodoxime vs ciprofloxacin for short-course treatment of acute uncomplicated cystitis: a randomized trial. Jama. 2012;307(6):583-9.
- Menday AP. Comparison of pivmecillinam and cephalexin in acute uncomplicated urinary tract infection. International journal of antimicrobial agents. 2000;13(3):183-7.
- Meier S, Weber R, Zbinden R, Ruef C, Hasse B. Extended-spectrum beta-lactamase-producing Gram-negative pathogens in community-acquired urinary tract infections: an increasing challenge for antimicrobial therapy. Infection. 2011;39(4):333-40.
- Fasugba O, Gardner A, Mitchell BG, Mnatzaganian G. Ciprofloxacin resistance in community- and hospital-acquired Escherichia coli urinary tract infections: a systematic review and meta-analysis of observational studies. BMC infectious diseases. 2015;15:545.
- Montañez-Valverde RA, Montenegro-Idrogo JJ, Arenas-Significación FR, Vásquez-Alva R, editors. Infección urinaria alta comunitaria por E. coli resistente a ciprofloxacino: características asociadas en pacientes de un hospital nacional en Perú. Anales de la Facultad de Medicina; 2015: UNMSM. Facultad de Medicina.
- Galván F, Agapito J, Bravo N, Lagos J, Tamariz J. Caracterización fenotípica y molecular de Escherichia coli productoras de β-Lactamasas de espectro extendido en pacientes ambulatorios de Lima, Perú. Revista Medica Herediana. 2016;27(1):22-9.
- Castillo-Tokumori F, Irey-Salgado C, Malaga G. Worrisome high frequency of extended-spectrum beta-lactamase-producing Escherichia coli in community-acquired urinary tract infections: a case-control study. International journal of infectious diseases : IJID : official publication of the International Society for Infectious Diseases. 2017;55:16-9.
- Yábar MN, Curi-Pesantes B, Torres CA, Calderón-Anyosa R, Riveros M, Ochoa TJ. Multirresistencia y factores asociados a la presencia de betalactamasas de espectro extendido en cepas de Escherichia coli provenientes de urocultivos. Revista Peruana de Medicina Experimental y Salud Pública. 2017;34(4):660-5.
- Astete La Madrid S, Flores Fukuda F, Buckley De Meritens A, Villarreal Menchola J. Sensibilidad antibiótica de los gérmenes causantes de infecciones urinarias en pacientes ambulatorios en el Hospital Nacional Arzobispo Loayza Antibiotic sensitivity of bacteria causing urinary tract infections in outpatients in the National Hospital Arzobispo Loayza2004.
- Blanco VM, Maya JJ, Correa A, Perenguez M, Muñoz JS, Motoa G, et al. Prevalence and risk factors for extended-spectrum β-lactamase-producing Escherichia coli causing community-onset urinary tract infections in Colombia. Enfermedades infecciosas y microbiologia clinica. 2016;34(9):559-65.
- Calle Núñez A, Colqui Campos KA, Rivera Estrella DA, Cieza Zevallos JA. Factores asociados a la presentación de infecciones urinarias por Escherichia coli productoras de betalactamasas de espectro extendido. Revista Medica Herediana. 2017;28:142-9.
- Falagas ME, Vouloumanou EK, Togias AG, Karadima M, Kapaskelis AM, Rafailidis PI, et al. Fosfomycin versus other antibiotics for the treatment of cystitis: a meta-analysis of randomized controlled trials. The Journal of antimicrobial chemotherapy. 2010;65(9):1862-77.
- Kang CI, Wi YM, Lee MY, Ko KS, Chung DR, Peck KR, et al. Epidemiology and risk factors of community onset infections caused by extended-spectrum beta-lactamase-producing Escherichia coli strains. Journal of clinical microbiology. 2012;50(2):312-7.
- Karanika S, Karantanos T, Arvanitis M, Grigoras C, Mylonakis E. Fecal Colonization With Extended-spectrum Beta-lactamase-Producing Enterobacteriaceae and Risk Factors Among Healthy Individuals: A Systematic Review and Metaanalysis. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2016;63(3):310-8.
- Mohd Sazlly Lim S, Wong PL, Sulaiman H, Atiya N, Hisham Shunmugam R, Liew SM. Clinical prediction models for ESBL-Enterobacteriaceae colonization or infection: a systematic review. The Journal of hospital infection. 2019;102(1):8-16.
- Rodriguez-Bano J, Picon E, Gijon P, Hernandez JR, Ruiz M, Pena C, et al. Community-onset bacteremia due to extended-spectrum beta-lactamase- producing Escherichia coli: risk factors and prognosis. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2010;50(1):40-8.
- Johnson JR, Russo TA. Acute Pyelonephritis in Adults. The New England journal of medicine. 2018;378(1):48-59.
- Talan DA, Stamm WE, Hooton TM, Moran GJ, Burke T, Iravani A, et al. Comparison of ciprofloxacin (7 days) and trimethoprim-sulfamethoxazole (14 days) for acute uncomplicated pyelonephritis pyelonephritis in women: a randomized trial. Jama. 2000;283(12):1583-90.
- Sanchez M, Collvinent B, Miro O, Horcajada JP, Moreno A, Marco F, et al. Short-term effectiveness of ceftriaxone single dose in the initial treatment of acute uncomplicated pyelonephritis in women. A randomised controlled trial. Emergency medicine journal : EMJ. 2002;19(1):19-22.
- Mouton Y, Ajana F, Chidiac C, Capron MH, Home P, Masquelier AM. A multicenter study of lomefloxacin and trimethoprim/sulfamethoxazole in the treatment of uncomplicated acute pyelonephritis. The American journal of medicine. 1992;92(4a):87s-90s.
- Dinh A, Davido B, Etienne M, Bouchand F, Raynaud-Lambinet A, Aslangul-Castier E, et al. Is 5 days of oral fluoroquinolone enough for acute uncomplicated pyelonephritis? The DTP randomized trial. European journal of clinical microbiology & infectious diseases : official publication of the European Society of Clinical Microbiology. 2017;36(8):1443-8.
- Bach D, van den Berg-Segers A, Hubner A, van Breukelen G, Cesana M, Pletan Y. Rufloxacin once daily versus ciprofloxacin twice daily in the treatment of patients with acute uncomplicated pyelonephritis. The Journal of urology. 1995;154(1):19-24.
- Johnson JR, Lyons MF, 2nd, Pearce W, Gorman P, Roberts PL, White N, et al. Therapy for women hospitalized with acute pyelonephritis: a randomized trial of ampicillin versus trimethoprim-sulfamethoxazole for 14 days. The Journal of infectious diseases. 1991;163(2):325-30.
- Chang UI, Kim HW, Wie SH. Comparison of Second- and Third-Generation Cephalosporin as Initial Therapy for Women with Community-Onset Uncomplicated Acute Pyelonephritis. Yonsei medical journal. 2015;56(5):1266-73.
- Takahashi S, Hirose T, Satoh T, Kato R, Hisasue SI, Takagi S, et al. Efficacy of a 14-day course of oral ciprofloxacin therapy for acute uncomplicated pyelonephritis. Journal of infection and chemotherapy : official journal of the Japan Society of Chemotherapy. 2001;7(4):255-7.
- Wie SH, Kim HW, Chang UI. Use of gentamicin for women with community-acquired uncomplicated acute pyelonephritis caused by gentamicin-susceptible or -resistant Escherichia coli: 10-year experience. Microbial drug resistance (Larchmont, NY). 2013;19(4):316-22.
- Jeon JH, Kim K, Han WD, Song SH, Park KU, Rhee JE, et al. Empirical use of ciprofloxacin for acute uncomplicated pyelonephritis caused by Escherichia coli in communities where the prevalence of fluoroquinolone resistance is high. Antimicrobial agents and chemotherapy. 2012;56(6):3043-6.
- Bryan J. Perfil microbiológico y resistencia bacteriana de infecciones urinarias en pacientes que acuden por consultorio externo del Hospital III Essalud Juliaca mayo–julio 2012. 2013.
- Leon Rodriguez LJ. Multirresistencia antimicrobiana de cepas Escherichia Coli productoras de Betalactamasas de espectro extendido (Blee) aislados en Urocultivo del hospital regional “Manuel Nuñez Butrón” Puno–2012. 2014.
- La Madrid SA, Fukuda FF, De Meritens AB, Menchola JV. Sensibilidad antibiótica de los gérmenes causantes de infecciones urinarias en pacientes ambulatorios en el Hospital Nacional Arzobispo Loayza. Rev Soc Per Med Inter. 2004;17:5-8.
- Chacaltana Huarcaya J. Perfil microbilógico y resistencia bacteriana de infecciones del tracto urinario adquiridas en la comunidad en pacientes ambulatorios del Hospital Nacional Daniel A. Carrión. 2002.
- Horna Quintana G, Silva Díaz M, Vicente Taboada W, Tamariz Ortiz J. Concentración mínima inhibitoria y concentración mínima bactericida de ciprofloxacina en bacterias uropatógenas aisladas en el Instituto Nacional de Enfermedades Neoplásicas. Revista Medica Herediana. 2005;16(1):39-45.
- Quenta R, Cruz I. Etiología y resistencia bacteriana de infecciones urinarias en pacientes mayores de 60 años. 2008.
- Stamm WE, McKevitt M, Counts GW. Acute renal infection in women: treatment with trimethoprim-sulfamethoxazole or ampicillin for two or six weeks. A randomized trial. Ann Intern Med. 1987;106(3):341-5.
- Regalado J, Mendoza H, Aizpuru F, Altuna E, Gomez M, Cia JM. Acute pyelonephritis treated under «home hospitalization.» Ten years’ experience. Enfermedades infecciosas y microbiologia clinica. 2006;24(10):629-33.
- Guía de Práctica Clínica para el Reconocimiento y Manejo Inicial de Sepsis en Adultos. In: Investigación. IdEndTaeSe, editor. Lima: EsSalud; 2018.
- Hooton TM. Recurrent urinary tract infection in women. International journal of antimicrobial agents. 2001;17(4):259-68.
- Albert X, Huertas I, Pereiro, II, Sanfelix J, Gosalbes V, Perrota C. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. The Cochrane database of systematic reviews. 2004(3):Cd001209.
- Stapleton A, Latham RH, Johnson C, Stamm WE. Postcoital antimicrobial prophylaxis for recurrent urinary tract infection. A randomized, double-blind, placebo-controlled trial. Jama. 1990;264(6):703-6.
- Taype Rondán ÁR. Resistencia antibiótica de gérmenes causantes de infección del tracto urinario en pacientes que acuden al servicio de emergencia del Hospital de Emergencias José Casimiro Ulloa, 2012. 2013.
- Fu Z, Liska D, Talan D, Chung M. Cranberry Reduces the Risk of Urinary Tract Infection Recurrence in Otherwise Healthy Women: A Systematic Review and Meta-Analysis. J Nutr. 2017;147(12):2282-8.
- Schwenger EM, Tejani AM, Loewen PS. Probiotics for preventing urinary tract infections in adults and children. The Cochrane database of systematic reviews. 2015(12):CD008772.
- Taha Neto KA, Nogueira Castilho L, Reis LO. Oral vaccine (OM-89) in the recurrent urinary tract infection prophylaxis: a realistic systematic review with meta-analysis. Actas urologicas espanolas. 2016;40(4):203-8.
- Revoredo Rego F, Huaman Egoavil E, Zegarra Cavan S, Auris Mora H, Valderrama Barrientos RJRdGdP. Perfil microbiológico de las infecciones intra abdominales en el Servicio de Cirugía de Emergencia del Hospital Nacional Guillermo Almenara lrigoyen, Lima, Peru. Rev gastroenterol Perú. 2016;36(2):115-22.
- Lifonzo-Mucha SJ, E Tamariz-Zamudio P, Champi-Merino RG. Sensibilidad a fosfomicina en Escherichia coli productoras de betalactamasas de espectro extendido. Revista Peruana de Medicina Experimental y Salud Pública. 2018;35:68-71.
- Palma N, Pons MJ, Gomes C, Mateu J, Riveros M, Garcia W, et al. Resistance to quinolones, cephalosporins and macrolides in Escherichia coli causing bacteraemia in Peruvian children. Journal of global antimicrobial resistance. 2017;11:28-33.
- Martínez-Martínez L. Asociación de BLEE con otros mecanismos de resistencia. Enfermedades infecciosas y microbiologia clinica. 2007;25(Supl. 2):38-47.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


