GUÍA PRÁCTICA CLÍNICA:
PARA EL MANEJO DE NEUMONÍA INTRAHOSPITALARIA
Y NEUMONÍA ASOCIADA A VENTILADOR (2019)
DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: pacientes con neumonía intrahospitalaria y neumonía asociada a ventilador.
- Alcance: manejo de neumonía intrahospitalaria y neumonía asociada a ventilador.
Autores
Expertos clínicos:
- Martin Oyanguren Miranda
- Luis Hercilla Vásquez
- Enrique Paz Rojas
- Giancarlo Pérez Lazo
- Martín Ramón Pinedo
- Humberto Vásquez Cubas
Metodólogos:
- Claudia Patricia Matos Miranda
- César Augusto Ugarte Gil
Coordinadores:
- Raúl Alonso Timaná Ruiz
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
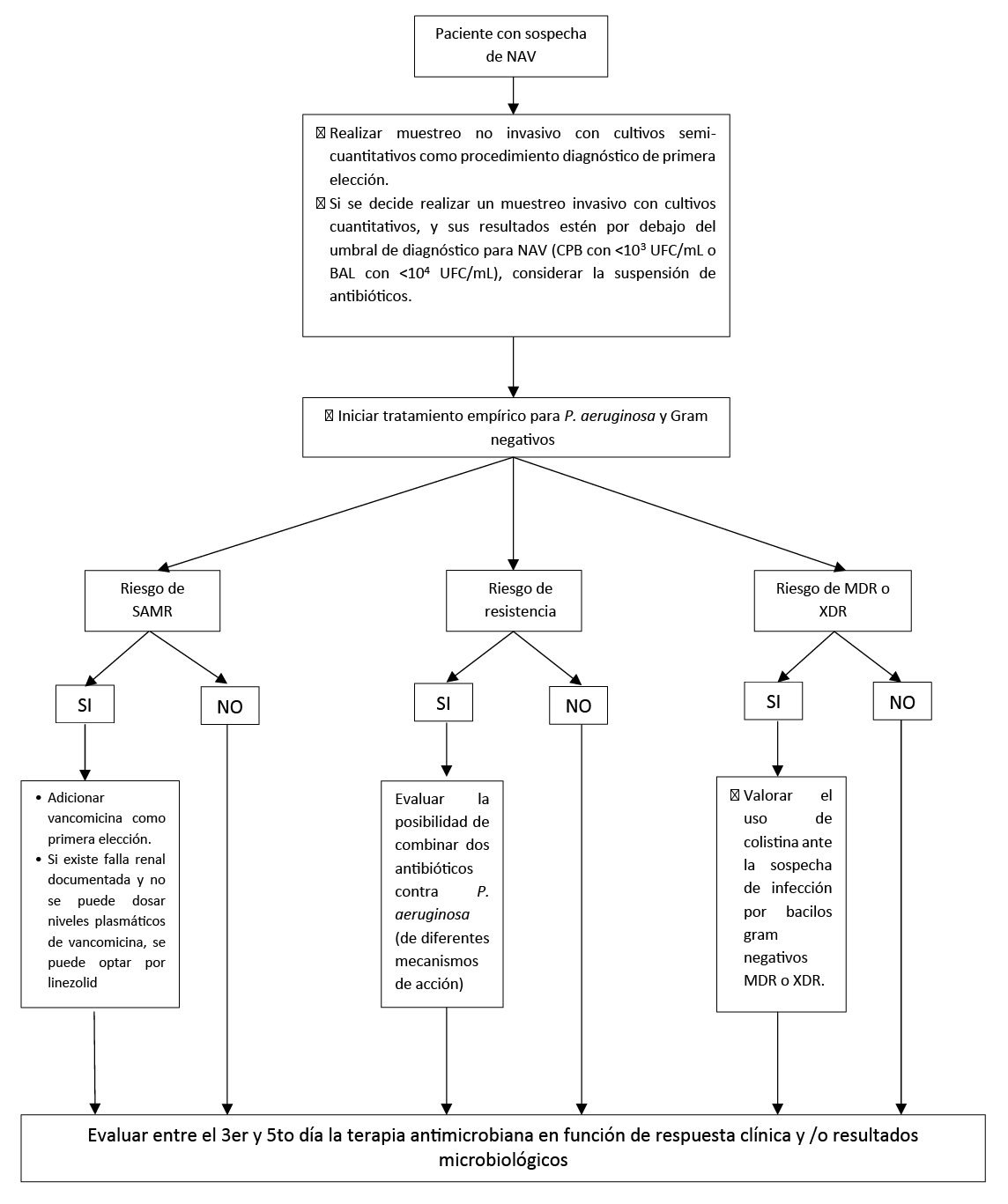
Flujograma de diagnóstico y manejo empírico de pacientes con sospecha de NAV
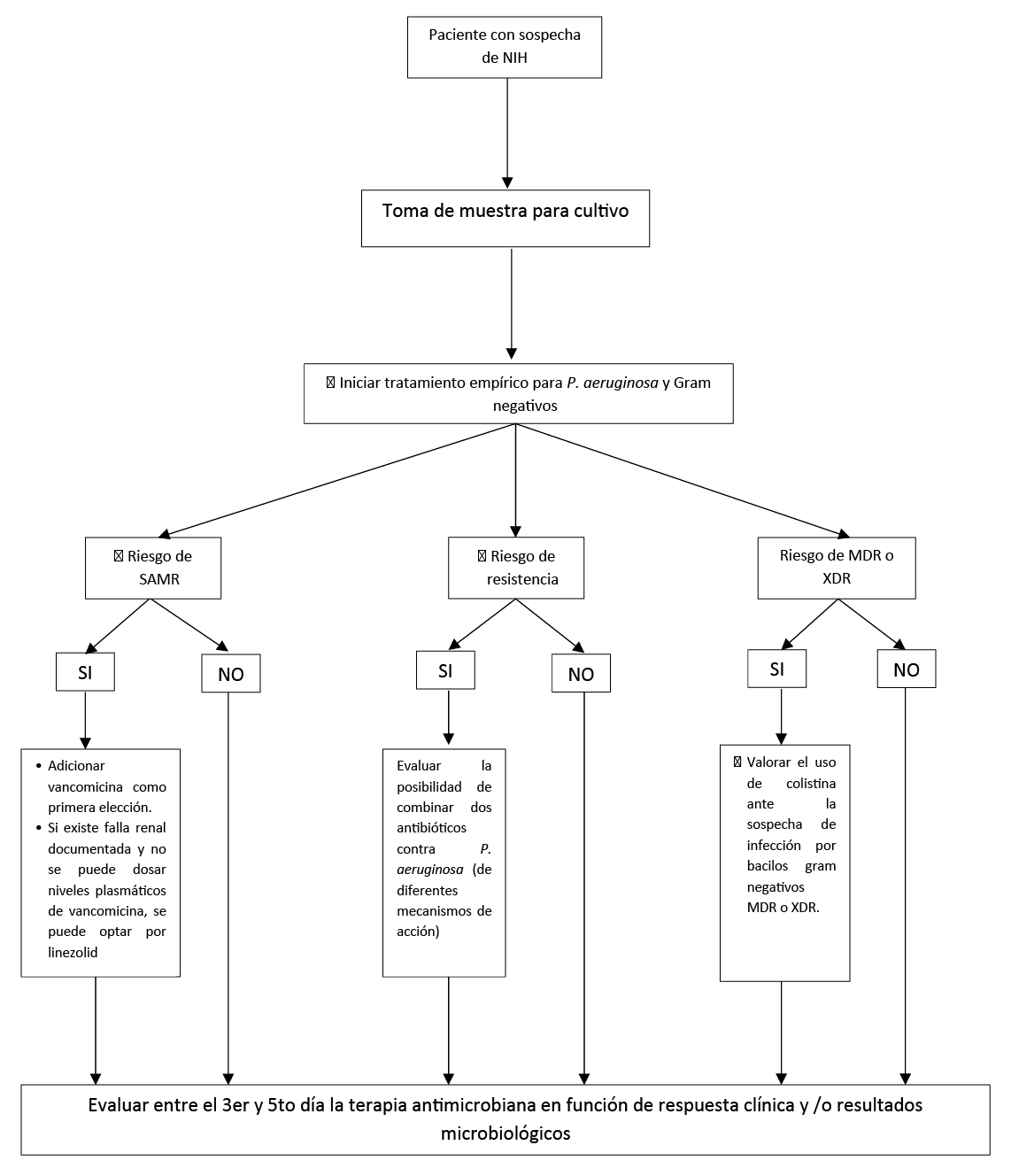
Flujograma de diagnóstico y manejo empírico de pacientes con sospecha de NIH
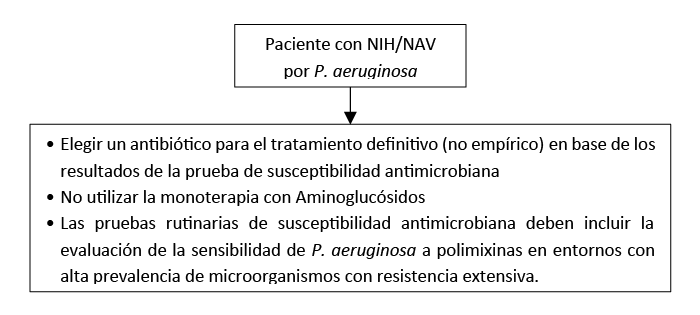
Flujograma de manejo de NIH/NAV por P aeruginosa
vacio
vacio
1. Diagnóstico
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con sospecha de NAV, sugerimos la realización de muestreo no invasivo con cultivos semi-cuantitativos como procedimiento diagnóstico. Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
En situaciones en que la condición del paciente lo amerite, las condiciones del laboratorio sean adecuadas y según la decisión clínica del médico tratante (la cual se justificará debido al objetivo de definir si es colonización o infección), se puede optar por realizar un muestreo invasivo con cultivos cuantitativos.
2. Suspensión de antibióticos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Para pacientes con sospecha de NAV cuyos resultados de cultivo cuantitativo invasivo estén por debajo del umbral de diagnóstico para NAV (un cepillado protegido bacteriológico [CPB] con <103 unidades formadoras de colonias [UFC]/mL o lavado bronquio alveolar [BAL] con <104 UFC/mL), sugerimos considerar la suspensión de antibióticos. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
Para pacientes con sospecha de NAV cuyos resultados de cultivo cuantitativo invasivo estén por debajo del umbral de diagnóstico para NAV, considerar algunos factores clínicos (como la probabilidad de una fuente alternativa de infección, terapia antimicrobiana previa en el momento del cultivo, sospecha clínica de complicaciones o evidencia de deterioro clínico) para tomar la decisión de continuar o no con los antibióticos.
3. Selección de régimen de antibióticos empíricos
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
Todos los establecimientos con internamiento deben generar y difundir regularmente mapas microbiológicos, idealmente aquellos específicos para su población de cuidados intensivos.
BPC 2:
Los regímenes de tratamiento empírico deberán ser definidos de acuerdo con la distribución local de patógenos asociados con NIH/NAV y sus respectivos perfiles de susceptibilidad antimicrobiana.
BPC 3:
La frecuencia con la que se actualiza la distribución de patógenos y sus susceptibilidades antimicrobianas debe ser determinada por la institución. Las consideraciones deben incluir la tasa de cambio, los recursos y la cantidad de datos disponibles para el análisis.
4. Antibióticos recomendados
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Para pacientes con sospecha de NAV que requieren cobertura empírica para SAMR, recomendamos usar vancomicina como primera opción. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BPC 1:
En pacientes con sospecha de NAV, todos los regímenes de terapia antibiótica empírica deben tener cobertura contra P. aeruginosa, Acinetobacter spp. y otros bacilos gram negativos.
BPC 2:
En pacientes con sospecha de NAV que están siendo tratados de forma empírica se debe prescribir un antibiótico con actividad contra SAMR cuando el paciente cumpla con cualquiera de los siguientes factores:
- Pacientes con algún factor de riesgo para SAMR (reciente hospitalización, cirugía reciente, infección por VIH, uso de drogas inyectables, uso previo de antibióticos o estancia prolongada en el centro hospitalario)
- Pacientes tratados en unidades y servicios donde > 20% de los aislamientos sean de SAMR
BPC 3:
En pacientes con sospecha de NAV que requieren cobertura empírica para SAMR, se puede seleccionar de manera empírica linezolid siempre y cuando el paciente presente falla renal documentada y la institución no cuente con dosaje de niveles plasmáticos de vancomicina para guiar la terapéutica.
BPC 4:
Para los pacientes con NAV que están siendo tratados de forma empírica y tienen factores que aumentan la probabilidad de infección por P. aeruginosa o por bacilos gram negativos como los siguientes:
- Pacientes con al menos un factor de riesgo de multi-resistencia antimicrobiana
- Pacientes en unidades donde > 10% de aislamientos de Gram negativos son resistentes al agente considerado para monoterapia
- Cuando el perfil de susceptibilidad microbiana combinada de la institución lo justifique,
se sugiere prescribir dos antibióticos contra P. aeruginosa (de diferentes mecanismos de acción) por un potencial mayor riesgo de resistencia.
BPC 5:
Si el médico tratante de acuerdo a la estratificación de riesgos realizada o a las recomendaciones establecidas por las políticas de gerenciamiento de antibióticos locales (a partir de perfil de susceptibilidad antimicrobiana combinada) lo considera, puede optar por el manejo con un único antibiótico con actividad contra P. aeruginosa.
BPC 6:
En pacientes con sospecha de NAV, se debería evitar los aminoglucósidos si se dispone de agentes alternativos con actividad Gram negativa adecuada.
BPC 7:
En pacientes con sospecha de NAV, se debería evitar la colistina si existen agentes alternativos con actividad Gram negativa adecuada.
BPC 8:
En pacientes con sospecha de NAV, se debe valorar el uso de colistina ante la sospecha de infección por bacilos gram negativos MDR o XDR.
5. Tratamiento empírico de NIH
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Para pacientes con NIH que requieren cobertura empírica para SAMR, recomendamos usar vancomicina como primera opción. (Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
En pacientes con NIH, todos los regímenes de terapia antibiótica empírica deben tener cobertura contra P. aeruginosa y otros bacilos gram negativos.
BPC 2:
En pacientes con NIH que están siendo tratados de forma empírica se debe prescribir un antibiótico con actividad contra SAMR cuando el paciente cumpla con cualquiera de los siguientes factores:
- Uso de antibióticos intravenosos dentro de los 90 días previos
- Tratados en unidades y servicios donde > 20% de los aislamientos sean de SAMR
- Se encuentre en alto riesgo de mortalidad
BPC 3:
En pacientes con NIH, se puede seleccionar de manera empírica linezolid siempre y cuando el paciente presente falla renal documentada y la institución no cuente con dosaje de niveles plasmáticos de vancomicina para guiar la terapéutica.
BPC 4:
Para los pacientes con NIH que están siendo tratados de forma empírica y tienen factores que aumentan la probabilidad de infección por P. aeruginosa o por Gram negativos, es decir, haber usado antibióticos por vía endovenosa dentro de los 90 días previos o tener una enfermedad pulmonar estructural que aumenta el riesgo de infección Gram negativa como bronquiectasia o fibrosis quística) o un alto riesgo de mortalidad (como necesidad de apoyo ventilatorio o shock séptico), se sugiere prescribir antibióticos de dos mecanismos de acción diferentes con actividad contra P. aeruginosa siempre y cuando el perfil de susceptibilidad combinada de la institución lo justifique.
BPC 5:
Si el médico tratante de acuerdo a la estratificación de riesgos realizada o a las recomendaciones establecidas por las políticas de gerenciamiento de antibióticos locales (a partir de perfil de susceptibilidad antimicrobiana combinada) lo considera, puede optar por el manejo con un único antibiótico con actividad contra P. aeruginosa.
BPC 6:
En pacientes con NIH que están siendo tratados empíricamente, no se debe utilizar un aminoglucósido como único agente contra pseudomonas.
BPC 7:
En pacientes con NIH, se debe valorar el uso de colistina ante la sospecha de infección por bacilos gram negativos MDR o XDR.
6. Monoterapia versus terapia combinada
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
Para los pacientes con NIH/NAV causados por P. aeruginosa, debe elegirse un antibiótico para el tratamiento definitivo (no empírico) en base de los resultados de la prueba de susceptibilidad antimicrobiana.
BPC 2:
Para los pacientes con NIH/NAV debido a P. aeruginosa no se debe utilizar la monoterapia con Aminoglucósidos.
BPC 3:
Las pruebas rutinarias de susceptibilidad antimicrobiana deben incluir la evaluación de la sensibilidad de P. aeruginosa a polimixinas (colistina o polimixina B) en entornos con alta prevalencia de microorganismos con resistencia extensiva.
7. Duración óptima de la terapia con antibióticos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
Para los pacientes con NIH/NAV, recomendamos que la terapia antibiótica con el antibiótico apropiado dure 7 días. (Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
Se deben considerar situaciones para decidir la prolongación de la terapia, incluyendo: inmunodeficiencia, fibrosis quística, empiema, absceso pulmonar, cavitación o neumonía necrotizante, y mala respuesta clínica a la terapia.
BPC 2:
La duración de la terapia antibiótica también se definirá en función del germen, especialmente si son gérmenes Gram Negativos no fermentadores, en cuyo caso se evaluará aumentar la duración de la terapia antibiótica.
Referencias bibliográficas
- Barbier F, Andremont A, Wolff M, Bouadma L. Hospital-acquired pneumonia and ventilator-associated pneumonia: recent advances in epidemiology and management. Current opinion in pulmonary medicine. 2013;19(3):216-28.
- Stone PW, Kunches L, Hirschhorn L. Cost of hospital-associated infections in Massachusetts. American journal of infection control. 2009;37(3):210-4.
- Torres A, Niederman MS, Chastre J, Ewig S, Fernandez-Vandellos P, Hanberger H, et al. International ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital-acquired pneumonia and ventilator-associated pneumonia: Guidelines for the management of hospital-acquired pneumonia (HAP)/ventilator-associated pneumonia (VAP) of the European Respiratory Society (ERS), European Society of Intensive Care Medicine (ESICM), European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and Asociacion Latinoamericana del Torax (ALAT). The European respiratory journal. 2017;50(3).
- Timsit JF, Esaied W, Neuville M, Bouadma L, Mourvllier B. Update on ventilator-associated pneumonia. F1000Research. 2017;6:2061.
- Moine P, Timsit JF, De Lassence A, Troche G, Fosse JP, Alberti C, et al. Mortality associated with late-onset pneumonia in the intensive care unit: results of a multi-center cohort study. Intensive care medicine. 2002;28(2):154-63.
- Valles J, Pobo A, Garcia-Esquirol O, Mariscal D, Real J, Fernandez R. Excess ICU mortality attributable to ventilator-associated pneumonia: the role of early vs late onset. Intensive care medicine. 2007;33(8):1363-8.
- Alvarez Lerma F, Torres Marti A, Rodriguez De Castro F. Recommendations for diagnosing ventilator-associated pneumonia. Archivos de bronconeumologia. 2001;37(8):325-34.
- Rey de Castro J, Piñeiro A, Carcelen A. Ventilación mecánica en la UCI del departamento de medicina del Hospital Cayetano Heredia. Rev méd hered. 1990;1(2):22-6.
- García L. Algunos aspectos clínicos epidemiológicos de los pacientes de la Unidad de Cuidados Intensivos del Hospital Belén de Trujillo 1994: Tesis Bachiller en Medicina UNT; 1995.
- Quinto F, Luisa M. Prevalencia de neumonía nosocomial en paciente con ventilación mecánica en la Unidad de Cuidados Intensivos del Hospital Regional Ayacucho-2016. 2016.
- Montalvo R, Alvarezcano J, Huaroto L, López J, Lam C, Mucha R, et al. Factores asociados a mortalidad por neumonía nosocomial en un hospital público de Perú. Revista Peruana de Epidemiología. 2013;17(2).
- León-Chahua C, Oscanoa-Espinoza T, Chávez-Gutiérrez C, Chávez-Gutiérrez J. Características epidemiológicas de la neumonía intrahospitalaria en un servicio de medicina interna del Hospital Guillermo Almenara Irigoyen de Lima, Perú. Horizonte Médico. 2016;16(3):43-9.
- INCN. Guía de Práctica Clínica Manejo de Neumonía Intrahospitalaria 2015 [Available from: http://www.incn.gob.pe/images/GUIAS/Guia_manejo_de_neumonia_intrahospitalaria.pdf.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- IETSI. Manual de Adopción de Guías de Práctica Clínica basadas en Evidencia en EsSalud. Lima. EsSalud; 2016. p. 1-31.
- Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2016;63(5):e61-e111.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC medical research methodology. 2007;7(1):10.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol. 2007;7:10.
- Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses. European journal of epidemiology. 2010;25(9):603-5.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Restellini S, Kherad O, Jairath V, Martel M, Barkun A. Red blood cell transfusion is associated with increased rebleeding in patients with nonvariceal upper gastrointestinal bleeding. Alimentary pharmacology & therapeutics. 2013;37(3):316-22.
- Berton DC, Kalil AC, Teixeira PJ. Quantitative versus qualitative cultures of respiratory secretions for clinical outcomes in patients with ventilator-associated pneumonia. The Cochrane database of systematic reviews. 2014(10):Cd006482.
- A randomized trial of diagnostic techniques for ventilator-associated pneumonia. The New England journal of medicine. 2006;355(25):2619-30.
- Fagon JY, Chastre J, Wolff M, Gervais C, Parer-Aubas S, Stephan F, et al. Invasive and noninvasive strategies for management of suspected ventilator-associated pneumonia. A randomized trial. Annals of internal medicine. 2000;132(8):621-30.
- Sole Violan J, Fernandez JA, Benitez AB, Cardenosa Cendrero JA, Rodriguez de Castro F. Impact of quantitative invasive diagnostic techniques in the management and outcome of mechanically ventilated patients with suspected pneumonia. Critical care medicine. 2000;28(8):2737-41.
- Ruiz M, Torres A, Ewig S, Marcos MA, Alcon A, Lledo R, et al. Noninvasive versus invasive microbial investigation in ventilator-associated pneumonia: evaluation of outcome. American journal of respiratory and critical care medicine. 2000;162(1):119-25.
- Sanchez-Nieto JM, Torres A, Garcia-Cordoba F, El-Ebiary M, Carrillo A, Ruiz J, et al. Impact of invasive and noninvasive quantitative culture sampling on outcome of ventilator-associated pneumonia: a pilot study. American journal of respiratory and critical care medicine. 1998;157(2):371-6.
- Sesma AC, Francisetti VA, Pintado S, Paiva C, Mangiaterra SM. Valor diagnóstico del método semi-cuantitativo en el procesamiento de aspirados traqueales. Acta bioquímica clínica latinoamericana. 2012;46(3):413-8.
- Brun-Buisson C, Fartoukh M, Lechapt E, Honoré S, Zahar JR, Cerf C, et al. Contribution of blinded, protected quantitative specimens to the diagnostic and therapeutic management of ventilator-associated pneumonia. Chest. 2005;128(2):533-44.
- Raman K, Nailor MD, Nicolau DP, Aslanzadeh J, Nadeau M, Kuti JL. Early antibiotic discontinuation in patients with clinically suspected ventilator-associated pneumonia and negative quantitative bronchoscopy cultures. Critical care medicine. 2013;41(7):1656-63.
- Rello J, Sa-Borges M, Correa H, Leal SR, Baraibar J. Variations in etiology of ventilator-associated pneumonia across four treatment sites: implications for antimicrobial prescribing practices. American journal of respiratory and critical care medicine. 1999;160(2):608-13.
- Namias N, Samiian L, Nino D, Shirazi E, O’Neill K, Kett DH, et al. Incidence and susceptibility of pathogenic bacteria vary between intensive care units within a single hospital: implications for empiric antibiotic strategies. The Journal of trauma. 2000;49(4):638-45; discussion 45-6.
- Fridkin SK, Edwards JR, Tenover FC, Gaynes RP, McGowan JE, Jr. Antimicrobial resistance prevalence rates in hospital antibiograms reflect prevalence rates among pathogens associated with hospital-acquired infections. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2001;33(3):324-30.
- Babcock HM, Zack JE, Garrison T, Trovillion E, Kollef MH, Fraser VJ. Ventilator-associated pneumonia in a multi-hospital system: differences in microbiology by location. Infection control and hospital epidemiology. 2003;24(11):853-8.
- Al-Dahir S, Gillard C, Brakta F, Figueroa JE. Antimicrobial Susceptibilities of Respiratory Pathogens in the Surgical/Trauma Intensive Care Unit Compared with the Hospital-Wide Respiratory Antibiogram in a Level I Trauma Center. Surgical Infections. 2015;16(1):62-7.
- Scholte JBJ, Duong HL, Linssen C, Van Dessel H, Bergmans D, van der Horst R, et al. Empirical antibiotic therapy for pneumonia in intensive care units: a multicentre, retrospective analysis of potentially pathogenic microorganisms identified by endotracheal aspirates cultures. European Journal of Clinical Microbiology and Infectious Diseases. 2015;34(11):2295-305.
- Djordjevic ZM, Folic MM, Jankovic SM. Distribution and antibiotic susceptibility of pathogens isolated from adults with hospital-acquired and ventilator-associated pneumonia in intensive care unit. Journal of Infection and Public Health. 2017;10(6):740-4.
- Dámaso-Mata B, Chirinos-Cáceres J, Menacho-Villafuerte L. Estimación de costos económicos en la atención de la neumonía nosocomial en un hospital regional peruano, 2009 al 2011. Revista Peruana de Medicina Experimental y Salud Pública. 2016;33:233-40.
- Sievert DM, Ricks P, Edwards JR, Schneider A, Patel J, Srinivasan A, et al. Antimicrobial-resistant pathogens associated with healthcare-associated infections: summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009-2010. Infection control and hospital epidemiology. 2013;34(1):1-14.
- Jones RN. Microbial etiologies of hospital-acquired bacterial pneumonia and ventilator-associated bacterial pneumonia. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2010;51 Suppl 1:S81-7.
- Lee AS, de Lencastre H, Garau J, Kluytmans J, Malhotra-Kumar S, Peschel A, et al. Methicillin-resistant Staphylococcus aureus. Nature reviews Disease primers. 2018;4:18033.
- Chambers HF, Deleo FR. Waves of resistance: Staphylococcus aureus in the antibiotic era. Nature reviews Microbiology. 2009;7(9):629-41.
- Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 2012;18(3):268-81.
- Kuti EL, Patel AA, Coleman CI. Impact of inappropriate antibiotic therapy on mortality in patients with ventilator-associated pneumonia and blood stream infection: a meta-analysis. Journal of critical care. 2008;23(1):91-100.
- Supplemental Material for the Management of Adults with Hospitalacquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. 2016.
- Arthur LE, Kizor RS, Selim AG, van Driel ML, Seoane L. Antibiotics for ventilator-associated pneumonia. The Cochrane database of systematic reviews. 2016;10:Cd004267.
- Neumonía Asociada a la Ventilación Mecánica: Factores de riesgo en la UCI del Hospital Nacional Carlos Seguin Escobedo EsSalud Arequipa 2006 2006 [Available from: http://www.essalud.gob.pe/biblioteca_central/pdfs/neum_asoc_ventil_mecanica.pdf.
- Chincha O, Cornelio E, Valverde V, Acevedo M. Nosocomial infections associated to invasive devices in the intensive care units of a national hospital of Lima, Peru. Revista peruana de medicina experimental y salud publica. 2013;30(4):616-20.
- Kalil AC, Klompas M, Haynatzki G, Rupp ME. Treatment of hospital-acquired pneumonia with linezolid or vancomycin: a systematic review and meta-analysis. BMJ open. 2013;3(10):e003912.
- Palavutitotai N, Jitmuang A, Tongsai S, Kiratisin P, Angkasekwinai N. Epidemiology and risk factors of extensively drug-resistant Pseudomonas aeruginosa infections. PLOS ONE. 2018;13(2):e0193431.
- Najmeddin F, Shahrami B, Azadbakht S, Dianatkhah M, Rouini MR, Najafi A, et al. Evaluation of Epithelial Lining Fluid Concentration of Amikacin in Critically Ill Patients With Ventilator-Associated Pneumonia. Journal of intensive care medicine. 2018:885066618754784.
- Wargo KA, Edwards JD. Aminoglycoside-induced nephrotoxicity. Journal of pharmacy practice. 2014;27(6):573-7.
- Leis JA, Rutka JA, Gold WL. Aminoglycoside-induced ototoxicity. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne. 2015;187(1):E52.
- Florescu DF, Qiu F, McCartan MA, Mindru C, Fey PD, Kalil AC. What is the efficacy and safety of colistin for the treatment of ventilator-associated pneumonia? A systematic review and meta-regression. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2012;54(5):670-80.
- Aarts MA, Hancock JN, Heyland D, McLeod RS, Marshall JC. Empiric antibiotic therapy for suspected ventilator-associated pneumonia: a systematic review and meta-analysis of randomized trials. Critical care medicine. 2008;36(1):108-17.
- Torres A, Rubinstein E, Corey GR, Stryjewski ME, Barriere SL. Analysis of phase 3 telavancin nosocomial pneumonia data excluding patients with severe renal impairment and acute renal failure. Journal of Antimicrobial Chemotherapy. 2014;69(4):1119-26.
- Mombelli G, Coppens L, Thys JP, Klastersky J. Anti-Pseudomonas activity in bronchial secretions of patients receiving amikacin or tobramycin as a continuous infusion. Antimicrobial Agents and Chemotherapy. 1981;19(1):72-5.
- Balaji V, Jeremiah SS, Baliga PR. Polymyxins: Antimicrobial susceptibility concerns and therapeutic options. Indian journal of medical microbiology. 2011;29(3):230-42.
- Telechea H, Speranza N, Lucas L, Santurio A, Giachetto G, Algorta G, et al. [Antibiotic consumption and antimicrobial susceptibility evolution in the Centro Hospitalario Pereira Rossell in methicillin resistant Staphylococcus aureus era]. Revista chilena de infectologia : organo oficial de la Sociedad Chilena de Infectologia. 2009;26(5):413-9.
- Pugh R, Grant C, Cooke RPD, Dempsey G. Short-course versus prolonged-course antibiotic therapy for hospital-acquired pneumonia in critically ill adults. Cochrane Database of Systematic Reviews. 2015;2015(8).
- Dimopoulos G, Poulakou G, Pneumatikos IA, Armaganidis A, Kollef MH, Matthaiou DK. Short- vs long-duration antibiotic regimens for ventilator-associated pneumonia: A systematic review and meta-analysis. Chest. 2013;144(6):1759-67.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com