DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- El ámbito asistencial incluye los servicios o unidades de medicina general, medicina interna, nefrología, y reumatología en lo que corresponda a cada nivel, de EsSalud.
Población y alcance
- Población: Pacientes adultos con nefritis lúpica de clases I a V no refractarios en fase de inducción y mantenimiento.
- Alcance: tratamiento farmacológico de nefritis lúpica.
Autores
Expertos clínicos:
- Ugarte Gil, Manuel Francisco
- Reumatólogo.
- Hospital Nacional Guillermo Almenara Irigoyen, red asistencial Almenara, Lima, EsSalud.
- Gutierrez Vargas, Mirella
- Reumatóloga.
- Hospital Suarez Angamos III, red asistencial Rebagliati, Lima, EsSalud.
- Lumbe Diaz, Vidia Luz
- Reumatóloga.
- Hospital Adolfo Guevara Velasco, red asistencial Cusco, Cusco, EsSalud.
- Guevara Rodríguez, Luis Ángel
- Reumatólogo.
- Hospital Almanzor Aguinaga Asenjo, red asistencial Lambayeque, Chiclayo, EsSalud.
- Perez Medina, Wilkerson
- Reumatólogo.
- Hospital Suarez Angamos III, red asistencial Rebagliati, Lima, EsSalud.
- Huamanyauri Saavedra, Paolo Cesar
- Reumatólogo.
- Hospital Nacional Alberto Sabogal Sologuren, red asistencial Sabogal, Callao, EsSalud.
- Rodríguez Mori, Juan Enrique
- Nefrólogo.
- Hospital Nacional Alberto Sabogal Sologuren, red asistencial Sabogal, Callao, EsSalud.
- Hostia Cardeña, Álvaro Nicanor
- Nefrólogo.
- Hospital Nacional Guillermo Almenara Irigoyen, red asistencial Almenara, Lima, EsSalud.
- Gómez Lujan, Martín
- Nefrólogo.
- Hospital Nacional Edgardo Rebagliati Martins, red asistencial Rebagliati, Lima, EsSalud.
- Sottec Roque, Valentín
- Nefrólogo.
- Hospital Adolfo Guevara Velasco, red asistencial Cusco, Cusco, EsSalud.
- Flores Vilva, Miguel
- Nefrólogo.
- Hospital Nacional Carlos Alberto Seguin Escobedo, red asistencial Arequipa, Arequipa, EsSalud.
- De la Jara Cordero, Jesús Rolando
- Internista.
- Hospital Nacional Edgardo Rebagliati Martins, red asistencial Rebagliati, Lima, EsSalud.
- Ugaz Zegarra, Milko Cesar
- Internista.
- Hospital Nacional Almanzor Aguinaga Asenjo, red asistencial Lambayeque, Chiclayo, EsSalud.
- Vargas Marquez, Sandra
- Internista.
- Hospital Adolfo Guevara Velasco, red asistencial Cusco, Cusco, EsSalud.
Metodólogos:
- Goicochea Lugo, Sergio André
- Metodólogo.
- Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI, EsSalud.
- Delgado Flores, Carolina
- Metodóloga.
- Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI, EsSalud.
- García Gomero, David
- Metodólogo.
- Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI, EsSalud.
- Dolores Maldonado, Gandy
- Metodóloga.
- Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI, EsSalud.
- Romero Robles, Milton Antonio
- Metodólogo.
- Universidad Nacional del Santa, Escuela de Medicina. Nuevo Chimbote, Ancash, Perú.
- Ortiz Benique, Zhamanda Noelia
- Metodóloga.
- Universidad Nacional de San Agustín de Arequipa, Facultad de Medicina. Arequipa, Perú.
Coordinadores:
- Salvador Salvador, Stefany
- Coordinadora.
- Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI, EsSalud.
- Carrera Acosta, Lourdes del Rocío
- Coordinadora.
- Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI, EsSalud.
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
vacio
vacio
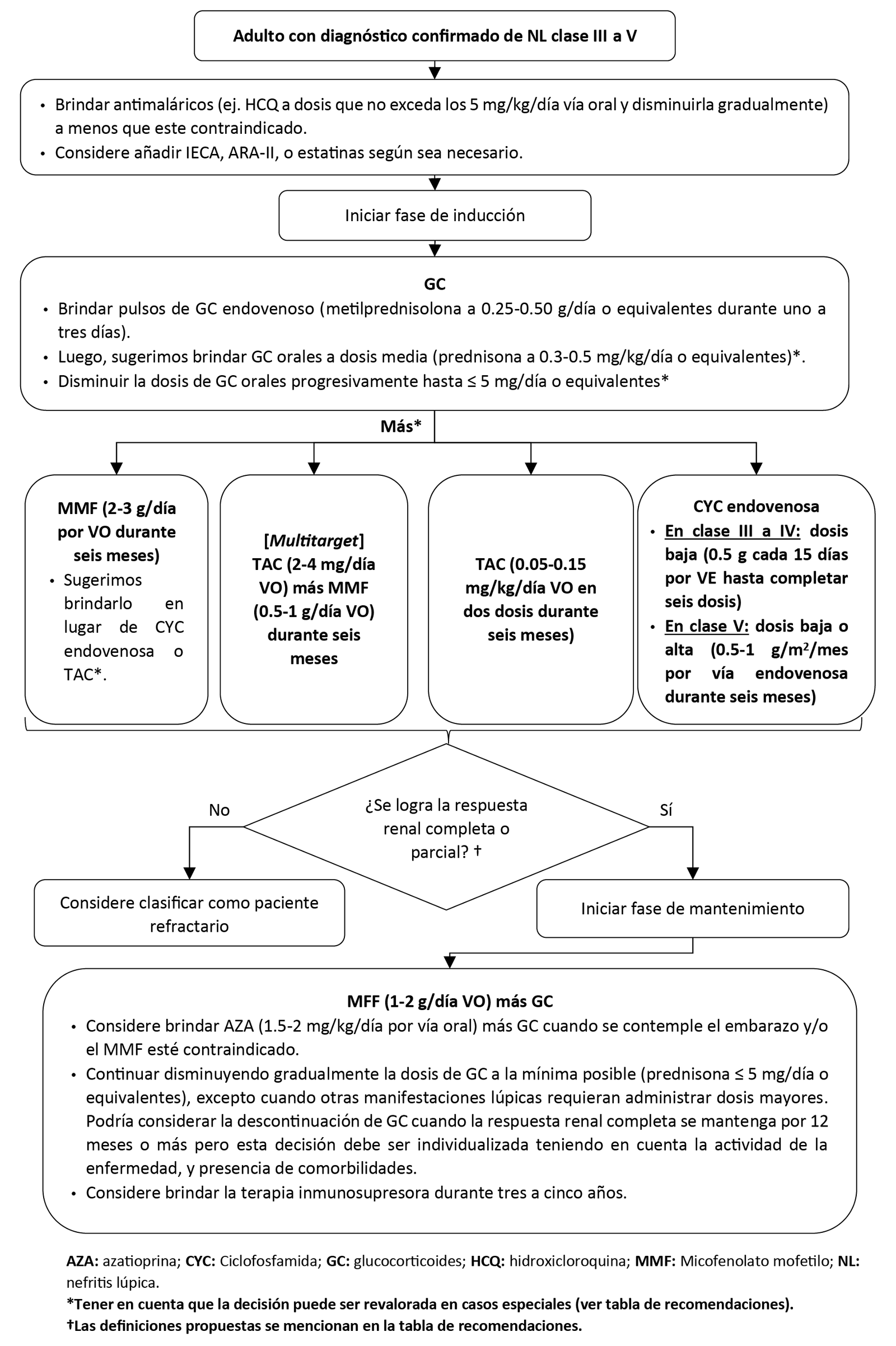
1. Inducción brindando glucocorticoides
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con NL clase III a V no refractarios, sugerimos considerar iniciar la fase de inducción brindando GC orales a dosis medias en lugar dosis altas en combinación con algún inmunosupresor. (Recomendación condicional a favor de la intervención, certeza muy baja de la evidencia)
BPC 1:
Considerar las siguientes dosis de inicio de GC orales:
- Dosis medias: prednisona a 0.3-0.5 mg/kg/día o equivalentes.
- Dosis altas: prednisona a 1 mg/kg/día o equivalentes.
Luego, disminuirla progresivamente hasta ≤ 5 mg/día o equivalentes, excepto cuando otras manifestaciones lúpicas requieran administrar dosis mayores.
BPC 2:
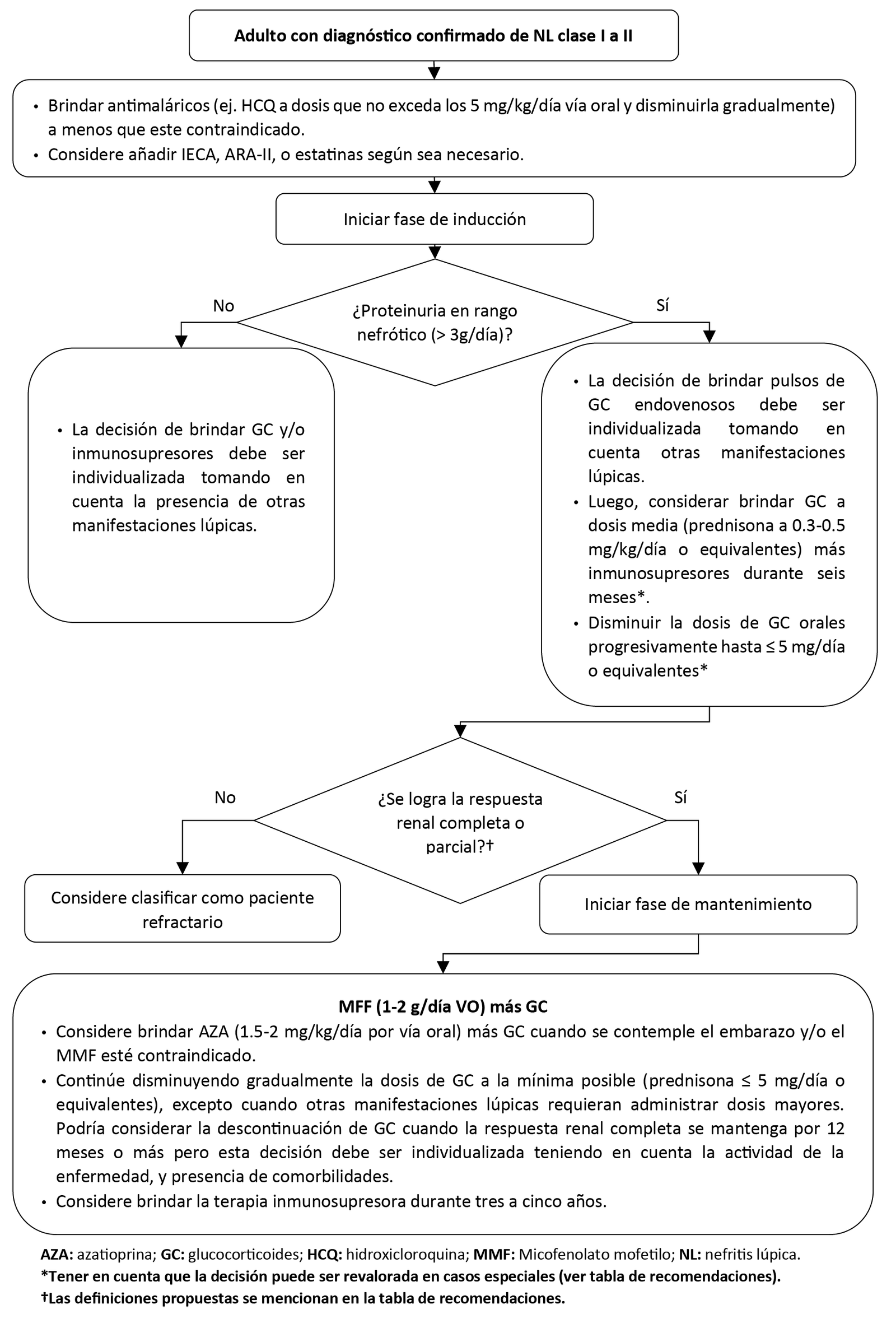
En adultos con NL clase I a II no refractarios en fase de inducción:
- Cuando se presente proteinuria en rango nefrótico (> 3 g/día), considere brindar GC orales a dosis medias más inmunosupresores durante seis meses. Cuando no se presente proteinuria en rango nefrótico, la decisión sobre brindar estas terapias debe ser individualizada y tomando en cuenta la presencia de otras manifestaciones lúpicas.
- Considere brindar pulsos de GC endovenosos teniendo en cuenta otras manifestaciones de la enfermedad.
BPC 3:
En adultos con NL clase III a V no refractarios en fase de inducción, primero brindar pulsos de GC endovenosos (metilprednisolona a 0.25-0.50 g/día o equivalentes durante uno a tres días) y luego brindar GC orales en combinación con algún inmunosupresor para disminuir las dosis acumuladas de GC.
BPC 4:
En adultos con NL clase I a V se podría considerar el uso de GC orales a dosis altas en casos especiales: en los que la gravedad de la enfermedad y/o la presencia de otras manifestaciones lúpicas hagan revalorar la decisión.
2. Terapia inicial de la fase de inducción: MMF vs CYC
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con NL clase III a IV no refractarios, sugerimos brindar -en combinación con glucocorticoides- MMF en lugar de CYC endovenosa, como terapia inicial de la fase de inducción. (Recomendación condicional a favor de la intervención, certeza baja de la evidencia)
Recomendación 2:
En adultos con NL clase V no refractarios, sugerimos brindar -en combinación con glucocorticoides- MMF en lugar de CYC endovenosa, como terapia inicial de la fase de inducción. (Recomendación condicional a favor de la intervención, certeza muy baja de la evidencia)
BPC 1:
Considerar la siguiente dosis de MMF: 2-3 g/día por vía oral durante seis meses.
BPC 2:
En adultos con NL clase III a V se podría considerar optar por el uso de CYC endovenosa como terapia inicial en casos especiales: cuando no se contemple el embarazo y/o cuando las comorbilidades, presencia de otras manifestaciones lúpicas o contraindicaciones a otros fármacos para inducción hagan revalorar esta decisión.
3. Dosis de ciclofosfamida
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con NL clase III a IV no refractarios, en quienes se decida iniciar la fase de inducción con CYC endovenosa en combinación con glucocorticoides, sugerimos brindar dosis bajas en lugar de dosis altas. (Recomendación condicional a favor de la intervención, certeza baja de la evidencia)
Recomendación 2:
En adultos con NL clase V no refractarios, en quienes se decida iniciar la fase de inducción con CYC endovenosa en combinación con glucocorticoides, sugerimos brindar CYC a dosis bajas o dosis altas. (Recomendación condicional a favor de ambas opciones, certeza muy baja de la evidencia)
BPC 1:
Considerar las siguientes dosis de CYC endovenosa:
- Dosis bajas: 0.5 g cada 15 días por vía endovenosa hasta completar seis dosis.
- Dosis altas: 0.5-1 g/m2/mes por vía endovenosa durante seis meses.
BPC 2:
En adultos con NL clase III a V se podría considerar el uso de CYC endovenosa a dosis altas en casos especiales: en los que la gravedad de la enfermedad y/o presencia de otras manifestaciones lúpicas hagan revalorar esta decisión.
BPC 3:
Cuando se brinde CYC endovenosa, ajustar la dosis en curso en caso se presente deterioro de la función renal y/o daño hepático severo.
4. Terapia inicial de la fase de inducción: TAC vs MMF o CYC
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con NL clase III a IV no refractarios, sugerimos brindar -en combinación con glucocorticoides- MMF en lugar de TAC, como terapia inicial de la fase de inducción. (Recomendación condicional a favor del control, certeza muy baja de la evidencia)
Recomendación 2:
En adultos con NL clase III a IV no refractarios, sugerimos brindar -en combinación con glucocorticoides- TAC o CYC endovenosa, como terapia inicial de la fase de inducción. (Recomendación condicional a favor de ambas opciones, certeza muy baja de la evidencia)
Recomendación 3:
En adultos con NL clase V no refractarios, sugerimos brindar -en combinación con glucocorticoides- MMF en lugar de TAC, como terapia inicial de la fase de inducción. (Recomendación condicional a favor del control, certeza muy baja de la evidencia)
BPC 1:
En adultos con NL clase III a IV, para elegir iniciar con TAC o CYC endovenosa considerar: contraindicaciones para el uso de alguno de estos fármacos, deseo de embarazo (preferir TAC), presencia de deterioro de la función renal (preferir CYC endovenosa), y otras manifestaciones lúpicas que orienten la decisión.
BPC 2:
Considerar lo siguiente respecto a la dosis de TAC:
- TAC: 0.05-0.15 mg/kg/día vía oral divido en dos dosis durante seis meses.
- Si es posible, dosar los niveles séricos de TAC para alcanzar una concentración de 6-10 ng/mL en el primer y segundo mes, y de 4-8 ng/mL en los meses restantes.
BPC 3:
En adultos con NL clase III a V se podría considerar el uso de TAC en lugar de MMF en casos especiales: cuando MMF este contraindicado, cuando el riesgo de herpes zoster implique consecuencias importantes para el paciente o para la continuidad del tratamiento, y/o cuando presencia de otras manifestaciones lúpicas hagan revalorar esta decisión.
5. Terapia inicial de la fase de inducción: TAC más MMF vs CYC
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con NL clase III a IV no refractarios, sugerimos brindar -en combinación con glucocorticoides- TAC más MMF [terapia multitarget] en lugar de CYC endovenosa, como terapia inicial de la fase de inducción. (Recomendación condicional a favor de la intervención, certeza baja de la evidencia)
Recomendación 2:
En adultos con NL clase V no refractarios, sugerimos brindar -en combinación con glucocorticoides- TAC más MMF [terapia multitarget] en lugar de CYC endovenosa, como terapia inicial de la fase de inducción. (Recomendación condicional a favor de la intervención, certeza baja de la evidencia)
BPC 1:
Considerar las siguientes dosis de la terapia multitarget:
- TAC: 2-4 mg/día vía oral durante seis meses.
- MMF: 0.5-1 g/día vía oral durante seis meses.
BPC 2:
En adultos con NL clase III a V se podría considerar el uso de CYC endovenosa en casos especiales: cuando TAC o MMF estén contraindicados, ante deterioro de la función renal, y/o presencia de otras manifestaciones lúpicas que hagan revalorar esta decisión.
6. Terapia inicial de la fase de mantenimiento
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con NL clase I a V no refractarios, sugerimos brindar -en combinación con glucocorticoides- MMF en lugar de AZA, como terapia inicial de la fase de mantenimiento. (Recomendación condicional a favor de la intervención, certeza muy baja de la evidencia)
BPC 1:
Considerar las siguientes dosis:
- MMF: 1-2 g/día por vía oral durante tres a cinco años.
- AZA: 1.5-2 mg/kg/día por vía oral durante tres a cinco años.
BPC 2:
En adultos con NL clase I a V se podría considerar el uso de AZA en casos especiales: cuando se contemple el embarazo y/o el MMF esté contraindicado.
BPC 3:
Durante la fase de mantenimiento continuar disminuyendo gradualmente la dosis de glucocorticoides (GC) a la mínima posible (prednisona ≤ 5 mg/día o equivalentes), excepto cuando otras manifestaciones lúpicas requieran administrar dosis mayores. Podría considerarse la descontinuación de los GC cuando la respuesta renal completa se mantenga por 12 meses o más pero esta decisión debe ser individualizada teniendo en cuenta la actividad de la enfermedad, y presencia de comorbilidades.
Referencias bibliográficas
- Anders HJ, Saxena R, Zhao MH, Parodis I, Salmon JE, Mohan C. Lupus nephritis. Nature reviews Disease primers. 2020;6(1):7.
- Kaul A, Gordon C, Crow MK, Touma Z, Urowitz MB, van Vollenhoven R, et al. Systemic lupus erythematosus. Nature reviews Disease primers. 2016;2:16039.
- Weening JJ, D’Agati VD, Schwartz MM, Seshan SV, Alpers CE, Appel GB, et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited. Kidney international. 2004;65(2):521-30.
- Pons-Estel BA, Bonfa E, Soriano ER, Cardiel MH, Izcovich A, Popoff F, et al. First Latin American clinical practice guidelines for the treatment of systemic lupus erythematosus: Latin American Group for the Study of Lupus (GLADEL, Grupo Latino Americano de Estudio del Lupus)-Pan-American League of Associations of Rheumatology (PANLAR). Annals of the rheumatic diseases. 2018;77(11):1549-57.
- Chen YE, Korbet SM, Katz RS, Schwartz MM, Lewis EJ. Value of a complete or partial remission in severe lupus nephritis. Clinical journal of the American Society of Nephrology : CJASN. 2008;3(1):46-53.
- Moroni G, Quaglini S, Gallelli B, Banfi G, Messa P, Ponticelli C. The long-term outcome of 93 patients with proliferative lupus nephritis. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association. 2007;22(9):2531-9.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica [Internet]. Lima, Perú: MINSA; 2015 [citado el 18 de diciembre de 2021]. Disponible en:
https://www.gob.pe/institucion/minsa/informes-publicaciones/314118-documento-tecnico-metodologia-para-la-elaboracion-de-guias-de-practica-clinica. - Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney international. 2021;100(4s):S1-s276.
- Ministerio de sanidad servicios sociales e igualdad de España. Guía de Práctica Clínica sobre Lupus Eritematoso Sistémico [Internet]. Madrid: Ministerio de sanidad; 2015 [citado el 30 de junio de 2021]. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2018/12/GPC_549_Lupus_SESCS_compl.pdf,.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Fanouriakis A, Kostopoulou M, Cheema K, Anders HJ, Aringer M, Bajema I, et al. 2019 Update of the Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of lupus nephritis. Annals of the rheumatic diseases. 2020;79(6):713-23.
- Reátegui-Sokolova C, Ugarte-Gil MF, Harvey GB, Wojdyla D, Pons-Estel GJ, Quintana R, et al. Predictors of renal damage in systemic lupus erythematous patients: data from a multiethnic, multinational Latin American lupus cohort (GLADEL). RMD open. 2020;6(3).
- Ugolini-Lopes MR, Seguro LPC, Castro MXF, Daffre D, Lopes AC, Borba EF, et al. Early proteinuria response: a valid real-life situation predictor of long-term lupus renal outcome in an ethnically diverse group with severe biopsy-proven nephritis? Lupus science & medicine. 2017;4(1):e000213.
- Dall’Era M, Cisternas MG, Smilek DE, Straub L, Houssiau FA, Cervera R, et al. Predictors of long-term renal outcome in lupus nephritis trials: lessons learned from the Euro-Lupus Nephritis cohort. Arthritis & rheumatology (Hoboken, NJ). 2015;67(5):1305-13.
- van Vollenhoven R, Voskuyl A, Bertsias G, Aranow C, Aringer M, Arnaud L, et al. A framework for remission in SLE: consensus findings from a large international task force on definitions of remission in SLE (DORIS). Annals of the rheumatic diseases. 2017;76(3):554-61.
- Klumb EM, Silva CA, Lanna CC, Sato EI, Borba EF, Brenol JC, et al. [Consensus of the Brazilian Society of Rheumatology for the diagnosis, management and treatment of lupus nephritis]. Revista brasileira de reumatologia. 2015;55(1):1-21.
- Mejía-Vilet JM, Ayoub I. The Use of Glucocorticoids in Lupus Nephritis: New Pathways for an Old Drug. Frontiers in medicine. 2021;8:622225.
- Tunnicliffe DJ, Palmer SC, Henderson L, Masson P, Craig JC, Tong A, et al. Immunosuppressive treatment for proliferative lupus nephritis. The Cochrane database of systematic reviews. 2018;6(6):Cd002922.
- Bharati J, Rathi M, Ramachandran R, Sharma A, Kumar V, Kohli HS, et al. Comparison of Two Steroid Regimens in Induction Therapy of Proliferative Lupus Nephritis: A Randomized Controlled Trial. Indian journal of nephrology. 2019;29(5):373-5.
- Ruiz-Irastorza G, Danza A, Perales I, Villar I, Garcia M, Delgado S, et al. Prednisone in lupus nephritis: how much is enough? Autoimmunity reviews. 2014;13(2):206-14.
- Barron KS, Person DA, Brewer EJ, Jr., Beale MG, Robson AM. Pulse methylprednisolone therapy in diffuse proliferative lupus nephritis. The Journal of pediatrics. 1982;101(1):137-41.
- Mok CC, Cheung TT, Lo WH. Minimal mesangial lupus nephritis: a systematic review. Scandinavian journal of rheumatology. 2010;39(3):181-9.
- Badsha H, Kong KO, Lian TY, Chan SP, Edwards CJ, Chng HH. Low-dose pulse methylprednisolone for systemic lupus erythematosus flares is efficacious and has a decreased risk of infectious complications. Lupus. 2002;11(8):508-13.
- Badsha H, Edwards CJ. Intravenous pulses of methylprednisolone for systemic lupus erythematosus. Seminars in arthritis and rheumatism. 2003;32(6):370-7.
- Fasano S, Gabriele Falcone L, La Montagna G, Valentini G. AB0498 Low Dose Pulse IV Methylprednisolone as Induction Therapy for Lupus Nephritis: A Preliminary Study. Annals of the rheumatic diseases. 2014;73(Suppl 2):971-2.
- Orth SR, Ritz E. The nephrotic syndrome. The New England journal of medicine. 1998;338(17):1202-11.
- Zhang H, Zhou M, Han X, Yang Y, Yu X. Mycophenolate mofetil in the treatment of Chinese patients with lupus nephritis: A PRISMA-compliant meta-analysis. Medicine. 2020;99(33):e21121.
- Thong KM, Chan TM. Infectious complications in lupus nephritis treatment: a systematic review and meta-analysis. Lupus. 2019;28(3):334-46.
- Tang KT, Tseng CH, Hsieh TY, Chen DY. Induction therapy for membranous lupus nephritis: a systematic review and network meta-analysis. International journal of rheumatic diseases. 2018;21(6):1163-72.
- Appel GB, Contreras G, Dooley MA, Ginzler EM, Isenberg D, Jayne D, et al. Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis. Journal of the American Society of Nephrology : JASN. 2009;20(5):1103-12.
- Tian M, Song X, Dong L, Xin X, Dong J. Systematic evaluation of different doses of cyclophosphamide induction therapy for lupus nephritis. Medicine. 2017;96(51):e9408.
- Bae SC, Lee YH. Comparative efficacy and safety of low-dose and high-dose cyclophosphamide as induction therapy for lupus nephritis: a network meta-analysis. Zeitschrift fur Rheumatologie. 2019;78(5):467-73.
- Hannah J, Casian A, D’Cruz D. Tacrolimus use in lupus nephritis: A systematic review and meta-analysis. Autoimmunity reviews. 2016;15(1):93-101.
- Krens SD, Lassche G, Jansman FGA, Desar IME, Lankheet NAG, Burger DM, et al. Dose recommendations for anticancer drugs in patients with renal or hepatic impairment. The Lancet Oncology. 2019;20(4):e200-e7.
- Haubitz M, Bohnenstengel F, Brunkhorst R, Schwab M, Hofmann U, Busse D. Cyclophosphamide pharmacokinetics and dose requirements in patients with renal insufficiency. Kidney international. 2002;61(4):1495-501.
- Yoon KH. Efficacy and cytokine modulating effects of tacrolimus in systemic lupus erythematosus: a review. Journal of biomedicine & biotechnology. 2010;2010:686480.
- Heidt S, Roelen DL, Eijsink C, Eikmans M, van Kooten C, Claas FH, et al. Calcineurin inhibitors affect B cell antibody responses indirectly by interfering with T cell help. Clinical and experimental immunology. 2010;159(2):199-207.
- Faul C, Donnelly M, Merscher-Gomez S, Chang YH, Franz S, Delfgaauw J, et al. The actin cytoskeleton of kidney podocytes is a direct target of the antiproteinuric effect of cyclosporine A. Nature medicine. 2008;14(9):931-8.
- Deng J, Huo D, Wu Q, Yang Z, Liao Y. A meta-analysis of randomized controlled trials comparing tacrolimus with intravenous cyclophosphamide in the induction treatment for lupus nephritis. The Tohoku journal of experimental medicine. 2012;227(4):281-8.
- Tian SY, Feldman BM, Beyene J, Brown PE, Uleryk EM, Silverman ED. Immunosuppressive therapies for the induction treatment of proliferative lupus nephritis: a systematic review and network metaanalysis. The Journal of rheumatology. 2014;41(10):1998-2007.
- Lee YH, Song GG. Relative efficacy and safety of tacrolimus, mycophenolate mofetil, and cyclophosphamide as induction therapy for lupus nephritis: a Bayesian network meta-analysis of randomized controlled trials. Lupus. 2015;24(14):1520-8.
- Singh JA, Hossain A, Kotb A, Wells GA. Comparative effectiveness of immunosuppressive drugs and corticosteroids for lupus nephritis: a systematic review and network meta-analysis. Systematic reviews. 2016;5(1):155.
- Singh JA, Hossain A, Kotb A, Wells G. Risk of serious infections with immunosuppressive drugs and glucocorticoids for lupus nephritis: a systematic review and network meta-analysis. BMC medicine. 2016;14(1):137.
- Zhou T, Lin S, Yang S, Lin W. Efficacy and safety of tacrolimus in induction therapy of patients with lupus nephritis. Drug design, development and therapy. 2019;13:857-69.
- Kostopoulou M, Fanouriakis A, Cheema K, Boletis J, Bertsias G, Jayne D, et al. Management of lupus nephritis: a systematic literature review informing the 2019 update of the joint EULAR and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations. RMD open. 2020;6(2).
- Yap DY, Yu X, Chen XM, Lu F, Chen N, Li XW, et al. Pilot 24 month study to compare mycophenolate mofetil and tacrolimus in the treatment of membranous lupus nephritis with nephrotic syndrome. Nephrology (Carlton, Vic). 2012;17(4):352-7.
- Mok CC, Ying KY, Yim CW, Siu YP, Tong KH, To CH, et al. Tacrolimus versus mycophenolate mofetil for induction therapy of lupus nephritis: a randomised controlled trial and long-term follow-up. Annals of the rheumatic diseases. 2016;75(1):30-6.
- Ekberg H, van Gelder T, Kaplan B, Bernasconi C. Relationship of tacrolimus exposure and mycophenolate mofetil dose with renal function after renal transplantation. Transplantation. 2011;92(1):82-7.
- Liu Z, Zhang H, Liu Z, Xing C, Fu P, Ni Z, et al. Multitarget therapy for induction treatment of lupus nephritis: a randomized trial. Ann Intern Med. 2015;162(1):18-26.
- Kraaij T, Bredewold OW, Trompet S, Huizinga TW, Rabelink TJ, de Craen AJ, et al. TAC-TIC use of tacrolimus-based regimens in lupus nephritis. Lupus science & medicine. 2016;3(1):e000169.
- Palmer SC, Tunnicliffe DJ, Singh-Grewal D, Mavridis D, Tonelli M, Johnson DW, et al. Induction and Maintenance Immunosuppression Treatment of Proliferative Lupus Nephritis: A Network Meta-analysis of Randomized Trials. American journal of kidney diseases : the official journal of the National Kidney Foundation. 2017;70(3):324-36.
- Deng J, Luo L, Zhu L, Xie H, xie H. Multitarget therapy versus intravenous cyclophosphamide in the induction treatment of lupus nephritis: a metaanalysis of randomized controlled trials. Turkish journal of medical sciences. 2018;48(5):901-10.
- Zhou T, Zhang X, Lin W, Lin S. Multitarget Therapy: An Effective and Safe Therapeutic Regimen for Lupus Nephritis. Journal of pharmacy & pharmaceutical sciences : a publication of the Canadian Society for Pharmaceutical Sciences, Societe canadienne des sciences pharmaceutiques. 2019;22(1):365-75.
- Brunner HI, Higgins GC, Klein-Gitelman MS, Lapidus SK, Olson JC, Onel K, et al. Minimal clinically important differences of disease activity indices in childhood-onset systemic lupus erythematosus. Arthritis care & research. 2010;62(7):950-9.
- Zhu B, Chen N, Lin Y, Ren H, Zhang W, Wang W, et al. Mycophenolate mofetil in induction and maintenance therapy of severe lupus nephritis: a meta-analysis of randomized controlled trials. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association. 2007;22(7):1933-42.
- Feng L, Deng J, Huo DM, Wu QY, Liao YH. Mycophenolate mofetil versus azathioprine as maintenance therapy for lupus nephritis: a meta-analysis. Nephrology (Carlton, Vic). 2013;18(2):104-10.
- Maneiro JR, Lopez-Canoa N, Salgado E, Gomez-Reino JJ. Maintenance therapy of lupus nephritis with mycophenolate or azathioprine: systematic review and meta-analysis. Rheumatology (Oxford, England). 2014;53(5):834-8.
- Tian SY, Feldman BM, Beyene J, Brown PE, Uleryk EM, Silverman ED. Immunosuppressive Therapies for the Maintenance Treatment of Proliferative Lupus Nephritis: A Systematic Review and Network Metaanalysis. The Journal of rheumatology. 2015;42(8):1392-400.
- Lee YH, Song GG. Comparative efficacy and safety of tacrolimus, mycophenolate mofetil, azathioprine, and cyclophosphamide as maintenance therapy for lupus nephritis : A Bayesian network meta-analysis of randomized controlled trials. Zeitschrift fur Rheumatologie. 2017;76(10):904-12.
- Singh JA, Hossain A, Kotb A, Oliveira A, Mudano AS, Grossman J, et al. Treatments for Lupus Nephritis: A Systematic Review and Network Metaanalysis. The Journal of rheumatology. 2016;43(10):1801-15.
- Deng J, Xie H, Zhu L, Luo L, Xie H. Maintenance therapy for lupus nephritis with mycophenolate mofetil or azathioprine. A meta-analysis Clinical nephrology. 2019;91(3):172-9.
- Moroni G, Gallelli B, Quaglini S, Banfi G, Rivolta E, Messa P, et al. Withdrawal of therapy in patients with proliferative lupus nephritis: long-term follow-up. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association. 2006;21(6):1541-8.
- Margherita Z, Enrico F, Marta LM, Roberto D, Micaela F, Mariele G, et al. Immunosuppressive therapy withdrawal after remission achievement in patients with lupus nephritis. Rheumatology (Oxford, England). 2021.
- Saavedra M, Sánchez A, Morales S, Ángeles U, Jara LJ. Azathioprine during pregnancy in systemic lupus erythematosus patients is not associated with poor fetal outcome. Clinical rheumatology. 2015;34(7):1211-6.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com