
GUÍA PRÁCTICA CLÍNICA: PARA EL TAMIZAJE, DIAGNÓSTICO Y TRATAMIENTO INICIAL DE CÁNCER DE PRÓSTATA LOCALIZADO Y LOCAMENTE AVANZADO (2021)
DESCARGAR
VERSIÓN
ARTÍCULO
DESCARGAR
VERSIÓN
EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN
CORTA
DESCARGAR RECOMENDACIONES
Y FLUJOGRAMAS
vacio
vacio
Ámbito
- El ámbito asistencial incluye los servicios o unidades de medicina general, medicina interna, urología, oncología, y radioterapia en lo que corresponda a cada nivel, de EsSalud.
Población y alcance
- Población: Varones mayores de 18 años con y sin factores de riesgo para cáncer de próstata. Varones con adenocarcinoma de próstata localizado y localmente avanzado de reciente diagnóstico, sensibles a la castración química, mayores de 18 años
- Alcance: prevención, diagnóstico y tratamiento de cáncer de próstata.
Autores
Expertos clínicos:
- Cuentas Jara, Mariano Jaime
- Codier Mariaca, Abel
- Velarde Ponce, Luis Alberto
- Romero Pinedo, Atilio Renan
- Livano Yberico, Teófilo
- Cuevas Muñoz, Nelson
- Broncano Huasasquiche, Oswaldo
Metodólogos:
- Goicochea Lugo, Sergio André
- Delgado Flores, Carolina Jaqueline
Coordinadores:
- Carrera Acosta, Lourdes del Rocío
- Santos Sánchez, Vladimir
- Salvador Salvador, Stefany
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
Flujograma 1. Flujograma para tamizaje y diagnóstico de varones con sospecha de cáncer de próstata
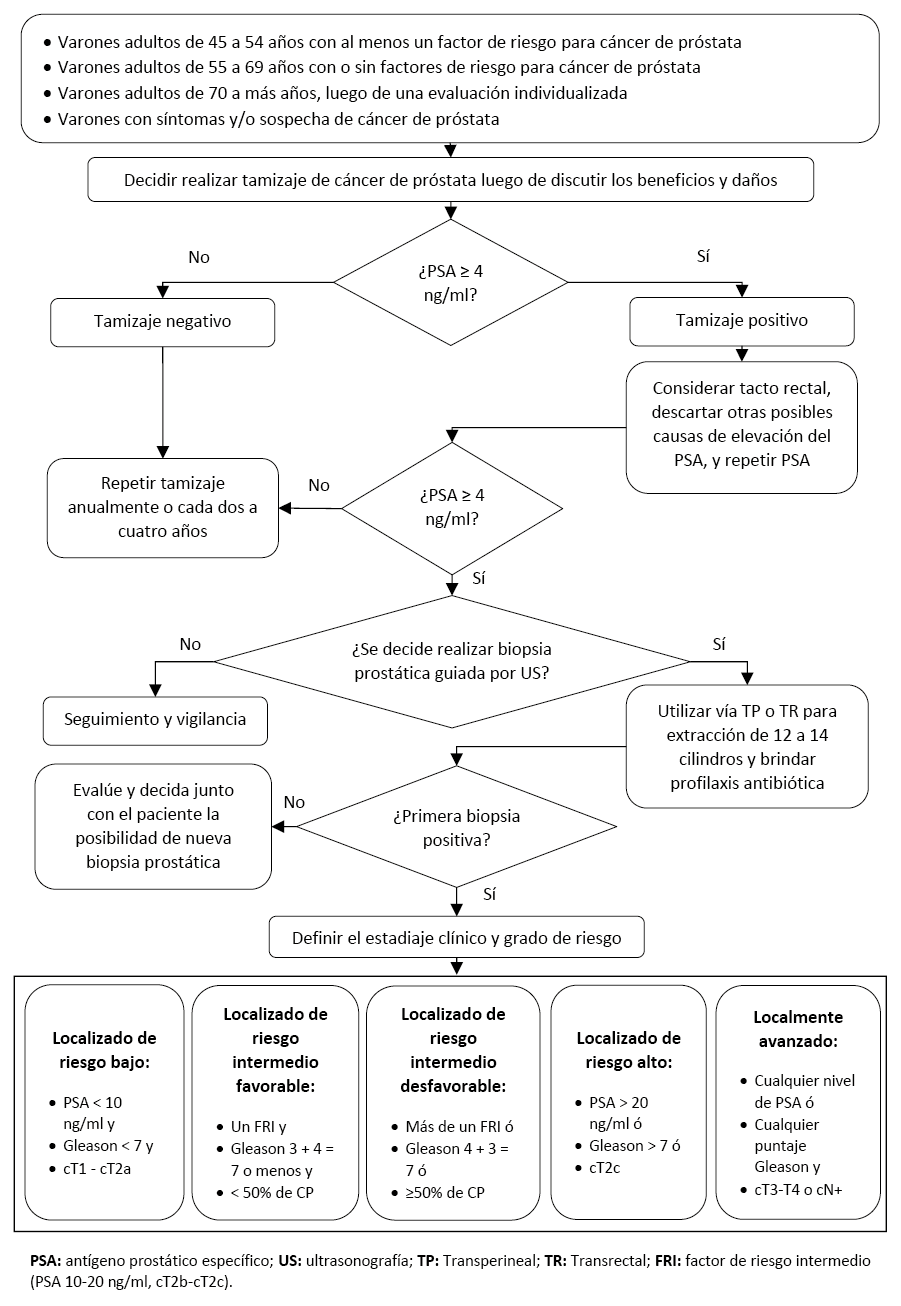
Flujograma 2. Flujograma de tratamiento inicial para pacientes con cáncer de próstata localizado de riesgo bajo
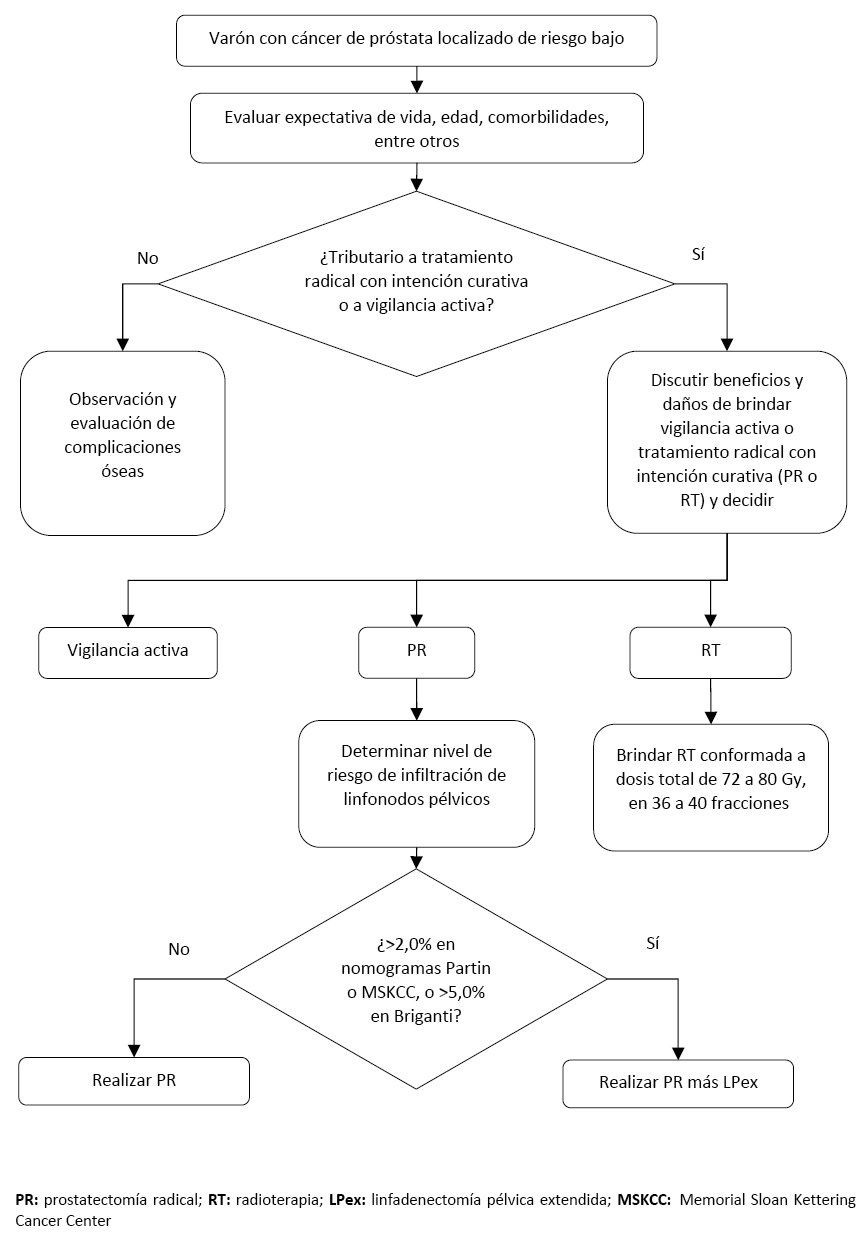
Flujograma 3. Flujograma de tratamiento inicial para pacientes con cáncer de próstata localizado de riesgo intermedio
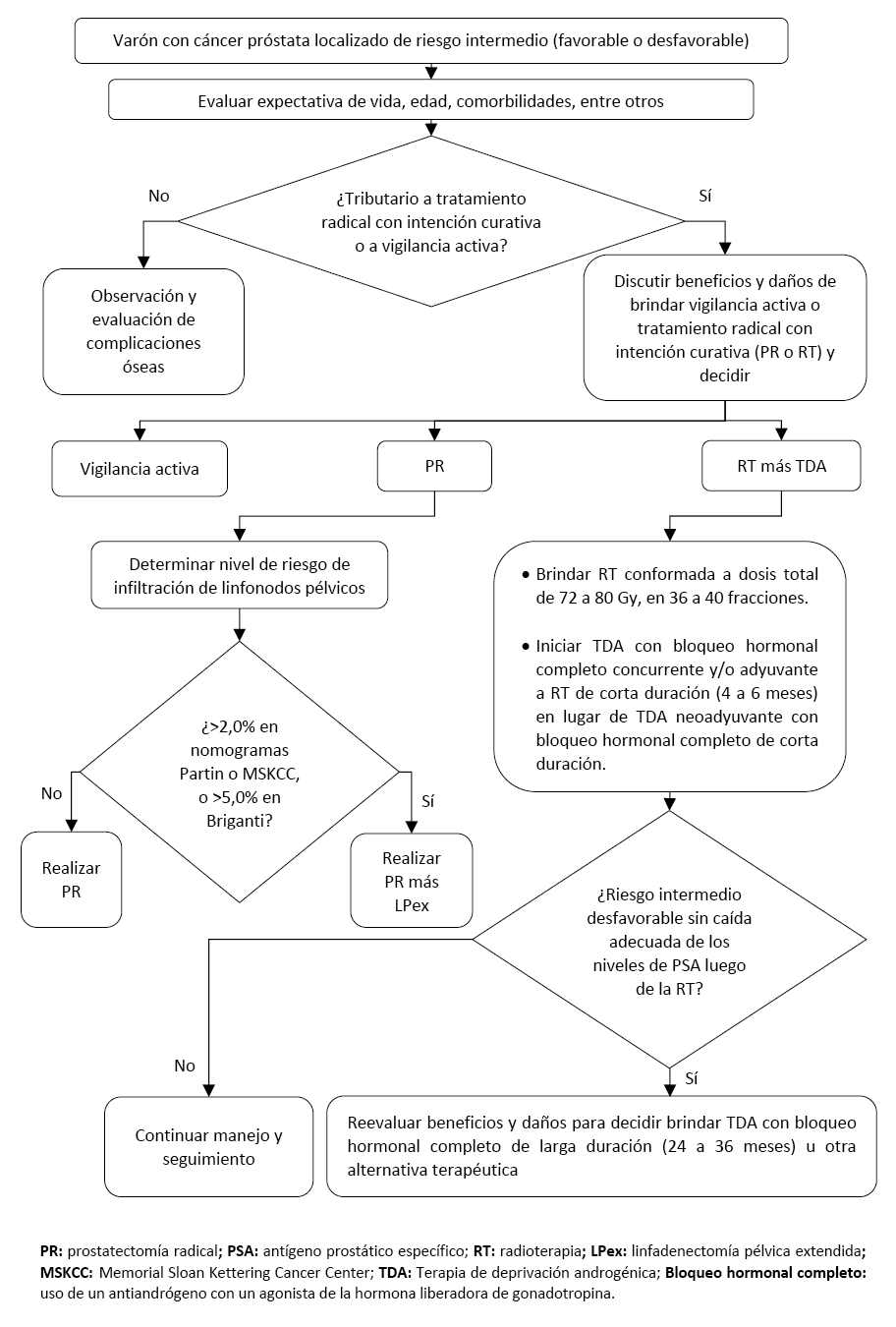
Flujograma 4. Flujograma de tratamiento inicial para pacientes con cáncer de próstata localizado de riesgo alto y localmente avanzado
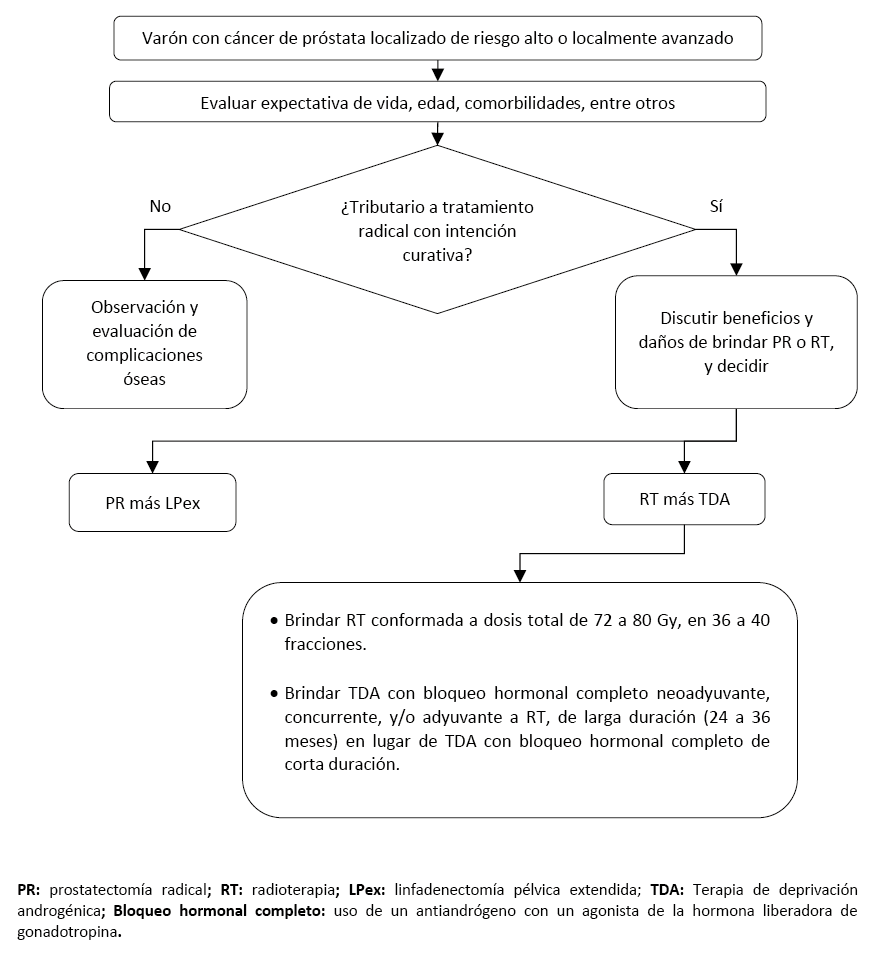
vacio
vacio
1. Tamizaje
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En varones adultos sin factores de riesgo para cáncer de próstata, sugerimos no realizar sistemáticamente el tamizaje de cáncer de próstata con antígeno prostático específico (Prostatic Specific Antigen, PSA) y/o tacto rectal. La decisión de realizar el tamizaje debe ser individualizada, luego de informar sobre los beneficios y daños al paciente. (Recomendación condicional en contra, certeza muy baja de la evidencia)
Recomendación 2:
En varones adultos con al menos un factor de riesgo para cáncer de próstata (afrodescendientes o historia familiar de cáncer de próstata), recomendamos realizar el tamizaje de cáncer de próstata con PSA, el cual se puede complementar con tacto rectal a criterio del médico tratante. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
BPC 1:
Respecto al grupo etario al cual brindar tamizaje:
- Informe sobre los beneficios y daños del tamizaje a varones partir de los 45 años si tienen algún factor de riesgo.
- Informe sobre los beneficios y daños del tamizaje a varones de entre 55 a 69 años sin factores de riesgo.
- Tome una decisión individualizada para ofrecer tamizaje a varones de 70 a más años, teniendo en cuenta las comorbilidades y expectativa de vida del paciente.
BPC 2:
En varones en quienes se decida realizar el tamizaje de cáncer de próstata y se obtenga un resultado negativo, considerar realizar el tamizaje anualmente o cada dos a cuatro años. Para decidir la frecuencia del tamizaje considere la presencia de factores de riesgo, y preferencias del paciente.
BPC 3:
Ante un resultado positivo en el tamizaje (PSA ≥ 4 ng/ml con o sin tacto rectal anormal), según los niveles de PSA y sintomatología del paciente, considere descartar otras posibles causas de elevación del PSA (infecciosas o inflamatorias como prostatitis, hiperplasia prostática benigna, e infección urinaria; y no infecciosas como instrumentación o cirugía reciente del tracto urinario) y repetir el tamizaje para confirmar el resultado.
2. Diagnóstico de Cáncer de Próstata
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En varones adultos con sospecha de cáncer de próstata, en quienes se decida realizar una primera biopsia guiada por ultrasonografía, sugerimos realizar la biopsia sistemática por vía TP o TR con extracción de 12 a 14 cilindros. (Recomendación condicional a favor de cualquiera de las intervenciones, certeza moderada de la evidencia)
BPC 1:
Considerar los siguientes criterios para decidir por alguno de los dos tipos de abordaje:
- Experiencia del profesional de salud en el uso de la vía de abordaje.
- Tolerabilidad al dolor del paciente.
- Presencia de factores de riesgo de sangrado (ej. uso de anticoagulantes o enfermedades predisponentes) o de infecciones (ej. diabetes mellitus, portadores de catéteres urinarios, prostatitis concurrente) del paciente.
- Presencia de los recursos humanos y logísticos necesarios para realizar el procedimiento.
BPC 2:
Antes de realizar la biopsia por vía TP o TR, brindar un esquema de profilaxis antibiótica de forma individualizada, tomando en cuenta la vía de abordaje para la biopsia, la sospecha de resistencia bacteriana a quinolonas, y las contraindicaciones para el uso de algún antibiótico.
3. Nomogramas para predecir probabilidad de compromiso ganglionar
escargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En varones adultos con cáncer de próstata localizado de riesgo bajo o intermedio, en quienes se decida realizar PR como primera opción terapéutica, sugerimos utilizar cualquiera de los tres nomogramas evaluados para predecir infiltración de linfonodos pélvicos, en el siguiente orden de preferencia:
- Briganti
- MSKCC
- Partin
(Recomendación condicional a favor de cualquiera de las tres pruebas diagnósticas, certeza muy baja de la evidencia)
BPC 1:
Considere realizar la PR más linfadenectomía pélvica cuando el riesgo de infiltración de linfonodos calculado por los nomogramas sean mayores a los siguientes puntos de corte:
- 5,0% cuando se utilice el nomograma Briganti
- 2,0% cuando se utilicen los nomogramas MSKCC o Partin
4. Linfadenectomía Extendida (LPex) o Linfadenectomía Estándar (LPe)
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En varones adultos con cáncer de próstata localizado de riesgo bajo, intermedio, alto o localmente avanzado, en quienes, como primera opción terapéutica, se decida realizar PR más LP dado el alto riesgo de infiltración linfática (˃ 2,0% con el nomograma MSKCC o Partin, o ˃ 5,0% con el nomograma Briganti), recomendamos realizar linfadenectomía pélvica extendida. (Recomendación fuerte a favor, certeza muy baja de la evidencia)
5. Terapia de Deprivación de Andrógenos (TDA) de larga duración vs corta duración
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En varones adultos con cáncer de próstata localizado de riesgo intermedio favorable o desfavorable, en quienes se decida brindar RT más TDA como opción terapéutica inicial, sugerimos brindar TDA con bloqueo hormonal completo de corta duración (4 a 6 meses) en lugar de TDA con bloqueo hormonal completo de larga duración (24 a 36 meses). (Recomendación condicional a favor, certeza baja de la evidencia)
Recomendación 2:
En varones adultos con cáncer de próstata localizado de riesgo alto o localmente avanzado, en quienes se decida brindar RT más TDA como opción terapéutica inicial, recomendamos brindar TDA con bloqueo hormonal completo de larga duración (24 a 36 meses) en lugar de TDA con bloqueo hormonal completo de corta duración (4 a 6 meses). (Recomendación fuerte a favor, certeza moderada de la evidencia)
BPC 1:
En aquellos varones con cáncer de próstata localizado de riesgo intermedio desfavorable que no tengan caída adecuada de los niveles de PSA (cercano a 0 ng/ml) luego de la RT más TDA, considerar reevaluar los beneficios y daños para decidir brindar TDA de larga duración (24 a 36 meses) u otra alternativa terapéutica.
BPC 2:
En varones adultos con cáncer de próstata localizado de riesgo intermedio o alto, o localmente avanzado, no sometidos a cirugía prostática, en quienes se decida brindar RT como opción terapéutica inicial, considere brindar RT conformada a dosis total de 72 a 80 Gy, en 36 a 40 fracciones.
BPC 3:
Considerar utilizar los siguientes fármacos y dosis para brindar TDA con bloqueo hormonal completo:
- Un agonista de la hormona liberadora de gonadotropina: acetato de leuprorelina 7,5 mg cada mes por vía IM o triptorelina 3,75 mg cada mes por vía IM.
- Un antiandrógeno: flutamida 250 mg cada 08 horas por VO o bicalutamida a 50 mg cada 24 horas por VO
6. Terapia de Deprivación de Andrógenos (TDA) neoadyuvante vs concurrente y/o adyuvante
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En varones adultos con cáncer de próstata localizado de riesgo intermedio (favorable o desfavorable), en quienes se decida brindar RT más TDA con bloqueo hormonal completo de corta duración, recomendamos iniciar la TDA de forma concurrente y/o adyuvante a la RT en lugar de iniciarla de forma neoadyuvante. (Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
En varones adultos con cáncer de próstata localizado de riesgo alto o localmente avanzado, en quienes se decida brindar RT más TDA con bloqueo hormonal completo de larga duración, la evidencia disponible al momento no permite emitir una recomendación sobre si se debiera iniciar la terapia hormonal de forma concurrente, adyuvante o neoadyuvante.
Referencias bibliográficas
- Rebello RJ, Oing C, Knudsen KE, Loeb S, Johnson DC, Reiter RE, et al. Prostate cancer. Nature reviews Disease primers. 2021;7(1):9.
- Parker C, Castro E, Fizazi K, Heidenreich A, Ost P, Procopio G, et al. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology : official journal of the European Society for Medical Oncology. 2020;31(9):1119-34.
- European Association U. European Association of Urology Guidelines. 2020 Edition. Arnhem, The Netherlands: European Association of Urology Guidelines Office; 2020.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Prostate Cancer, Version 2.2020 Pensilvania, EE.UU.2020 [cited 10 de marzo de 2021 10 de marzo de 2021]. Available from: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf.
- World Health Organization International Agency for Research on Cancer (IARC). GLOBOCAN 2020: estimated cancer incidence, mortality and prevalence worldwide in 2020: Global Cancer Observatory; 2020 [cited 11 de abril de 2021 11 de abril de 2021]. Available from: https://gco.iarc.fr/today/home.
- Oficina de Inteligencia e Información Sanitaria del Seguro Social de Salud. Informe preliminar de estimación de carga de enfermedad y lesiones en la población asegurada – ESSAALUD – 2018. 2020.
- Vidaurre T, Santos C, Gómez H, Sarria G, Amorin E, López M, et al. The implementation of the Plan Esperanza and response to the imPACT Review. The Lancet Oncology. 2017;18(10):e595-e606.
- Zafra-Tanaka JH, Tenorio-Mucha J, Villarreal-Zegarra D, Carrillo-Larco R, Bernabe-Ortiz A. Cancer-related mortality in Peru: Trends from 2003 to 2016. PloS one. 2020;15(2):e0228867.
- Zumsteg ZS, Zelefsky MJ, Woo KM, Spratt DE, Kollmeier MA, McBride S, et al. Unification of favourable intermediate-, unfavourable intermediate-, and very high-risk stratification criteria for prostate cancer. BJU international. 2017;120(5b):E87-e95.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ (Clinical research ed). 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ (Clinical research ed). 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ (Clinical research ed). 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ (Clinical research ed). 2016;353:i2089.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Tikkinen KAO, Dahm P, Lytvyn L, Heen AF, Vernooij RWM, Siemieniuk RAC, et al. Prostate cancer screening with prostate-specific antigen (PSA) test: a clinical practice guideline. BMJ (Clinical research ed). 2018;362:k3581.
- Djulbegovic M, Beyth RJ, Neuberger MM, Stoffs TL, Vieweg J, Djulbegovic B, et al. Screening for prostate cancer: systematic review and meta-analysis of randomised controlled trials. BMJ (Clinical research ed). 2010;341:c4543.
- Bailey SJ, Brewster SF. Prostate cancer: to screen or not to screen. Archivos espanoles de urologia. 2011;64(5):406-18.
- Lumen N, Fonteyne V, De Meerleert G, Ost P, Villeirs G, Mottrie A, et al. Population screening for prostate cancer: an overview of available studies and meta-analysis. International journal of urology : official journal of the Japanese Urological Association. 2012;19(2):100-8.
- Ilic D, Neuberger MM, Djulbegovic M, Dahm P. Screening for prostate cancer. The Cochrane database of systematic reviews. 2013(1):Cd004720.
- Hayes JH, Barry MJ. Screening for prostate cancer with the prostate-specific antigen test: a review of current evidence. Jama. 2014;311(11):1143-9.
- Pron G. Prostate-Specific Antigen (PSA)-Based Population Screening for Prostate Cancer: An Evidence-Based Analysis. Ontario health technology assessment series. 2015;15(10):1-64.
- Fenton JJ, Weyrich MS, Durbin S, Liu Y, Bang H, Melnikow J. Prostate-Specific Antigen-Based Screening for Prostate Cancer: Evidence Report and Systematic Review for the US Preventive Services Task Force. Jama. 2018;319(18):1914-31.
- Ilic D, Djulbegovic M, Jung JH, Hwang EC, Zhou Q, Cleves A, et al. Prostate cancer screening with prostate-specific antigen (PSA) test: a systematic review and meta-analysis. BMJ (Clinical research ed). 2018;362:k3519.
- Schröder FH, Hugosson J, Roobol MJ, Tammela TL, Zappa M, Nelen V, et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet (London, England). 2014;384(9959):2027-35.
- Martin RM, Donovan JL, Turner EL, Metcalfe C, Young GJ, Walsh EI, et al. Effect of a Low-Intensity PSA-Based Screening Intervention on Prostate Cancer Mortality: The CAP Randomized Clinical Trial. Jama. 2018;319(9):883-95.
- Booth N, Rissanen P, Tammela TL, Määttänen L, Taari K, Auvinen A. Health-related quality of life in the Finnish trial of screening for prostate cancer. European urology. 2014;65(1):39-47.
- National Comprehensive Cancer Network. NCCN Guidelines Insights: Prostate Cancer Early Detection, Version 2.2019. Pensilvania, EE.UU.2019 [cited 04 de marzo de 2021 04 de marzo de 2021]. Available from: https://www2.tri-kobe.org/nccn/guideline/urological/english/prostate_detection.pdf.
- Grossman DC, Curry SJ, Owens DK, Bibbins-Domingo K, Caughey AB, Davidson KW, et al. Screening for Prostate Cancer: US Preventive Services Task Force Recommendation Statement. Jama. 2018;319(18):1901-13.
- Jones D, Friend C, Dreher A, Allgar V, Macleod U. The diagnostic test accuracy of rectal examination for prostate cancer diagnosis in symptomatic patients: a systematic review. BMC Fam Pract. 2018;19(1):79.
- Naji L, Randhawa H, Sohani Z, Dennis B, Lautenbach D, Kavanagh O, et al. Digital Rectal Examination for Prostate Cancer Screening in Primary Care: A Systematic Review and Meta-Analysis. Annals of family medicine. 2018;16(2):149-54.
- Skouteris VM, Crawford ED, Mouraviev V, Arangua P, Metsinis MP, Skouteris M, et al. Transrectal Ultrasound-guided Versus Transperineal Mapping Prostate Biopsy: Complication Comparison. Reviews in urology. 2018;20(1):19-25.
- Di Franco CA, Jallous H, Porru D, Giliberto GL, Cebrelli T, Tinelli C, et al. A retrospective comparison between transrectal and transperineal prostate biopsy in the detection of prostate cancer. Archivio italiano di urologia, andrologia : organo ufficiale [di] Societa italiana di ecografia urologica e nefrologica. 2017;89(1):55-9.
- Abdollah F, Novara G, Briganti A, Scattoni V, Raber M, Roscigno M, et al. Trans-rectal versus trans-perineal saturation rebiopsy of the prostate: is there a difference in cancer detection rate? Urology. 2011;77(4):921-5.
- Shen PF, Zhu YC, Wei WR, Li YZ, Yang J, Li YT, et al. The results of transperineal versus transrectal prostate biopsy: a systematic review and meta-analysis. Asian journal of andrology. 2012;14(2):310-5.
- Xue J, Qin Z, Cai H, Zhang C, Li X, Xu W, et al. Comparison between transrectal and transperineal prostate biopsy for detection of prostate cancer: a meta-analysis and trial sequential analysis. Oncotarget. 2017;8(14):23322-36.
- Xiang J, Yan H, Li J, Wang X, Chen H, Zheng X. Transperineal versus transrectal prostate biopsy in the diagnosis of prostate cancer: a systematic review and meta-analysis. World journal of surgical oncology. 2019;17(1):31.
- Ministerio de Salud. Guía Clínica AUGE Cáncer de Próstata en personas de 15 años y más Chile: Subsecretaría de Salud Pública, división de Prevención y Control de Enfermedades, departamento de Manejo Integral de Cáncer y otros Tumores.; 2015 [Available from: https://diprece.minsal.cl/garantias-explicitas-en-salud-auge-o-ges/guias-de-practica-clinica/cancer-de-prostata/recomendaciones-grade/.
- American Urological Association. Early detection of prostate cancer: AUA guideline USA: American Urological Association Education and Research, Inc; 2018 [cited 10 de marzo de 2021 10 de marzo de 2021]. Available from: https://www.auanet.org/guidelines/prostate-cancer-early-detection-guideline.
- Brierley JD, Gospodarowicz MK, Wittekind C. TNM classification of malignant tumours: John Wiley & Sons; 2017.
- Cheung DC, Fleshner N, Sengupta S, Woon D. A narrative review of pelvic lymph node dissection in prostate cancer. Translational andrology and urology. 2020;9(6):3049-55.
- Cimino S, Reale G, Castelli T, Favilla V, Giardina R, Russo GI, et al. Comparison between Briganti, Partin and MSKCC tools in predicting positive lymph nodes in prostate cancer: a systematic review and meta-analysis. Scandinavian journal of urology. 2017;51(5):345-50.
- Fossati N, Willemse PM, Van den Broeck T, van den Bergh RCN, Yuan CY, Briers E, et al. The Benefits and Harms of Different Extents of Lymph Node Dissection During Radical Prostatectomy for Prostate Cancer: A Systematic Review. European urology. 2017;72(1):84-109.
- García-Perdomo HA, Correa-Ochoa JJ, Contreras-García R, Daneshmand S. Effectiveness of extended pelvic lymphadenectomy in the survival of prostate cancer: a systematic review and meta-analysis. Central European journal of urology. 2018;71(3):262-9.
- Choo MS, Kim M, Ku JH, Kwak C, Kim HH, Jeong CW. Extended versus Standard Pelvic Lymph Node Dissection in Radical Prostatectomy on Oncological and Functional Outcomes: A Systematic Review and Meta-Analysis. Annals of surgical oncology. 2017;24(7):2047-54.
- Rees T, Raison N, Sheikh MI, Jaffry Z, Madaan S, Challacombe B, et al. Is extended pelvic lymph node dissection for prostate cancer the only recommended option? A systematic over-view of the literature. Turkish journal of urology. 2016;42(4):240-6.
- Gao L, Yang L, Lv X, Bu S, Wan F, Qian S, et al. A systematic review and meta-analysis of comparative studies on the efficacy of extended pelvic lymph node dissection in patients with clinically localized prostatic carcinoma. Journal of cancer research and clinical oncology. 2014;140(2):243-56.
- Ji J YH, Wang L, Hou J.,. Retraction: “Is the impact of the extent of lymphadenectomy in radical prostatectomy related to the disease risk? A single center prospective study” J Surg Res 2012;178:779-784. The Journal of surgical research. 2014;189(2):373.
- Clark T, Parekh DJ, Cookson MS, Chang SS, Smith ER, Jr., Wells N, et al. Randomized prospective evaluation of extended versus limited lymph node dissection in patients with clinically localized prostate cancer. The Journal of urology. 2003;169(1):145-7; discussion 7-8.
- Schwerfeld-Bohr J, Kaemper M, Krege S, Heidenreich A, editors. Prospective randomized multicenter study comparing limited vs extended pelvic lymphadenectomy in intermediate and high risk prostate cancer-comparison of complications (SEAL, AUO AP 55/09). European Urology, Supplements Conference: 29th Annual Congress of the European Association of Urology, EAU Stockholm Sweden; 2014.
- Lestingi JFP, Guglielmetti GB, Trinh QD, Coelho RF, Pontes J, Jr., Bastos DA, et al. Extended Versus Limited Pelvic Lymph Node Dissection During Radical Prostatectomy for Intermediate- and High-risk Prostate Cancer: Early Oncological Outcomes from a Randomized Phase 3 Trial. European urology. 2020.
- Pignot G, Maillet D, Gross E, Barthelemy P, Beauval JB, Constans-Schlurmann F, et al. Systemic treatments for high-risk localized prostate cancer. Nature reviews Urology. 2018;15(8):498-510.
- Pagliarulo V, Bracarda S, Eisenberger MA, Mottet N, Schröder FH, Sternberg CN, et al. Contemporary role of androgen deprivation therapy for prostate cancer. European urology. 2012;61(1):11-25.
- Kumar S, Shelley M, Harrison C, Coles B, Wilt TJ, Mason MD. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. The Cochrane database of systematic reviews. 2006(4):Cd006019.
- Shelley MD, Kumar S, Wilt T, Staffurth J, Coles B, Mason MD. A systematic review and meta-analysis of randomised trials of neo-adjuvant hormone therapy for localised and locally advanced prostate carcinoma. Cancer treatment reviews. 2009;35(1):9-17.
- Hu J, Xu H, Zhu W, Wu F, Wang J, Ding Q, et al. Neo-adjuvant hormone therapy for non-metastatic prostate cancer: a systematic review and meta-analysis of 5,194 patients. World journal of surgical oncology. 2015;13:73.
- Xue J, Wang Y, Zheng Y, Zhang J, Qi F, Cheng H, et al. Efficacy characteristics of different therapeutic modalities for locally advanced prostate cancer: a Bayesian network meta-analysis of randomized controlled trials. Annals of translational medicine. 2018;6(18):358.
- Tosco L, Briganti A, D’Amico A V, Eastham J, Eisenberger M, Gleave M, et al. Systematic Review of Systemic Therapies and Therapeutic Combinations with Local Treatments for High-risk Localized Prostate Cancer. European urology. 2019;75(1):44-60.
- Moris L, Cumberbatch MG, Van den Broeck T, Gandaglia G, Fossati N, Kelly B, et al. Benefits and Risks of Primary Treatments for High-risk Localized and Locally Advanced Prostate Cancer: An International Multidisciplinary Systematic Review. European urology. 2020;77(5):614-27.
- Bekelman JE, Rumble RB, Chen RC, Pisansky TM, Finelli A, Feifer A, et al. Clinically Localized Prostate Cancer: ASCO Clinical Practice Guideline Endorsement of an American Urological Association/American Society for Radiation Oncology/Society of Urologic Oncology Guideline. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2018;36(32):3251-8.
- National Institute for Health and Care Excellence. Prostate cancer: diagnosis and management. NICE guideline [NG131] UK2019 [cited 11 de marzo de 2021 11 de marzo de 2021]. Available from: https://www.nice.org.uk/guidance/ng131.
- Zumsteg ZS, Zelefsky MJ. Short-term androgen deprivation therapy for patients with intermediate-risk prostate cancer undergoing dose-escalated radiotherapy: the standard of care? The Lancet Oncology. 2012;13(6):e259-69.
- Nguyen PL. Optimization of the Radiation Management of High-Risk Prostate Cancer. Seminars in radiation oncology. 2017;27(1):43-9.
- Leal F, Figueiredo MA, Sasse AD. Optimal duration of androgen deprivation therapy following radiation therapy in intermediate- or high-risk nonmetastatic prostate cancer: A systematic review and metaanalysis. International braz j urol : official journal of the Brazilian Society of Urology. 2015;41(3):425-34.
- Helgstrand JT, Berg KD, Lippert S, Brasso K, Røder MA. Systematic review: does endocrine therapy prolong survival in patients with prostate cancer? Scandinavian journal of urology. 2016;50(3):135-43.
- Bolla M, de Reijke TM, Van Tienhoven G, Van den Bergh AC, Oddens J, Poortmans PM, et al. Duration of androgen suppression in the treatment of prostate cancer. The New England journal of medicine. 2009;360(24):2516-27.
- Zapatero A, Guerrero A, Maldonado X, Alvarez A, Gonzalez San Segundo C, Cabeza Rodríguez MA, et al. High-dose radiotherapy with short-term or long-term androgen deprivation in localised prostate cancer (DART01/05 GICOR): a randomised, controlled, phase 3 trial. The Lancet Oncology. 2015;16(3):320-7.
- Mirhadi AJ, Zhang Q, Hanks GE, Lepor H, Grignon DJ, Peters CA, et al. Effect of Long-Term Hormonal Therapy (vs Short-Term Hormonal Therapy): A Secondary Analysis of Intermediate-Risk Prostate Cancer Patients Treated on NRG Oncology RTOG 9202. International journal of radiation oncology, biology, physics. 2017;97(3):511-5.
- Lawton CAF, Lin X, Hanks GE, Lepor H, Grignon DJ, Brereton HD, et al. Duration of Androgen Deprivation in Locally Advanced Prostate Cancer: Long-Term Update of NRG Oncology RTOG 9202. International journal of radiation oncology, biology, physics. 2017;98(2):296-303.
- Spratt DE, Malone S, Roy S, Grimes S, Eapen L, Morgan SC, et al. Prostate Radiotherapy With Adjuvant Androgen Deprivation Therapy (ADT) Improves Metastasis-Free Survival Compared to Neoadjuvant ADT: An Individual Patient Meta-Analysis. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2021;39(2):136-44.
- Bonkhoff H. Factors implicated in radiation therapy failure and radiosensitization of prostate cancer. Prostate cancer. 2012;2012:593241.
- Roach M, Moughan J, Lawton CAF, Dicker AP, Zeitzer KL, Gore EM, et al. Sequence of hormonal therapy and radiotherapy field size in unfavourable, localised prostate cancer (NRG/RTOG 9413): long-term results of a randomised, phase 3 trial. The Lancet Oncology. 2018;19(11):1504-15.
- Malone S, Roy S, Eapen L, E C, MacRae R, Perry G, et al. Sequencing of Androgen-Deprivation Therapy With External-Beam Radiotherapy in Localized Prostate Cancer: A Phase III Randomized Controlled Trial. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2020;38(6):593-601.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com

