GUÍA PRÁCTICA CLÍNICA:
PARA EL MANEJO DE Y TRATAMIENTO DE LA RETINOPATÍA DIABÉTICA Y EL EDEMA MACULAR DIABÉTICO (2019)
DESCARGAR
VERSIÓN
ARTÍCULO
DESCARGAR
VERSIÓN
EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN
CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: pacientes con retinopatía diabética y edema macular diabético.
- Alcance: diagnóstico y tratamiento de la retinopatía diabética y edema macular diabético.
Autores
Expertos clínicos:
- Cáceres del Carpio, Javier Héctor
- Quiroz Cerna, Doris Amparo
- Luján Donayre, Vanesa Cinthia
- Reátegui Escalante, Guillermo
- Escobedo Arriola, Robinson Richard
- García Rodríguez, Pedro Manuel
- Chacón Rosselló, Enrique Wenceslao
- Chahua Torres, Justina Yolanda
- Honorio Morales, Harvy Alberto
- Touzett Valera, Antonio Martín
- Shimabuku Ysa, Héctor Eduardo
Metodólogos:
- Montes Alvis, José Manuel
- Pacheco Barrios, Kevin Arturo
Coordinadores:
- Timaná Ruiz, Raúl Alonso
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
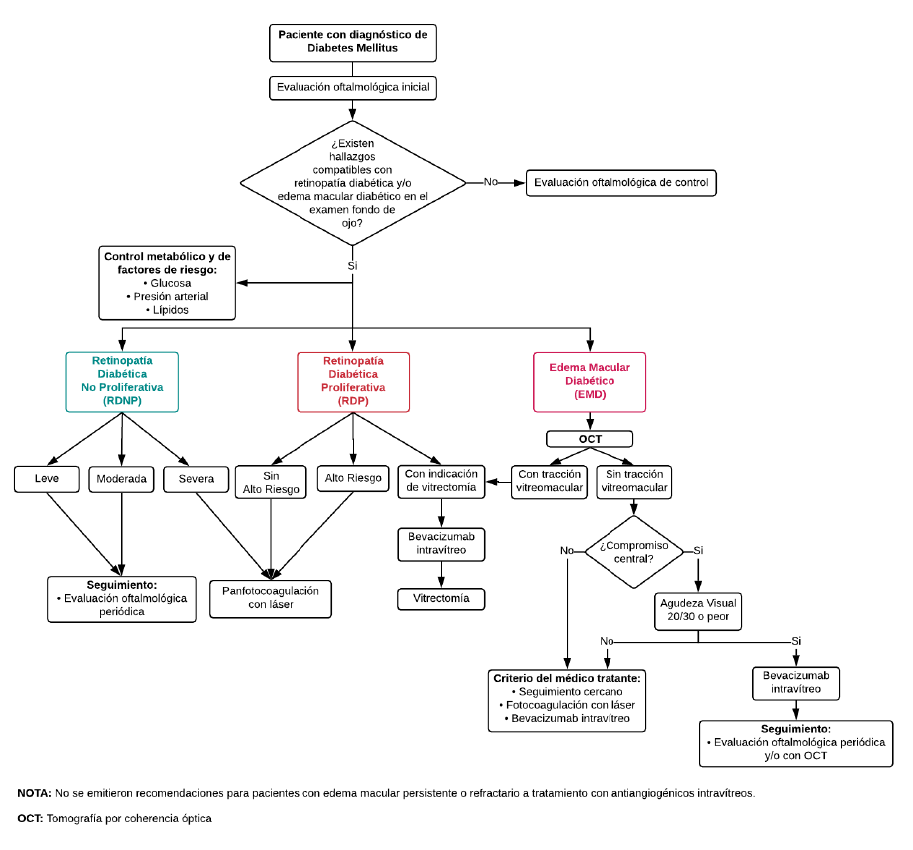
Flujogramas que resumen el contenido de la GPC
vacio
vacio
1. Diagnóstico
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En personas con RD y sospecha de EMD, recomendamos utilizar OCT para diagnosticar y clasificar el EMD. (Recomendación fuerte a favor, certeza baja de la evidencia)
BPC 1:
En personas con diabetes mellitus (DM), el diagnóstico de retinopatía diabética (RD) es clínico, mediante el examen de fondo de ojo dilatado por el médico oftalmólogo, sea en lámpara de hendidura con lupa 78D, 90D o por oftalmoscopía indirecta.
BPC 2:
En personas con DM, la evaluación oftalmológica realizada por un médico oftalmólogo debe incluir la anamnesis, evaluación de la agudeza visual, presión intraocular y la evaluación del segmento anterior que incluya la búsqueda de neovascularización en iris y ángulo; y examen de fondo de ojo con dilatación pupilar.
BPC 3:
En personas con DM, considerar realizar la evaluación oftalmológica inicial y de control según el siguiente esquema:

BPC 4:
En personas con DM, considerar el clasificar la retinopatía diabética según la Clasificación Internacional de Retinopatía Diabética.

BPC 5:
En personas con DM, se debe optimizar el control metabólico de la glucosa y de los factores de riesgo como presión arterial y lípidos séricos para reducir el riesgo o disminuir la progresión de la RD.
BPC 6:
En personas con DM, informar que la RD es una complicación crónica y progresiva pero un adecuado autocontrol metabólico (glucosa, presión arterial y lípidos), evaluación oftalmológica temprana y tratamiento oportuno pueden disminuir el riesgo de ceguera.
BPC 7:
En personas con RD, se sospecha de EMD cuando el paciente presenta engrosamiento de la retina y/o presencia de exudados duros en área macular o perimacular como hallazgo en el fondo de ojo con dilatación pupilar realizado por el médico oftalmólogo, sea en lámpara de hendidura con lupa 78D o 90D, o por oftalmoscopía indirecta.
BPC 8:
En personas con RD, considerar clasificar el EMD según la Clasificación Internacional de Edema Macular Diabético.

BPC 9:
En personas con RD, la AFG está indicada para confirmar la sospecha de neovascularización, identificar áreas de isquemia y planificar tratamiento láser a criterio del médico tratante.
BPC 10:
En personas con RD o con sospecha de EMD, considerar indicar AFG ante una disminución de la agudeza visual inexplicada.
BPC 11:
En pacientes tratados por EMD, el seguimiento puede incluir OCT a criterio de médico tratante.
BPC 12:
En personas con DM, considerar el indicar OCT ante una disminución de la agudeza visual inexplicada.
BPC 13:
En personas con DM, no solicitar OCT para tamizaje de RD o EMD.
BPC 14:
En personas con DM, no solicitar AFG para tamizaje de RD o EMD.
2. Panfotocoagulación con láser
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En personas con RDP, recomendamos administrar tratamiento con panfotocoagulación con láser. (Recomendación fuerte a favor, certeza baja de la evidencia)
Recomendación 2:
En personas con RDNP severa, sugerimos administrar tratamiento con panfotocoagulación con láser en pacientes de riesgo.(Recomendación condicional a favor, certeza baja de la evidencia)
BPC 1:
Se consideran pacientes con RDNP severa de riesgo si presentan alguna de las siguientes características: dificultad de seguimiento (ruralidad), mal control metabólico, algún grado de enfermedad renal crónica, presencia de retinopatía diabética proliferativa en el otro ojo, diabética en estado de gestación u otro criterio sustentado por el médico tratante.
BPC 2:
En personas con RD, la frecuencia con la que se realizará las evaluaciones oftalmológicas de seguimiento será definida por la severidad, presencia de signos de neovascularización u otros criterios sustentados por el médico tratante; considerando intervalos de tiempo según el siguiente esquema:

3. Antiangiogénicos intravítreos
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En personas con EMD con compromiso central y AV de 20/30 o peor, recomendamos administrar bevacizumab intravítreo como tratamiento de primera línea. (Recomendación fuerte a favor, certeza moderada de la evidencia)
Recomendación 2:
En personas con EMD con compromiso central, recomendamos no administrar corticoides intravítreos como tratamiento de primera línea. (Recomendación fuerte en contra, certeza baja de la evidencia)
BCP 1:
En personas con EMD sin compromiso central o AV mejor que 20/30, el tratamiento puede incluir seguimiento cercano, fotocoagulación con láser o bevacizumab intravítreo a criterio del médico tratante.
BCP 2:
Con respecto al uso de bevacizumab fuera de la etiqueta:
- Realizar el consentimiento informado antes de su aplicación.
- Aplicar 1.25 mg en 0.05 ml por inyección intravítrea.
- Seguir el protocolo de preparación y administración elaborado por IETSI EsSalud.
BCP 3:
En personas con EMD con evidencia de tracción vitreomacular y/o membrana epirretiniana mediante OCT, considerar realizar tratamiento con vitrectomía.
4. Antiangiogénicos intravítreos para vitrectomía
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con RDP con indicación de vitrectomía, sugerimos administrar bevacizumab intravítreo preoperatorio entre 3 a 7 días previos a la vitrectomía, considerando el riesgo de desprendimiento de retina traccional después de la inyección de antiangiogénico en dichos pacientes. (Recomendación condicional a favor, certeza baja de la evidencia)
Referencias bibliográficas
- Solomon SD, Chew E, Duh EJ, Sobrin L, Sun JK, VanderBeek BL, et al. Diabetic retinopathy: a position statement by the American Diabetes Association. Diabetes Care. 2017;40(3):412-8.
- Antonetti DA, Klein R, Gardner TW. Diabetic retinopathy. The New England journal of medicine. 2012;366(13):1227-39.
- Cheung N, Mitchell P, Wong TY. Diabetic retinopathy. Lancet (London, England). 2010;376(9735):124-36.
- Klein R, Lee KE, Gangnon RE, Klein BE. The 25-year incidence of visual impairment in type 1 diabetes mellitus the wisconsin epidemiologic study of diabetic retinopathy. Ophthalmology. 2010;117(1):63-70.
- Moss SE, Klein R, Klein BE. The 14-year incidence of visual loss in a diabetic population1. Ophthalmology. 1998;105(6):998-1003.
- Lee R, Wong TY, Sabanayagam C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye and vision (London, England). 2015;2:17.
- Wong TY, Sun J, Kawasaki R, Ruamviboonsuk P, Gupta N, Lansingh VC, et al. Guidelines on Diabetic Eye Care: The International Council of Ophthalmology Recommendations for Screening, Follow-up, Referral, and Treatment Based on Resource Settings. Ophthalmology. 2018;125(10):1608-22.
- Kusuhara S, Fukushima Y, Ogura S, Inoue N, Uemura A. Pathophysiology of Diabetic Retinopathy: The Old and the New. Diabetes & metabolism journal. 2018;42(5):364-76.
- Wong TY, Klein R, Islam FA, Cotch MF, Folsom AR, Klein BE, et al. Diabetic retinopathy in a multi-ethnic cohort in the United States. American journal of ophthalmology. 2006;141(3):446-55. e1.
- Simó R, Stitt AW, Gardner TW. Neurodegeneration in diabetic retinopathy: does it really matter? Diabetologia. 2018;61(9):1902-12.
- Rossing P, Hougaard P, Parving HH. Risk factors for development of incipient and overt diabetic nephropathy in type 1 diabetic patients: a 10-year prospective observational study. Diabetes care. 2002;25(5):859-64.
- Takagi M, Babazono T, Uchigata Y. Differences in risk factors for the onset of albuminuria and decrease in glomerular filtration rate in people with Type 2 diabetes mellitus: implications for the pathogenesis of diabetic kidney disease. Diabetic medicine : a journal of the British Diabetic Association. 2015;32(10):1354-60.
- Kramer CK, Rodrigues TC, Canani LH, Gross JL, Azevedo MJ. Diabetic retinopathy predicts all-cause mortality and cardiovascular events in both type 1 and 2 diabetes: meta-analysis of observational studies. Diabetes care. 2011;34(5):1238-44.
- Brownrigg JR, Hughes CO, Burleigh D, Karthikesalingam A, Patterson BO, Holt PJ, et al. Microvascular disease and risk of cardiovascular events among individuals with type 2 diabetes: a population-level cohort study. The lancet Diabetes & endocrinology. 2016;4(7):588-97.
- Cheung N, Rogers S, Couper DJ, Klein R, Sharrett AR, Wong TY. Is diabetic retinopathy an independent risk factor for ischemic stroke? Stroke. 2007;38(2):398-401.
- Kawasaki R, Tanaka S, Tanaka S, Abe S, Sone H, Yokote K, et al. Risk of cardiovascular diseases is increased even with mild diabetic retinopathy: the Japan Diabetes Complications Study. Ophthalmology. 2013;120(3):574-82.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ (Clinical research ed). 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Bandello F, Battaglia Parodi M, Lanzetta P, Loewenstein A, Massin P, Menchini F, et al. Diabetic Macular Edema. Developments in ophthalmology. 2017;58:102-38.
- Panozzo G, Gusson E, Parolini B, Mercanti A. Role of OCT in the diagnosis and follow up of diabetic macular edema. Seminars in ophthalmology. 2003;18(2):74-81.
- Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study research group. Archives of ophthalmology (Chicago, Ill : 1960). 1985;103(12):1796-806.
- Virgili G, Menchini F, Casazza G, Hogg R, Das RR, Wang X, et al. Optical coherence tomography (OCT) for detection of macular oedema in patients with diabetic retinopathy. The Cochrane Library. 2015.
- Panel. AAoORV. Preferred Practice Pattern® Guidelines. Diabetic Retinopathy. San Francisco, CA: American Academy of Ophthalmology; 2017. Available at: wwwaaoorg/ppp.
- Klein R, Klein BE, Moss SE, Davis MD, DeMets DL. The Wisconsin epidemiologic study of diabetic retinopathy. II. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Archives of ophthalmology (Chicago, Ill : 1960). 1984;102(4):520-6.
- Agardh E, Tababat-Khani P. Adopting 3-Year Screening Intervals for Sight-Threatening Retinal Vascular Lesions in Type 2 Diabetic Subjects Without Retinopathy. Diabetes Care. 2011;34(6):1318-9.
- Taype-Rondan A, Huapaya-Huertas O, Bendezu-Quispe G, Pacheco-Mendoza J, Bryce-Alberti M. Producción científica en diabetes en Perú: Un estudio bibliométrico. Revista chilena de nutrición. 2017;44(2):153-60.
- Effect of pregnancy on microvascular complications in the diabetes control and complications trial. The Diabetes Control and Complications Trial Research Group. Diabetes Care. 2000;23(8):1084-91.
- Axer-Siegel R, Hod M, Fink-Cohen S, Kramer M, Weinberger D, Schindel B, et al. Diabetic retinopathy during pregnancy. Ophthalmology. 1996;103(11):1815-9.
- Gunderson EP, Lewis CE, Tsai A-L, Chiang V, Carnethon M, Quesenberry CP, et al. A 20-Year Prospective Study of Childbearing and Incidence of Diabetes in Young Women, Controlling for Glycemia Before Conception. The Coronary Artery Risk Development in Young Adults (CARDIA) Study. 2007;56(12):2990-6.
- Harris Nwanyanwu K, Talwar N, Gardner TW, Wrobel JS, Herman WH, Stein JD. Predicting Development of Proliferative Diabetic Retinopathy. Diabetes Care. 2013;36(6):1562-8.
- Leske MC, Wu SY, Hennis A, Hyman L, Nemesure B, Yang L, et al. Hyperglycemia, blood pressure, and the 9-year incidence of diabetic retinopathy: the Barbados Eye Studies. Ophthalmology. 2005;112(5):799-805.
- Chew EY, Davis MD, Danis RP, Lovato JF, Perdue LH, Greven C, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes: the Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophthalmology. 2014;121(12):2443-51.
- Progression of retinopathy with intensive versus conventional treatment in the Diabetes Control and Complications Trial. Diabetes Control and Complications Trial Research Group. Ophthalmology. 1995;102(4):647-61.
- Chew EY, Ambrosius WT, Davis MD, Danis RP, Gangaputra S, Greven CM, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes. The New England journal of medicine. 2010;363(3):233-44.
- Aiello LP, Sun W, Das A, Gangaputra S, Kiss S, Klein R, et al. Intensive diabetes therapy and ocular surgery in type 1 diabetes. The New England journal of medicine. 2015;372(18):1722-33.
- Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. BMJ. 1998;317(7160):703-13.
- Keech AC, Mitchell P, Summanen PA, O’Day J, Davis TM, Moffitt MS, et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomised controlled trial. Lancet (London, England). 2007;370(9600):1687-97.
- Diabetes Advocacy: Standards of Medical Care in Diabetes-2018. Diabetes care. 2018;41(Suppl 1):S152-s3.
- Curtis TM, Gardiner TA, Stitt AW. Microvascular lesions of diabetic retinopathy: clues towards understanding pathogenesis? Eye (London, England). 2009;23(7):1496-508.
- Ferrara N. Vascular endothelial growth factor: basic science and clinical progress. Endocrine reviews. 2004;25(4):581-611.
- Chappelow AV, Tan K, Waheed NK, Kaiser PK. Panretinal photocoagulation for proliferative diabetic retinopathy: pattern scan laser versus argon laser. American journal of ophthalmology. 2012;153(1):137-42.e2.
- Evans JR, Michelessi M, Virgili G. Laser photocoagulation for proliferative diabetic retinopathy. The Cochrane database of systematic reviews. 2014(11):Cd011234.
- Hercules BL, Gayed, II, Lucas SB, Jeacock J. Peripheral retinal ablation in the treatment of proliferative diabetic retinopathy: a three-year interim report of a randomised, controlled study using the argon laser. The British journal of ophthalmology. 1977;61(9):555-63.
- Yassur Y, Pickle LW, Fine SL, Singerman L, Orth DH, Patz A. Optic disc neovascularisation in diabetic retinopathy: II. Natural history and results of photocoagulation treatment. The British journal of ophthalmology. 1980;64(2):77-86.
- Photocoagulation treatment of proliferative diabetic retinopathy: relationship of adverse treatment effects to retinopathy severity. Diabetic retinopathy study report no. 5. Developments in ophthalmology. 1981;2:248-61.
- Early photocoagulation for diabetic retinopathy. ETDRS report number 9. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology. 1991;98(5 Suppl):766-85.
- Sato Y, Kojimahara N, Kitano S, Kato S, Ando N, Yamaguchi N, et al. Multicenter randomized clinical trial of retinal photocoagulation for preproliferative diabetic retinopathy. Japanese journal of ophthalmology. 2012;56(1):52-9.
- Takamura Y, Ohkoshi K, Murata T. New Strategies for Treatment of Diabetic Macular Edema. Journal of ophthalmology. 2018;2018.
- Fogli S, Mogavero S, Egan CG, Del Re M, Danesi R. Pathophysiology and pharmacological targets of VEGF in diabetic macular edema. Pharmacological research. 2016;103:149-57.
- Klaassen I, Van Noorden CJ, Schlingemann RO. Molecular basis of the inner blood-retinal barrier and its breakdown in diabetic macular edema and other pathological conditions. Progress in retinal and eye research. 2013;34:19-48.
- Titchenell PM, Lin CM, Keil JM, Sundstrom JM, Smith CD, Antonetti DA. Novel atypical PKC inhibitors prevent vascular endothelial growth factor-induced blood-retinal barrier dysfunction. The Biochemical journal. 2012;446(3):455-67.
- Virgili G, Parravano M, Evans JR, Gordon I, Lucenteforte E. Anti-vascular endothelial growth factor for diabetic macular oedema: a network meta-analysis. The Cochrane database of systematic reviews. 2018;10:Cd007419.
- Mehta H, Hennings C, Gillies MC, Nguyen V, Campain A, Fraser-Bell S. Anti-vascular endothelial growth factor combined with intravitreal steroids for diabetic macular oedema. The Cochrane database of systematic reviews. 2018;4:Cd011599.
- Oellers P, Mahmoud TH. Surgery for proliferative diabetic retinopathy: new tips and tricks. Journal of ophthalmic & vision research. 2016;11(1):93.
- Yau GL, Silva PS, Arrigg PG, Sun JK, editors. Postoperative Complications of Pars Plana Vitrectomy for Diabetic Retinal Disease. Seminars in ophthalmology; 2018: Taylor & Francis.
- Morera Y, González R, Lamdan H, Pérez L, González Y, Agüero J, et al. Vaccination with a mutated variant of human Vascular Endothelial Growth Factor (VEGF) blocks VEGF-induced retinal neovascularization in a rabbit experimental model. Experimental eye research. 2014;122:102-9.
- Smith JM, Steel DH. Anti-vascular endothelial growth factor for prevention of postoperative vitreous cavity haemorrhage after vitrectomy for proliferative diabetic retinopathy. The Cochrane database of systematic reviews. 2015(8):Cd008214.
- Zhao XY, Xia S, Chen YX. Antivascular endothelial growth factor agents pretreatment before vitrectomy for complicated proliferative diabetic retinopathy: a meta-analysis of randomised controlled trials. The British journal of ophthalmology. 2018;102(8):1077-85.
- Osaadon P, Fagan XJ, Lifshitz T, Levy J. A review of anti-VEGF agents for proliferative diabetic retinopathy. Eye (London, England). 2014;28(5):510-20.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com