DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población:
Niños mayores a 5 años y adolescentes con crisis asmática. - Usuarios:
Esta GPC está dirigida al personal médico y no médico, que participa en la atención multidisciplinaria de niños y adolescentes con crisis asmática. Las recomendaciones serán aplicadas por médicos generales, pediatras, neumólogos, emergenciólogos, internistas, intensivistas, médicos residentes de las diversas especialidades, médicos gestores, enfermeros y personal técnico. Asimismo, podrá ser utilizada como referencia por estudiantes de profesiones relacionadas al ámbito de la salud y pacientes.
Autores
Grupo elaborador
Expertos clínicos:
- Dávila Edquén, Yojana Elizabeth.
Médico pediatra
Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú - Alvarado Gamarra, Giancarlo.
Médico pediatra
Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú - Trujillo Aranda, Pedro.
Médico pediatra
Hospital II Vitarte, EsSalud, Lima, Perú - Torres Sánchez, Juan Alexander.
Médico neumólogo pediatra
Hospital III, EsSalud, Chimbote, Perú - Ramírez Macedo, Eduardo.
Médico neumólogo pediatra
Hospital Nacional Guillermo Almenara Irigoyen, EsSalud, Lima, Perú - Zapata Tasayco, Ysabel.
Médico neumóloga pediatra
Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú - Lope Tenorio, Adanida Flor.
Médico pediatra
Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
Metodólogos:
- Chávez Rimache, Lesly Karem.
Metodóloga
IETSI, EsSalud, Lima, Perú - Delgado Flores, Carolina.
Metodóloga
IETSI, EsSalud, Lima, Perú - Mendoza Aucaruri, Liz.
Metodóloga
IETSI, EsSalud, Lima, Perú - Rivera Torrejón, Oscar.
Metodólogo
IETSI, EsSalud, Lima, Perú - Salvador Salvador, Stefany.
Metodóloga
IETSI, EsSalud, Lima, Perú
Gestores:
- Zeta Ruiz, Nieves del Milagro.
Coordinador para evaluación de adherencia de la guía de práctica clínica
IETSI, EsSalud, Lima, Perú - Santos Sánchez, Vladimir.
Coordinador del grupo elaborador
IETSI, EsSalud, Lima, Perú
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
Flujogramas que resumen el contenido de la GPC
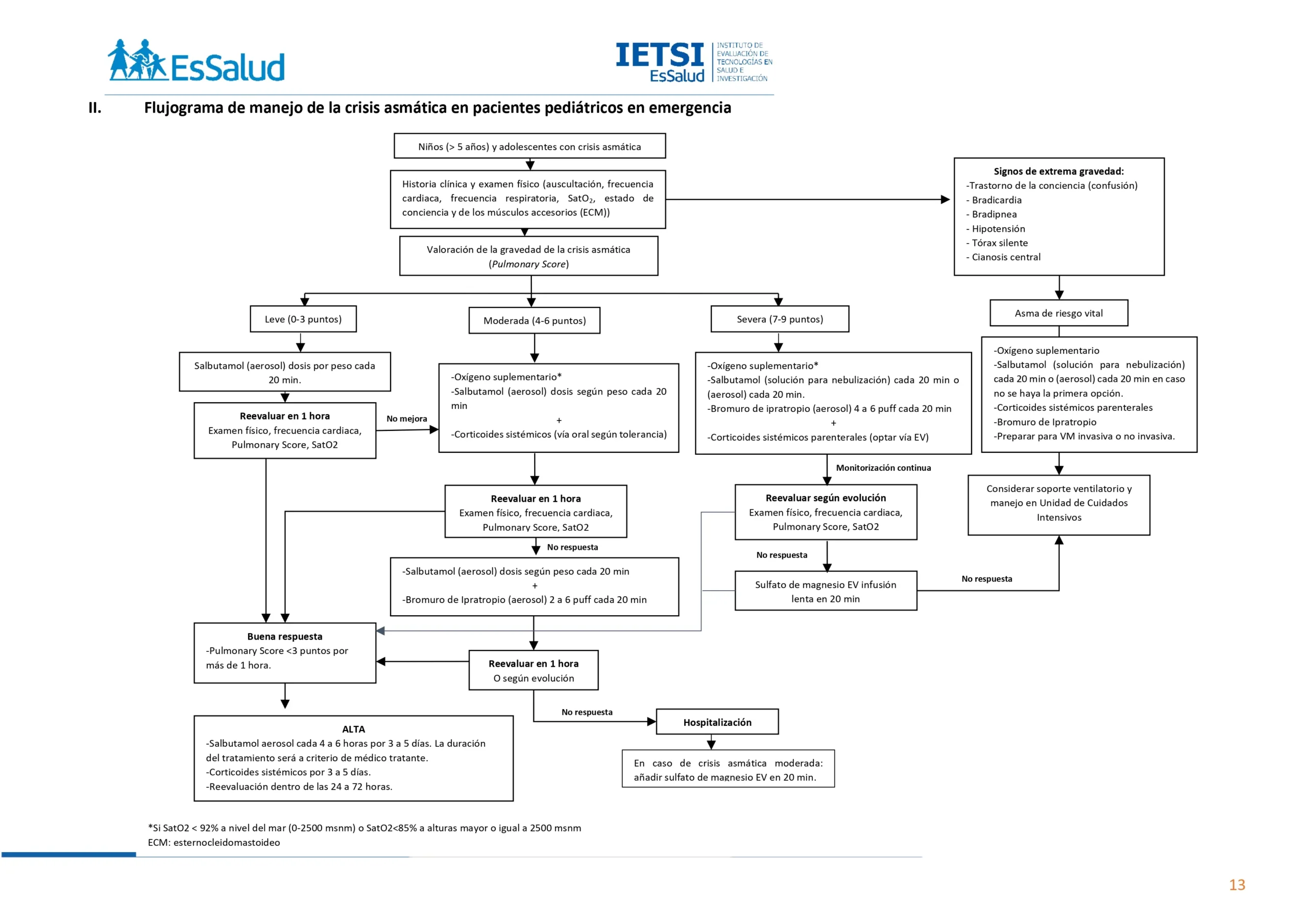
vacio
vacio
1. Índice clínico de gravedad
Descargar PDF con el desarrollo de la pregunta.
BPC 1:
En niños y adolescentes con crisis asmática, considerar emplear el Pulmonary Score para evaluar la gravedad de la crisis asmática antes de iniciar el tratamiento.
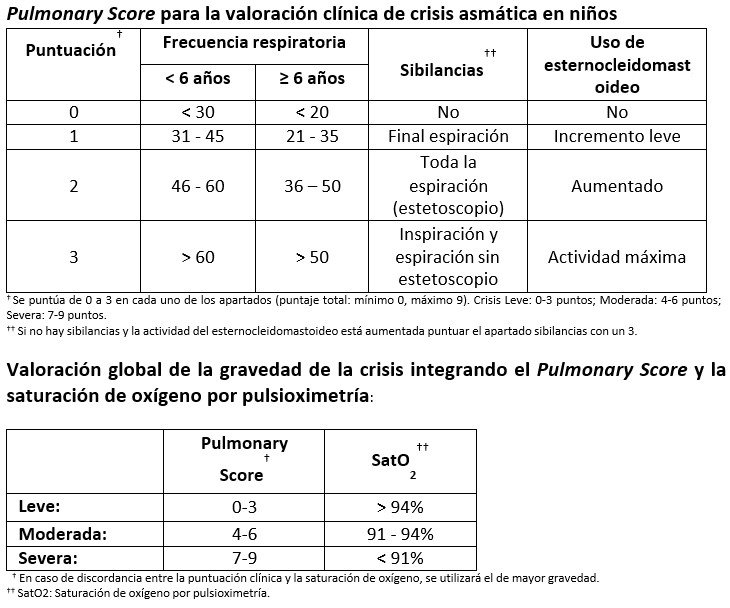
El GEG consideró importante mencionar que el manejo de los pacientes con crisis asmática debe evaluarse de forma integral tomando como referencia los valores del Pulmonary Score. Se considerará una crisis leve de 0 a 3 puntos, crisis moderada de 4 a 6 puntos, y una crisis severa de 7 a 9 puntos.
BPC 2:
En niños y adolescentes con crisis asmática, incluir en la historia clínica: el tiempo desde el inicio de la crisis asmática, medicación reciente y antecedentes relacionados al asma (crisis asmática a repetición, hospitalización por crisis asmática en el último año o uso actual de corticoide
inhalado o sistémico como terapia de mantenimiento).
BPC 3:
En niños y adolescentes con crisis asmática, catalogar como asma de riesgo vital cuando presenten uno o más de los siguientes signos de gravedad:
Trastorno de conciencia (confusión)
Bradicardia
Bradipnea
Hipotensión
Tórax silente
Cianosis central
Además, se consideró algunos criterios adicionales para identificar a un paciente con asma de riesgo vital como el antecedente de tratamiento en la unidad de cuidados intensivos o necesidad de soporte ventilatorio y
aquellos que tengan una rápida progresión de la crisis asmática.
BPC 4:
En niños y adolescentes con crisis asmática, monitorizar la frecuencia cardiaca, frecuencia respiratoria, uso de músculos accesorios (esternocleidomastoideo), presencia de sibilancias, nivel de conciencia y saturación de oxígeno; con la finalidad de evaluar la gravedad y la respuesta
al tratamiento.
BPC 5:
En niños y adolescentes con crisis asmática severa o que no respondan de forma adecuada al tratamiento inicial, en caso sea posible, considerar la realización de un análisis de gases arteriales como parte de la detección de insuficiencia respiratoria temprana conjuntamente con la evaluación clínica
de los pacientes.
BPC 6:
En niños y adolescentes con crisis asmática catalogados como asma de riesgo vital, considerar brindar soporte ventilatorio (ventilación no invasiva
con presión positiva o intubación endotraqueal según capacidad resolutiva).
2. Agonistas β2 con inhalador de dosis medida con espaciador vs nebulización
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En niños y adolescentes con crisis asmática leve, recomendamos usar como técnica inhalatoria para la administración de los agonistas B2 el inhalador de dosis medida con espaciador.
(Recomendación fuerte a favor Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática leve, indicar terapia inhalatoria con salbutamol de acuerdo con su peso cada 20 minutos. Esto se realizará a criterio del médico tratante considerando las siguientes dosis máximas del salbutamol:
• <20 kg: 500 mcg/dosis (5 puffs de 100 mcg/puff)
• ≥20 kg: 1000 mcg/dosis (10 puffs de 100 mcg/puff)
BPC 2:
En niños y adolescentes con crisis asmática leve que no respondan al tratamiento inicial luego de 1 hora, continuar el manejo como si fuera una
crisis asmática moderada.
BPC 3:
En niños y adolescentes con crisis asmática leve con buena respuesta al tratamiento inicial, mantener terapia inhalatoria con salbutamol 2 puff cada 4 a 6 horas por 3 a 5 días y luego reevaluación. La duración del tratamiento será según reevaluación a criterio de médico tratante.
Recomendación 2:
En niños y adolescentes con crisis asmática moderada, sugerimos usar como técnica inhalatoria para la administración de los agonistas B2 el inhalador de dosis medida con espaciador.
(Recomendación condicional a favor, Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática moderada, indicar terapia inhalatoria con salbutamol de acuerdo con su peso cada 20 minutos por 1 hora. Esto se realizará a criterio del médico tratante considerando las siguientes dosis máximas del salbutamol:
• <20 kg: 500 mcg/dosis (5 puffs de 100 mcg/puff)
• ≥20 kg: 1000 mcg/dosis (10 puffs de 100 mcg/puff)
Recomendación 3:
En niños y adolescentes con crisis asmática severa, sugerimos realizar la nebulización con salbutamol o terapia inhalatoria con aerocámara o espaciador.
(Recomendación condicional a favor, Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática severa, considerar nebulización con salbutamol (2.5 a 5 mg/dosis) cada 20 minutos o terapia inhalatoria con aerocámara o espaciador (según dosis por peso) cada 20 minutos. Esto se realizará a criterio del médico tratante considerando las siguientes dosis máximas del salbutamol:
• <20 kg: 500 mcg/dosis (5 puffs de 100 mcg/puff)
• ≥20 kg: 1000 mcg/dosis (10 puffs de 100 mcg/puff)
BPC 2:
En niños y adolescentes con crisis asmática de riesgo vital, considerar nebulización con salbutamol (2.5 a 5 mg/dosis) cada 20 minutos o terapia inhalatoria con aerocámara o espaciador (según dosis por peso) cada 20 minutos en caso no hubiera la primera opción.
BPC 3:
En niños y adolescentes con crisis asmática de riesgo vital o con SatO2 ≤ 92% a nivel del mar (0-2500 msnm), administrar oxígeno suplementario a través de una mascarilla o una cánula nasal con la cantidad necesaria para mantener una SatO2 > 92%.
BPC 4:
En niños y adolescentes con crisis asmática de riesgo vital o con SatO2 ≤ 85% a alturas mayores a 2500 msnm, administrar oxígeno suplementario a través de una mascarilla o una cánula nasal con la cantidad necesaria para mantener una SatO2 > 85%.
3. Corticoides sistémicos vs inhalados
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En niños y adolescentes con crisis asmática leve, en caso de brindar corticoides, sugerimos brindar corticoides sistémicos en lugar de los corticoides inhalados.
(Recomendación condicional a favor, Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática leve, en caso brindar corticoterapia, brindar prednisona o prednisolona, según disponibilidad, a la dosis de:
• Niños de 5 años dar de 1 a 2 mg/kg/día (máximo 30mg/día) por 3 a 5 días.
• Niños de 6 a 11 años dar de 1 a 2 mg/kg/día (máximo 40mg/día) por 3 a 5 días.
Recomendación 2:
En niños y adolescentes con crisis asmática moderada, en caso de brindar corticoides, sugerimos brindar corticoides sistémicos en lugar de los corticoides inhalados.
(Recomendación condicional a favor, Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática leve o moderada, en caso de brindar corticoides sistémicos, optar por la vía oral de acuerdo con la
evaluación del paciente.
Recomendación 3:
En niños y adolescentes con crisis asmática severa, sugerimos brindar corticoides sistémicos en lugar de los corticoides inhalados.
(Recomendación condicional a favor, Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática moderada o severa, cuando se dé corticoterapia, brindar el medicamento disponible en la institución y que
mejor se adapte al paciente.
BPC 2:
En niños y adolescentes con crisis asmática severa, en caso de brindar corticoides sistémicos, optar por la vía endovenosa.
BPC 3:
En niños y adolescentes con crisis asmática leve o moderada (no hospitalizado), considerar tratamiento con corticoides por un máximo de 5
días.
BPC 4:
En niños y adolescentes con crisis asmática moderada (hospitalizado) o severa, considerar la duración máxima del tratamiento con corticoides de
acuerdo con el criterio de médico tratante.
4. Anticolinérgicos + Agonistas β2 vs Agonistas β2
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En niños y adolescentes con crisis asmática leve, sugerimos brindar tratamiento con agonistas beta-2 sin anticolinérgicos.
(Recomendación condicional a favor, Certeza de la evidencia: baja)
BPC 1:
En niños y adolescentes con crisis asmática leve, con respecto al manejo con agonistas beta-2, indicar terapia inhalatoria con salbutamol de acuerdo con su peso cada 20 minutos. Esto se realizará a criterio del médico tratante considerando las siguientes dosis máximas del salbutamol:
• <20 kg: 500 mcg/dosis (5 puffs de 100 mcg/puff)
• ≥20 kg: 1000 mcg/dosis (10 puffs de 100 mcg/puff)
Recomendación 2:
En niños y adolescentes con crisis asmática moderada, sugerimos brindar tratamiento con agonistas beta-2 sin anticolinérgicos.
(Recomendación condicional a favor, Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática moderada que no responde al tratamiento inicial con agonistas beta-2 de acción corta luego de una hora, considerar terapia inhalatoria con bromuro de ipratropio 2 a 6 puff con aerocámara o espaciador cada 20 minutos en combinación con salbutamol
inhalado.
Recomendación 3:
En niños y adolescentes con crisis asmática severa, sugerimos brindar tratamiento con agonistas beta-2 y añadir anticolinérgicos como tratamiento coadyuvante.
(Recomendación condicional a favor, Certeza de la evidencia: baja)
BPC 1:
En niños y adolescentes con crisis asmática severa, con respecto al uso de anticolinérgicos, considerar agregar al inicio del tratamiento la terapia
inhalatoria con bromuro de ipratropio 4 a 6 puff con aerocámara o espaciador cada 20 minutos.
5. Sulfato de magnesio
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En niños y adolescentes con crisis asmática moderada en caso de no respuesta al tratamiento inicial, sugerimos agregar sulfato de magnesio.
(Recomendación condicional a favor, Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática moderada, en caso de brindar sulfato de magnesio como tratamiento, administrar con una dosis de 40-50 mg/kg (máximo 2 gramos) en infusión lenta en 20 minutos.
BPC 2:
Al brindar sulfato de magnesio, monitorizar la respuesta clínica y posibles eventos adversos (control de saturación y frecuencia cardiaca)
considerando las dosis administradas y el tiempo de administración.
Recomendación 2:
En niños y adolescentes con crisis asmática severa, en caso de no responder al tratamiento inicial, sugerimos agregar sulfato de magnesio.
(Recomendación condicional a favor Certeza de la evidencia: muy baja)
BPC 1:
En niños y adolescentes con crisis asmática severa, en caso de brindar sulfato de magnesio como tratamiento de segunda línea, administrar con una dosis de 40-50 mg/kg (máximo 2 gramos) en infusión lenta en 20 minutos.
BPC 2:
En niños y adolescentes con crisis asmática severa que no respondan al tratamiento con broncodilatadores y sulfato de magnesio sistémico o aquellos pacientes catalogados como asma de riesgo vital, considerar el manejo en la unidad de cuidados intensivos.
6. Intervenciones educativas
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En niños y adolescentes con crisis asmática, sugerimos brindar intervenciones educativas basadas en el autocontrol del asma al alta de la emergencia.
Recomendación condicional a favor, Certeza de la evidencia: muy baja
BPC 1:
En cuanto a las intervenciones educativas que se deben brindar antes del alta de emergencia, esto incluye lo siguiente:
• Plan de acción por escrito,
• Verificar técnica inhalatoria,
• Signos de alarma (empeoramiento del cuadro respiratorio),
• Necesidad de control por consultorio externo a las 72 horas,
• Educación sobre factores de riesgo y desencadenantes del asma, y proporcionar información educativa y apoyo emocional al niño y la
familia (esto se reforzará por consultorio externo).
BPC 2:
La intervención educativa debe considerar la participación del equipo multidisciplinario, involucrando al personal de enfermería, farmacéutico, educador o profesional médico o de salud asociado con el hospital o remitido por el hospital.
BPC 3:
En niños y adolescentes con crisis asmática, considerar el alta cuando se cumplan todos los siguientes criterios:
• Pulmonary Score ≤ 3 puntos por más de una hora
• Adecuada tolerancia oral
Referencias bibliográficas
1. N.G. Papadopoulos, H. Arakawa, K.H. Carlsen, A. Custovic, J. Gern, R. Lemanske, et al. International consensus on (ICON) pediatric asthma. Allergy, 67 (2012), pp. 976-997.
2. Fu LS, Tsai MC. Asthma Exacerbation in Children: A Practical Review. Pediatrics & Neonatology. 2014 Apr 1;55(2):83–91.
3. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet. 1998 Apr 25;351(9111):1225-32.
4. Asher MI, Keil U, Anderson HR, Beasley R, Crane J, Martinez F, Mitchell EA, Pearce N, Sibbald B, Stewart AW, et al. International Study of Asthma and Allergies in Childhood (ISAAC): rationale and methods. Eur Respir J. 1995 Mar;8(3):483-91. doi: 10.1183/09031936.95.08030483.
5. Nunes C, Pereira AM, Morais-Almeida M. Asthma costs and social impact. Asthma research and practice. 2017;3:1-.
6. Ocampo J, Gaviria R, Sánchez J. Prevalencia del asma en América Latina. Mirada crítica a partir del ISAAC y otros estudios. Revista Alergia México. 2017;64(2):188-97.
7. Lezana V, Arancibia JC. Consideraciones epidemiológicas del asma en Latinoamérica. Neumología Pediátrica. 2006;1(2):45-8.
8. Robinson CL, Baumann LM, Gilman RH, Romero K, Combe JM, Cabrera L, et al. The Peru Urban versus Rural Asthma (PURA) Study: methods and baseline quality control data from a cross-sectional investigation into the prevalence, severity, genetics, immunology and environmental factors affecting asthma in adolescence in Peru. BMJ open. 2012;2.
9. Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
10. Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
11. Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
12. Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane
Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
13. Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
14. Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
15. Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
16. Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
17. Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
18. Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines:
14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
19. Chacko J, King C, Harkness D, Messahel S, Grice J, Roe J, Mullen N, Sinha IP, Hawcutt DB; PERUKI. Pediatric acute asthma scoring systems: a systematic review and survey of UK practice. J Am Coll Emerg Physicians Open. 2020 Jun 2;1(5):1000-1008. doi: 10.1002/emp2.12083.
20. Bekhof J, Reimink R, Brand PL. Systematic review: insufficient validation of clinical scores for the assessment of acute dyspnoea in wheezing children. Paediatr Respir Rev. 2014 Mar;15(1):98-112. doi: 10.1016/j.prrv.2013.08.004.
21. SIGN Guideline development group. SIGN158: British guideline on the management of asthma. Scottish Intercollegiate Guidelines Network, 2019. Epub 2019 Jul.
22. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2023. Update July 2023. Available from: www.ginasthma.org.
23. Sheffield Children’s National Health Service Foundation Trust. Acute Asthma Management
Guideline for Infants Greater than 2 Years Old. 2023.
24. Guía Española para el Manejo del Asma (GEMA) 5.0 [consultado 10 Dec 2023] Disponible en: https://www.gemasma.com/.
25. Larenas-Linnemann D, Salas-Hernández J, Vázquez-García JC, Ortiz-Aldana I, FernándezVega M, Del Río-Navarro BE, et al. Guía Mexicana del Asma 2017. Rev Alerg Mex. 2017;64 Supl 1:s11-s128.
26. Payares-Salamanca L, Contreras-Arrieta S, Florez-García V, Barrios-Sanjuanelo A, Stand- Niño I, Rodriguez-Martinez CE. Metered-dose inhalers versus nebulization for the delivery of albuterol for acute exacerbations of wheezing or asthma in children: A systematic review with meta-analysis. Pediatr Pulmonol. 2020 Dec;55(12):3268-3278.
27. Roncada C, Andrade J, Bischoff LC, Pitrez PM. Comparison of two inhalational techniques for bronchodilator administration in children and adolescents with acute asthma crisis: a Meta-analysis. Rev Paul Pediatr. 2018 Jul-Sep;36(3):364-371. doi: 10.1590/1984- 0462/;2018;36;3;00002.
28. Cates CJ, Welsh EJ, Rowe BH. Holding chambers (spacers) versus nebulisers for beta-agonist treatment of acute asthma. Cochrane Database Syst Rev. 2013 Sep 13;2013(9):CD000052. doi: 10.1002/14651858.CD000052.pub3.
29. Snider MA, Wan JY, Jacobs J, Kink R, Gilmore B, Arnold SR. A Randomized Trial Comparing Metered Dose Inhalers and Breath Actuated Nebulizers. J Emerg Med. 2018 Jul;55(1):7-14. doi: 10.1016/j.jemermed.2018.03.002.
30. Mitselou N, Hedlin G, Hederos CA. Spacers versus nebulizers in treatment of acute asthma
– a prospective randomized study in preschool children. J Asthma. 2016 Dec;53(10):1059- 62. doi: 10.1080/02770903.2016.1185114.
31. Iramain R, Castro-Rodriguez JA, Jara A, Cardozo L, Bogado N, Morinigo R, De Jesús R. Salbutamol and ipratropium by inhaler is superior to nebulizer in children with severe acute asthma exacerbation: Randomized clinical trial. Pediatr Pulmonol. 2019 Apr;54(4):372-377. doi: 10.1002/ppul.24244.
32. Trottier ED, Chan K, Allain D, Chauvin-Kimoff L. Managing an acute asthma exacerbation in children. Paediatr Child Health. 2021 Nov 11;26(7):438-439. doi: 10.1093/pch/pxab058.
33. Kirkland SW, Vandermeer B, Campbell S, Villa-Roel C, Newton A, Ducharme FM, et al. Evaluating the effectiveness of systemic corticosteroids to mitigate relapse in children assessed and treated for acute asthma: A network meta-analysis. The Journal of asthma : official journal of the Association for the Care of Asthma. 2019;56(5):522-33.
34. Su XM, Yu N, Kong LF, Kang J. Effectiveness of inhaled corticosteroids in the treatment of acute asthma in children in the emergency department: a meta-analysis. Annals of medicine. 2014;46(1):24-30.
35. Smith M, Iqbal SMSI, Rowe BH, N’Diaye T. Corticosteroids for hospitalised children with acute asthma. Cochrane Database of Systematic Reviews 2003, Issue 1. Art. No.: CD002886. DOI: 10.1002/14651858.CD002886.
36. Beckhaus AA, Riutort MC, Castro-Rodriguez JA. Inhaled versus systemic corticosteroids for acute asthma in children. A systematic review. Pediatric Pulmonology. 2014 Apr;49(4):326- 34.
37. Kearns N, Maijers I, Harper J, Beasley R, Weatherall M. Inhaled corticosteroids in acute asthma: a systemic review and meta-analysis. The Journal of Allergy and Clinical Immunology: In Practice. 2019; 8(2): 605-17.
38. Sawanyawisuth K, Chattakul P, Khamsai S, Boonsawat W, Ladla A, Chotmongkol V, Limpawattana P, Chindaprasirt J, Senthong V, Phitsanuwong C, Sawanyawisuth K. Role of inhaled corticosteroids for asthma exacerbation in children: An updated meta-analysis. Journal of Emergencies, Trauma, and Shock. 2020 Apr;13(2):161.
39. Scarfone RJ, Loiselle JM, Wiley 2nd JF, Decker JM, Henretig FM, Joffe MD. Nebulized dexamethasone versus oral prednisone in the emergency treatment of asthmatic children. Annals of emergency medicine. 1995 Oct;26(4):480-6.
40. Milani GK, Rosário Filho NA, Riedi CA, Figueiredo BC. Nebulized budesonide to treat acute asthma in children. Jornal de pediatria. 2004;80:106-12.
41. Schuh S, Dick PT, Stephens D, Hartley M, Khaikin S, Rodrigues L, Coates AL. High-dose inhaled fluticasone does not replace oral prednisolone in children with mild to moderate acute asthma. Pediatrics. 2006 Aug 1;118(2):644-50.
42. Yanagida N, Tomikawa M, Shukuya A, Iguchi M, Ebisawa M. Budesonide inhalation suspension versus methylprednisolone for treatment of moderate bronchial asthma attacks. World Allergy Organ J. 2015 May 5;8(1):14. doi: 10.1186/s40413-015-0065-0.
43. Manjra AI, Price J, Lenney W, Hughes S, Barnacle H. Efficacy of nebulized fluticasone propionate compared with oral prednisolone in children with an acute exacerbation of asthma. Respir Med. 2000 Dec;94(12):1206-14. doi: 10.1053/rmed.2000.0952.
44. Kirkland SW, Cross E, Campbell S, Villa-Roel C, Rowe BH. Intramuscular versus oral corticosteroids to reduce relapses following discharge from the emergency department for acute asthma. Cochrane Database of Systematic Reviews 2018, Issue 6. Art. No.: CD012629. DOI: 10.1002/14651858.CD012629.pub2.
45. Cai KJ, Su SQ, Wang YG, Zeng YM. Dexamethasone Versus Prednisone or Prednisolone for Acute Pediatric Asthma Exacerbations in the Emergency Department: A Meta-Analysis. Pediatr Emerg Care. 2021 Dec 1;37(12):e1139-e1144. doi: 10.1097/PEC.0000000000001926. PMID: 32149991.
46. Dahan E, El Ghazal N, Nakanishi H, El Haddad J, Matar RH, Tosovic D, Beran A, Than CA, Stiasny D. Dexamethasone versus prednisone/prednisolone in the management of pediatric patients with acute asthmatic exacerbations: a systematic review and meta- analysis. J Asthma. 2023 Aug;60(8):1481-1492. doi: 10.1080/02770903.2022.2155189.
47. Plotnick LH, Ducharme FM. Acute Asthma in Children and Adolescents: Should Inhaled Anticholinergics Be Added to β 2-Agonists?. American Journal of Respiratory Medicine. 2003 Apr;2:109-15.
48. Griffiths B, Ducharme FM. Combined inhaled anticholinergics and short-acting beta2- agonists for initial treatment of acute asthma in children. Cochrane Database Syst Rev. 2013 Aug 21;(8):CD000060. doi: 10.1002/14651858.CD000060.pub2.
49. Vézina K, Chauhan BF, Ducharme FM. Inhaled anticholinergics and short-acting beta(2)- agonists versus short-acting beta2-agonists alone for children with acute asthma in hospital. Cochrane Database Syst Rev. 2014 Jul 31;(7):CD010283. doi: 10.1002/14651858.CD010283.pub2.
50. Xu H, Tong L, Gao P, Hu Y, Wang H, Chen Z, Fang L. Combination of ipratropium bromide and salbutamol in children and adolescents with asthma: A meta-analysis. Plos one. 2021 Feb 23;16(2):e0237620.
51. Cheuk DK, Chau TC, Lee SL. A meta-analysis on intravenous magnesium sulphate for treating acute asthma. Arch Dis Child. 2005 Jan;90(1):74-7. doi: 10.1136/adc.2004.050005.
52. Mohammed S, Goodacre S. Intravenous and nebulised magnesium sulphate for acute asthma: systematic review and meta-analysis. Emerg Med J. 2007 Dec;24(12):823-30. doi: 10.1136/emj.2007.052050.
53. Shan Z, Rong Y, Yang W, Wang D, Yao P, Xie J, Liu L. Intravenous and nebulized magnesium sulfate for treating acute asthma in adults and children: a systematic review and meta- analysis. Respir Med. 2013 Mar;107(3):321-30. doi: 10.1016/j.rmed.2012.12.001.
54. Griffiths B, Kew KM. Intravenous magnesium sulfate for treating children with acute asthma in the emergency department. Cochrane Database of Systematic Reviews 2016, Issue 4. Art. No.: CD011050. DOI: 10.1002/14651858.CD011050.pub2.
55. Su Z, Li R, Gai Z. Intravenous and Nebulized Magnesium Sulfate for Treating Acute Asthma in Children: A Systematic Review and Meta-Analysis. Pediatr Emerg Care. 2018 Jun;34(6):390-395. doi: 10.1097/PEC.0000000000000909.
56. Mega TA, Gugsa H, Dejenie H, Hussen H, Lulseged K. Safety and Effectiveness of Magnesium Sulphate for Severe Acute Asthma Management Among Under-five Children: Systematic Review and Meta-analysis. J Asthma Allergy. 2023 Mar 3;16:241-247. doi: 10.2147/JAA.S390389.
57. Pruikkonen H, Tapiainen T, Kallio M, Dunder T, Pokka T, Uhari M, Renko M. Intravenous magnesium sulfate for acute wheezing in young children: a randomised double-blind trial. Eur Respir J. 2018 Feb 7;51(2):1701579. doi: 10.1183/13993003.01579-2017.
58. Torres S, Sticco N, Bosch JJ, Iolster T, Siaba A, Rocca Rivarola M, Schnitzler E. Effectiveness of magnesium sulfate as initial treatment of acute severe asthma in children, conducted in a tertiary-level university hospital: a randomized, controlled trial. Arch Argent Pediatr. 2012 Aug;110(4):291-6. English, Spanish. doi: 10.5546/aap.2012.eng.291.
59. Ciarallo L, Sauer AH, Shannon MW. Intravenous magnesium therapy for moderate to severe pediatric asthma: results of a randomized placebo controlled Trial. J Pediatr. 1996;129(6):809-14.
60. Ciarallo L, Brousseau D, Reinert S. Higher-dose intravenous magnesium therapy for children with moderate to severe acute asthma. Arch Pediatr Adolesc Med. 2000;154(10):979-83.
61. Devi PR, Kumar L, Singhi SC, Prasad R, Singh M. Intravenous magnesium sulfate in acute severe asthma not responding to conventional therapy. Indian Pediatr. 1997 May;34(5):389-97.
62. Ordonez GA, Phelan PD, Olinsky A, Robertson CF. Preventable factors in hospital admission for asthma. Archives of Disease in Childhood 1998;78:143-7.
63. Boyd M, Lasserson TJ, McKean MC, Gibson PG, Ducharme FM, Haby M. Interventions for educating children who are at risk of asthma-related emergency department attendance. Cochrane Database Syst Rev. 2009 Apr 15;2009(2):CD001290.
64. Hall KK, Petsky HL, Chang AB, O’Grady KF. Caseworker-assigned discharge plans to prevent hospital readmission for acute exacerbations in children with chronic respiratory illness. Cochrane Database Syst Rev. 2018 Nov 2;11(11):CD012315.
65. Coffman JM, Cabana MD, Yelin EH. Do school-based asthma education programs improve self-management and health outcomes? Pediatrics. 2009 Aug;124(2):729-42.
66. Coffman JM, Cabana MD, Halpin HA, Yelin EH. Effects of asthma education on children’s use
of acute care services: a meta-analysis. Pediatrics. 2008 Mar;121(3):575-86.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


