DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
ANEXOS
DESCARGAR
VERSIÓN CORTA
DESCARGAR RECOMENDACIONES Y FLUJOGRAMAS
vacio
vacio
Ámbito
- El ámbito asistencial incluye los servicios o unidades de atención donde se atiendan pacientes adultos con carcinoma hepatocelular y cirrosis hepática, en lo que corresponda a cada nivel de EsSalud.
Población y alcance
•Pacientes de 18 años a más con CHC y cirrosis hepática.
Autores
Grupo elaborador
Expertos clínicos:
- Javier Omar Díaz Ferrer
Médico especialista en gastroenterología, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú - Edgar Fermín Yan Quiroz
Médico especialista en cirugía oncológica, Hospital de Alta Complejidad “Virgen de la Puerta”, EsSalud, La Libertad, Perú - Carol Marianella Gonzales Gonzales
Médico especialista en oncología médica, Hospital IV Victor Lazarte Echegaray, EsSalud, La Libertad, Perú - Carlos Alejandro Arroyo Basto
Médico especialista en cirugía general, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú - Tayana Bedregal Mendoza
Médica especialista en cirugía pediátrica, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú - Cecilia Marina Yerén Paredes
Médica especialista en cirugía general y en cirugía hepatopancreatobiliar y trasplante, Hospital Nacional Guillermo Almenara Irigoyen, EsSalud, Lima, Perú - Sheyla Carolina Alfaro Ita
Médica especialista en radiología, Hospital Nacional Guillermo Almenara Irigoyen, EsSalud, Lima, Perú - José Antonio Velásquez Barbachán
Médico especialista en radiología intervencionista, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima
Metodólogos:
- Carolina Jaqueline Delgado Flores
Metodóloga, IETSI, EsSalud, Lima, Perú - Daniel Aarón Fernández Guzmán
Metodólogo, IETSI, EsSalud, Lima, Perú
Coordinadoras del grupo elaborador:
- Joan Caballero Luna
IETSI, EsSalud, Lima, Perú - Fabiola Mercedes Huaroto Ramírez
IETSI, EsSalud, Lima, Perú
Metodología
El procedimiento seguido para la elaboración de la presente GPC está detallado en su versión “in extenso”, la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html).
En resumen, se aplicó la siguiente metodología:
Conformación del grupo elaborador de la guía (GEG):
Se conformó un GEG, que incluyó metodólogos, médicos gastroenterólogos, oncólogos médicos, cirujanos oncólogos, cirujanos generales, y radiólogos intervencionistas.
En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 8 preguntas clínicas (Tabla 2), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (o outcomes) de interés.
Búsqueda y selección de la evidencia:
Para cada pregunta PICO, durante mayo del 2024, se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed y Central) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC). Cuando se encontraron RS de calidad aceptable según el instrumento A Measurement Tool to Assess Systematic Reviews-II (AMSTAR II) modificado por EsSalud (8), se escogió una para cada desenlace de interés, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia y cálculo de efectos absolutos:
Para cada desenlace de cada pregunta PICO, se evaluó la certeza de la evidencia siguiendo la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) (9).
Asimismo, se calcularon los efectos absolutos para cada desenlace (diferencias de riesgos para desenlaces dicotómicos, o diferencias de medias para desenlaces numéricos). Para el cálculo de las diferencias de riesgos, se consideró que la incidencia del desenlace en el grupo control fue la reportada por el cuerpo de la evidencia, salvo se mencione lo contrario para alguna pregunta.
Formulación de las recomendaciones:
El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, usando los marcos Evidence to Decision (EtD) de la metodología GRADE (10, 11). Para ello, tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Valores y preferencias de los pacientes, 3) Aceptabilidad por parte de los profesionales de salud y pacientes, 4) Equidad, 5) Factibilidad de las opciones en EsSalud, y 6) Uso de recursos. Luego de discutir estos criterios para cada pregunta, el GEG, por consenso o por mayoría simple, formuló cada recomendación, asignándole una fuerza (fuerte o condicional) y una certeza de la evidencia (alta, moderada, baja, o muy baja).
Formulación de buenas prácticas clínicas:
El GEG formuló buenas prácticas clínicas (BPC), usualmente en base a su experiencia clínica o a adopciones de otras guías o protocolos (Tabla 2).
Revisión por expertos externos:
La presente GPC fue revisada en reuniones con especialistas representantes de otras instituciones, y tomadores de decisiones de EsSalud. Asimismo, su versión extensa fue enviada por vía electrónica a un experto externo para su revisión (mencionados en la sección de agradecimientos). Cuando fue pertinente, el GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
La presente GPC tiene una vigencia de cinco años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
Flujogramas que resumen el contenido de la GPC
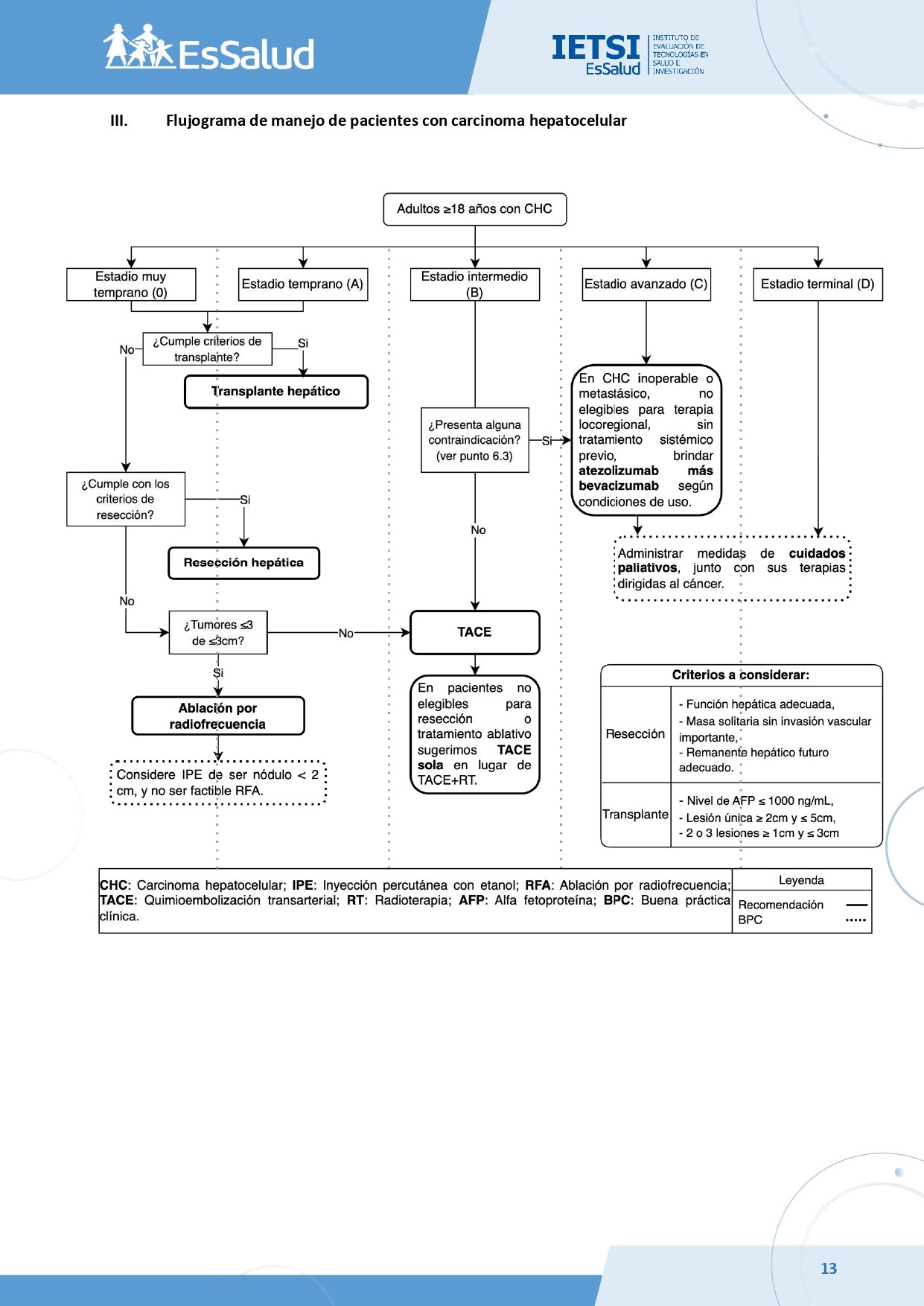
vacio
vacio
1. Resección quirúrgica o trasplante en CHC BCLC 0-A
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con CHC estadios tempranos (BCLC 0-A), se sugiere considerar tanto la resección quirúrgica como el trasplante hepático como opciones de tratamiento.
(Recomendación condicional a favor de ambas intervenciones, certeza muy baja de la evidencia)
BPC 1:
El panel reconoce la escasez de donantes en el Perú y la factibilidad de la resección quirúrgica como una alternativa aceptable y menos costosa.
2. Trasplante o RFA en CHC BCLC 0-A
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con CHC estadios tempranos (BCLC 0-A), se sugiere considerar tanto el trasplante hepático como la ablación por radiofrecuencia (RFA) como opciones de tratamiento según las características clínicas del paciente.
(Recomendación condicional a favor de ambas intervenciones, certeza muy baja de la evidencia)
BPC 1:
La RFA es una opción menos costosa y aceptable por pacientes y especialistas, aunque presenta menor sobrevida comparada con el trasplante hepático.
3. RFA o resección quirúrgica en CHC BCLC 0-A
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con CHC estadios tempranos (BCLC 0-A), se sugiere considerar la resección quirúrgica como una opción preferible a la ablación por radiofrecuencia (RFA).
(Recomendación condicional a favor del comparador, certeza muy baja de la evidencia)
BPC 1:
El GEG considera que los daños asociados a la RFA son más relevantes para los pacientes, justificando la preferencia por la resección quirúrgica.
4. TACE o RFA en CHC BCLC 0-A no resecable
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con CHC estadios tempranos (BCLC 0-A) no resecables, se sugiere considerar la ablación por radiofrecuencia (RFA) como opción preferible a la quimioembolización transarterial (TACE).
(Recomendación condicional a favor del comparador, certeza muy baja de la evidencia)
BPC 1:
Se reconoce la posible recurrencia local asociada a TACE y su menor beneficio comparado con la RFA en términos de recurrencia global.
5. IPE o RAFA en CHC BCLC 0-A
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En adultos con CHC estadios tempranos (BCLC 0-A), se sugiere la ablación por radiofrecuencia (RFA) sobre la inyección percutánea con etanol (IPE).
(Recomendación condicional a favor del comparador, certeza muy baja de la evidencia)
BPC 1:
La IPE podría aumentar la recurrencia local y la estancia hospitalaria en comparación con la RFA, justificando su menor preferencia.
6. Resección quirúrgica o TACE en CHC BCLC A-B
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con CHC estadio temprano (BCLC A), se sugiere considerar la resección quirúrgica como una opción preferible a la quimioembolización transarterial (TACE).
(Recomendación condicional a favor de la intervención, certeza baja de la evidencia)
Recomendación 2:
En pacientes con CHC estadio intermedio (BCLC B), se sugiere la quimioembolización transarterial (TACE) como opción preferible a la resección quirúrgica.
(Recomendación condicional a favor del comparador, certeza baja de la evidencia)
BPC 1:
El panel destaca que TACE es más factible y aceptable en este contexto.
7. TACE+RT o TACE sola en CHC BCLC B
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con CHC estadio intermedio (BCLC B), se sugiere la quimioembolización transarterial (TACE) sola como opción preferible a TACE más radioterapia (RT).
(Recomendación condicional a favor del comparador, certeza muy baja de la evidencia)
BPC 1:
El panel considera que el mayor costo y complejidad de TACE más RT no justifican su implementación generalizada.
8. Atezolizumab+Bevacizumab o Sorafenib en CHC Child-Pugh A
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En pacientes con CHC avanzado, se sugiere considerar atezolizumab más bevacizumab como opción preferible a sorafenib.
(Recomendación basada en dictamen preliminar de evaluación, certeza moderada de la evidencia)
BPC 1:
Se reconoce que los beneficios de prolongar la vida y mejorar la calidad de vida superan los riesgos asociados con eventos adversos manejables.
Referencias bibliográficas
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Versión 1.2024 (internet). Hepatocellular Carcinoma [citado 17.04.2024]. https://www.nccn.org/professionals/physician_gls/pdf/hcc.pdf.
- Oken MM, Creech RH, Tormey DC, et al. Toxicidad y criterios de respuesta del Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5:649.
- Prevención, diagnóstico y tratamiento del hepatocarcinoma. Guía de Evidencias y Recomendaciones: Guía de Práctica Clínica. México, CENETEC; 2019 [24 de abril 2024]. Disponible en: http.//www.cenetec-difusion.com/CMGPC/GPC-SS-582-19/ER.pdf.
- GLOBOCAN, International Agency for Research on Cancer (IARC). GLOBOCAN 2022 (version 1.1)-08.02.2024: Cancer today. Disponible en: https://gco.iarc.who.int/today/en/dataviz/bars?mode=cancer&cancers=39&types=1&sort_by=value0&populations=903_904_905_908_909_935&sexes=0&include_nmsc_other=0&group_cancers=1&multiple_cancers=1&group_populations=1.
- Díaz-Ferrer J, Liza-Baca E. Hepatocarcinoma: Estado del arte. Diagnóstico [nternet]. 28 de agosto de 2022 [citado 16 de octubre de 2024];61(3):e381. isponible en: https://revistadiagnostico.fihu.org.pe/index.php/diagnostico/article/view/381.
- Marrero JA, Kulik LM, Sirlin CB, et al.Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology 2018;68:723-750.
- European Association forthe Study of the Liver.Electronic address: easloffice@easloffice.eu, European Association for the StudyoftheLiver.EASL ClinicalPracticeGuidelines: Managementofhepatocellularcarcinoma.JHepatol.2018 Jul;69(1):182-236.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. bmj. 2017;358:j4008.
- Balshem H, Helfand M, Schünemann HJ, Oxman AD, Kunz R, Brozek J, et al. GRADE guidelines: 3. Rating the quality of evidence. Journal of clinical epidemiology. 2011;64(4):401-6.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Mendoza, Marvin Jonne. The Philippine Clinical Practice Guidelines for the Diagnosis and Management of Hepatocellular Carcinoma 2021. Philippine Journal of Internal Medicine. 59. 166-195.
- European Association for the Study of the Liver. EASL Clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2018; 69:182-236.
- Drefs M, Schoenberg MB, Börner N, Koliogiannis D, Koch DT, Schirren MJ, Andrassy J, Bazhin AV, Werner J, Guba MO. Changes of long-term survival of resection and liver transplantation in hepatocellular carcinoma throughout the years: A meta-analysis. Eur J Surg Oncol. 2024 Mar;50(3):107952. doi: 10.1016/j.ejso.2024.107952.
- Schoenberg MB, Bucher JN, Vater A, Bazhin AV, Hao J, Guba MO, Angele MK, Werner J, Rentsch M. Resection or Transplant in Early Hepatocellular Carcinoma. Dtsch Arztebl Int. 2017 Aug 7;114(31-32):519-526. doi: 10.3238/arztebl.2017.0519.
- Thein HH, Isaranuwatchai W, Qiao Y, Wong K, Sapisochin G, Chan KKW, Yoshida EM, Earle CC. Cost-effectiveness analysis of potentially curative and combination treatments for hepatocellular carcinoma with person-level data in a Canadian setting. Cancer Med. 2017 Sep;6(9):2017-2033. doi: 10.1002/cam4.1119.
- Ivanics T, Rajendran L, Abreu PA, Claasen MPAW, Shwaartz C, Patel MS, Choi WJ, Doyle A, Muaddi H, McGilvray ID, Selzner M, Beecroft R, Kachura J, Bhat M, Selzner N, Ghanekar A, Cattral M, Sayed B, Reichman T, Lilly L, Sapisochin G. Long-term outcomes of ablation, liver resection, and liver transplant as first-line treatment for solitary HCC of 3 cm or less using an intention-to-treat analysis: A retrospective cohort study. Ann Med Surg (Lond). 2022 Apr 20;77:103645. doi: 10.1016/j.amsu.2022.103645.
- Zhuang BW, Li W, Wang W, Li B, Lu MD, Kuang M, Xie XH, Xie XY. Treatment effect of radiofrequency ablation versus liver transplantation and surgical resection for hepatocellular carcinoma within Milan criteria: a population-based study. Eur Radiol. 2021 Jul;31(7):5379-5389. doi: 10.1007/s00330-020-07551-9.
- Kutlu OC, Chan JA, Aloia TA, Chun YS, Kaseb AO, Passot G, Yamashita S, Vauthey JN, Conrad C. Comparative effectiveness of first-line radiofrequency ablation versus surgical resection and transplantation for patients with early hepatocellular carcinoma. Cancer. 2017 May 15;123(10):1817-1827. doi: 10.1002/cncr.30531.
- Hu L, Lin J, Wang A, Shi X, Qiao Y. Comparison of liver resection and radiofrequency ablation in long-term survival among patients with early-stage hepatocellular carcinoma: a meta-analysis of randomized trials and high-quality propensity score-matched studies. World J Surg Oncol. 2024 Feb 19;22(1):56. doi: 10.1186/s12957-024-03330-8.
- Yu C, Wu S, Zhao J, Lu J, Zhao T, Wei Y, Long C, Lin T, He D, Wei G. Evaluation of efficacy, safety and treatment-related outcomes of percutaneous radiofrequency ablation versus partial hepatectomy for small primary liver cancer meeting the Milan criteria: A systematic review and meta-analysis of randomized controlled trials. Clin Res Hepatol Gastroenterol. 2020 Oct;44(5):718-732. doi: 10.1016/j.clinre.2019.12.012.
- Komorizono Y., Oketani M., Sako K., Yamasaki N., Shibatou T., Maeda M., Kohara K., Shigenobu S., Ishibashi K., Arima T. Risk factors for local recurrence of small hepatocellular carcinoma tumors after a single session, single application of percutaneous radiofrequency ablation. Cancer. 2003;97:1253–1262. doi: 10.1002/cncr.11168.
- Ishikawa K, Chiba T, Ooka Y, et al. Transarterial chemoembolization as a substitute to radiofrequency ablation for treating Barcelona Clinic Liver Cancer stage 0/A hepatocellular carcinoma. Oncotarget. 2018;9(30):21560-21568. Published 2018 Apr 20. doi:10.18632/oncotarget.25108.
- Chow R, Simone CB 2nd, Jairam MP, Swaminath A, Boldt G, Lock M. Radiofrequency ablation vs radiation therapy vs transarterial chemoembolization vs yttrium 90 for local treatment of liver cancer – a systematic review and network meta-analysis of survival data. Acta Oncol. 2022;61(4):484-494. doi:10.1080/0284186X.2021.2009563.
- Yang S, Lin H, Song J. Efficacy and safety of various primary treatment strategies for very early and early hepatocellular carcinoma: a network meta-analysis. Cancer Cell Int. 2021;21(1):681. Published 2021 Dec 19. doi:10.1186/s12935-021-02365-1.
- Luo W, Zhang Y, He G, Yu M, Zheng M, Liu L, Zhou X. Effects of radiofrequency ablation versus other ablating techniques on hepatocellular carcinomas: a systematic review and meta-analysis. World J Surg Oncol. 2017 Jul 10;15(1):126. doi: 10.1186/s12957-017-1196-2.
- Majumdar A, Roccarina D, Thorburn D, Davidson BR, Tsochatzis E, Gurusamy KS. Management of people with early‐ or very early‐stage hepatocellular carcinoma. Cochrane Database of Systematic Reviews 2017, Issue 3. Art. No.: CD011650. DOI: 10.1002/14651858.CD011650.pub2. Accessed 31 July 2024.
- Romano P, Busti M, Billato I, D’Amico F, Marchegiani G, Pelizzaro F, Vitale A, Cillo U. Liver resection versus radiofrequency ablation or trans-arterial chemoembolization for early-stage (BCLC A) oligo-nodular hepatocellular carcinoma: meta-analysis. BJS Open. 2024 Jan 3;8(1):zrad158. doi: 10.1093/bjsopen/zrad158.
- Vogel A, Martinelli E; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org; ESMO Guidelines Committee. Updated treatment recommendations for hepatocellular carcinoma (HCC) from the ESMO Clinical Practice Guidelines. Ann Oncol. 2021;32(6):801-805. doi:10.1016/j.annonc.2021.02.014.
- Korean Liver Cancer Study Group (KLCSG); National Cancer Center, Korea (NCC). 2014 KLCSG-NCC Korea Practice Guideline for the Management of Hepatocellular Carcinoma. Gut Liver. 2015;9(3):267-317. doi:10.5009/gnl14460.
- Kudo M, Matsui O, Izumi N, et al. JSH Consensus-Based Clinical Practice Guidelines for the Management of Hepatocellular Carcinoma: 2014 Update by the Liver Cancer Study Group of Japan. Liver Cancer. 2014;3(3-4):458-468. doi:10.1159/000343875.
- Bogdanovic A, Djokic Kovac J, Zdujic P, Djindjic U, Dugalic V. Liver resection versus transarterial chemoembolisation for the treatment of intermediate hepatocellular carcinoma: a systematic review and meta-analysis. Int J Surg. 2023 May 1;109(5):1439-1446. doi: 10.1097/JS9.0000000000000344.
- Wang P, Zhang D, Fang C, Gan Y, Luo B, Yang XL, Peng FY, Li B, Su S. Partial hepatectomy vs. transcatheter arterial chemoembolization for multiple hepatocellular carcinomas of BCLC-B stage: A meta-analysis of high-quality studies. Eur J Surg Oncol. 2022 Aug;48(8):1685-1691. doi: 10.1016/j.ejso.2022.04.017.
- Lu L, Zeng J, Wen Z, Tang C, Xu N. Transcatheter arterial chemoembolisation followed by three-dimensional conformal radiotherapy versus transcatheter arterial chemoembolisation alone for primary hepatocellular carcinoma in adults. Cochrane Database Syst Rev. 2019;2(2):CD012244. Published 2019 Feb 16. doi:10.1002/14651858.CD012244.pub2.
- Hegde PS, Wallin JJ, Mancao C. Predictive markers of anti-VEGF and emerging role of angiogenesis inhibitors as immunotherapeutics. Semin Cancer Biol. 2018;52(Pt 2):117-124. doi:10.1016/j.semcancer.2017.12.002.
- Wallin JJ, Bendell JC, Funke R, et al. Atezolizumab in combination with bevacizumab enhances antigen-specific T-cell migration in metastatic renal cell carcinoma. Nat Commun. 2016;7:12624. Published 2016 Aug 30. doi:10.1038/ncomms12624.
- IETSI – EsSalud. Eficacia y seguridad de atezolizumab en combinación con bevacizumab para el tratamiento de primera línea de pacientes adultos con carcinoma hepatocelular no resecable o metastásico. Dictamen Preliminar de Evaluación de Tecnología Sanitaria N.° 035-DETS-IETSI-2022. Lima, Perú. 2022.
- Cheng AL, Qin S, Ikeda M, et al. Updated efficacy and safety data from IMbrave150: Atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol. 2022;76(4):862-873. doi:10.1016/j.jhep.2021.11.030.
- Finn, Richard S., Shukui Qin, Masafumi Ikeda, Peter R. Galle, Michel Ducreux, Tae You Kim, Masatoshi Kudo, et al. 2020. «Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma.» N Engl J Med 382: 1894-1905. doi:10.1056/NEJMoa1915745.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


