DESCARGAR
VERSIÓN EXTENSA
DESCARGAR
VERSIÓN CORTA
DESCARGAR
ANEXOS
DESCARGAR
FLUJOGRAMA
vacio
vacio
Ámbito
- Esta guía debe ser usada en todos los establecimientos del seguro social del Perú (EsSalud), según lo correspondiente a su nivel de atención.
Población y alcance
- Población: Mujeres de la población general sin síntomas de cáncer mama de 40 a 74 años.
- Alcance: Tamizaje de cancér de mama.
Autores
Expertos clínicos:
- Salvatierra Romero, Guillermo
Médico radiólogo
Hospital Nacional Edgardo Rebagliati Martins, Lima, EsSalud - Limas Cline, Jackeline
Médica radióloga
Hospital Alberto Sabogal Sologuren, Lima, EsSalud - Cunia Perez, Marleni
Médica gineco-oncóloga
Hospital Nacional Almanzor Aguinaga Asenjo, Lambayeque, EsSalud - Aguilar Ramos, Pedro
Médico gineco-oncólogo
Hospital Nacional Edgardo Rebagliati Martins, Lima, EsSalud - Noa Bendezú, Bibiana.
Médica ginecóloga-obstetra
Hospital Luis Negreiros Vega, Lima, EsSalud - Torres Peña, Lourdes.
Médica ginecóloga-obstetra
Hospital Luis Negreiros Vega, Lima, EsSalud - Mejia Azañero, Jose Miguel
Médico de familia
Centro de atención Primaria III San Isidro, Lima, EsSalud - Ortiz Regis, Raúl.
Médico de familia
Policlínico Agustín Gavidia Salcedo, Lambayeque, EsSalud - Cueva Pérez, María del Rosario
Cirugía oncológica de mamas, tejidos blandos y piel
Hospital Nacional Guillermo Almenara Irigoyen - Tapia Amaya, José Felipe
Cirugía oncológica de mamas, tejidos blandos y piel
Hospital Nacional Guillermo Almenara Irigoyen
Metodólogos:
- Becerra Chauca, Naysha Yamilet
Metodóloga
IETSI, EsSalud, Lima, Perú - Nieto Gutierrez, Wendy Carolina
Metodóloga
IETSI, EsSalud, Lima, Perú
Gestores:
- Salvador Salvador, Stefany
Coordinadora del grupo elaborador
IETSI, EsSalud, Lima, Perú - Santos Sánchez, Vladimir Ernesto
Coordinador del grupo elaborador
IETSI, EsSalud, Lima, Perú
Descargar PDF con más información sobre la filiación y rol de los autores.
Metodología
Resumen de la metodología:
- Conformación del GEG: La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia, del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud), conformó un grupo elaborador de la guía (GEG), que incluyó médicos especialistas y metodólogos.
- Planteamiento de preguntas clínicas: En concordancia con los objetivos y alcances de esta GPC, se formularon las preguntas clínicas.
- Búsqueda de la evidencia para cada pregunta: Para cada pregunta clínica, se realizaron búsquedas de revisiones sistemáticas (publicadas como artículos científicos o guías de práctica clínica). De no encontrar revisiones de calidad, se buscaron estudios primarios, cuyo riesgo de sesgo fue evaluado usando herramientas estandarizadas.
- Evaluación de la certeza de la evidencia: Para graduar la certeza de la evidencia, se siguió la metodología Grading of Recommendations Assessment, Development, and Evaluation (GRADE), y se usaron tablas de Summary of Findings (SoF).
- Formulación de las recomendaciones: El GEG revisó la evidencia recolectada para cada una de las preguntas clínicas en reuniones periódicas, en las que formuló las recomendaciones usando la metodología GRADE, otorgándole una fuerza a cada una. Para ello, se tuvo en consideración los beneficios y daños de las opciones, valores y preferencias de los pacientes, aceptabilidad, factibilidad, equidad y uso de recursos. Estos criterios fueron presentados y discutidos, tomando una decisión por consenso o mayoría simple. Asimismo, el GEG emitió puntos de buenas prácticas clínicas (BPC) sin una evaluación formal de la evidencia, y mayormente en base a su experiencia clínica.
- Revisión externa: La presente GPC fue revisada en reuniones con profesionales representantes de otras instituciones, tomadores de decisiones, y expertos externos.
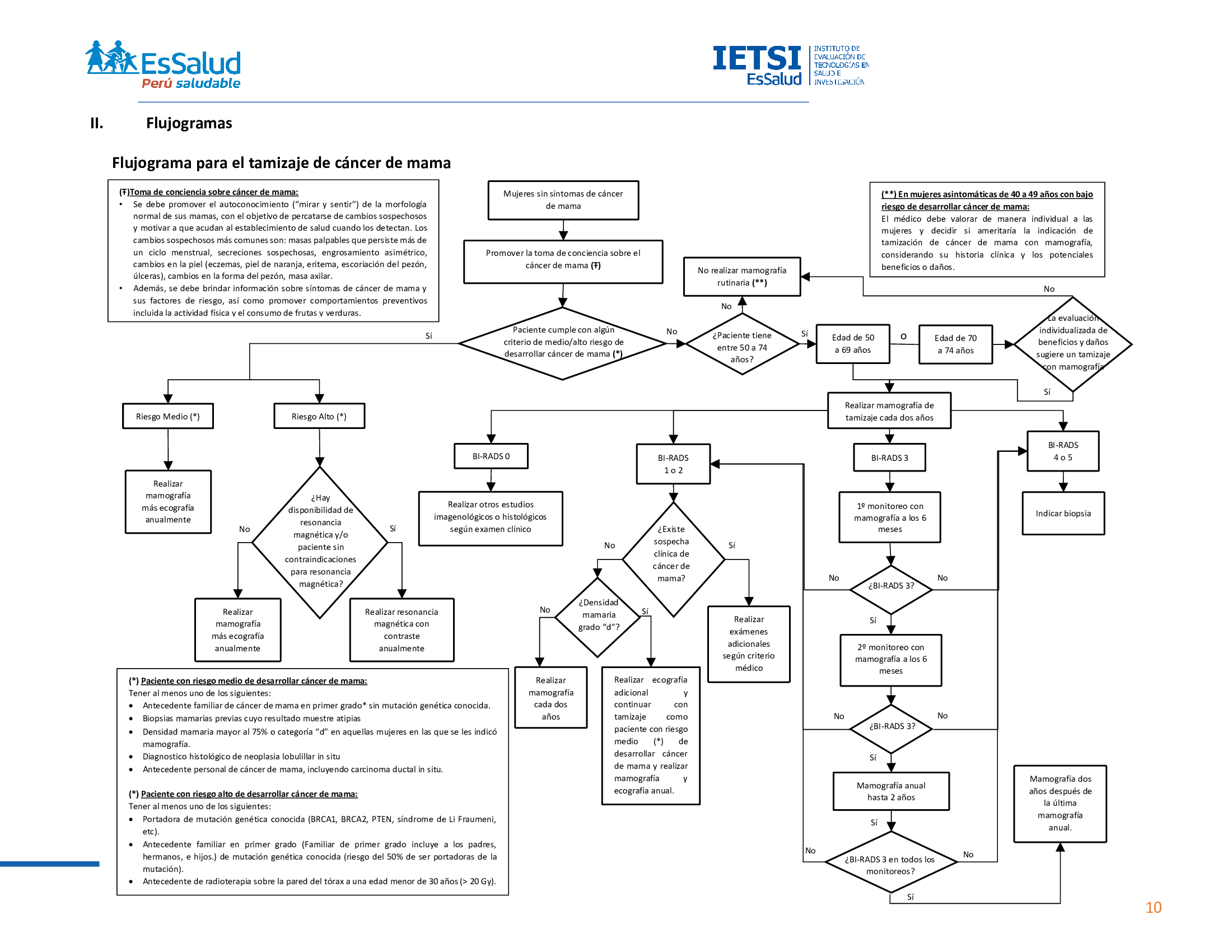
Flujograma que resume el contenido de la GPC
Flujograma para el tamizaje de cáncer de mama
vacio
vacio
1. Autoexamen de mama en sintomáticas
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
El autoexamen rutinario de mamas no ha mostrado disminuir la mortalidad, pero sí aumentar el número de biopsias. Por ello, recomendamos que el autoexamen no se indique de manera sistemática como estrategia de tamizaje. (Recomendación fuerte en contra, certeza baja de la evidencia)
BPC 1:
Se debe promover la toma de conciencia sobre el cáncer de mama, es decir aumentar la percepción de la seriedad de esta condición. Para ello, se debe promover el autoconocimiento (“mirar y sentir”) de la morfología normal de sus mamas, con el objetivo de percatarse de cambios sospechosos y motivar a que acudan al establecimiento de salud cuando los detectan. Los cambios sospechosos más comunes son: masas palpables que persisten más de un ciclo menstrual, secreciones sospechosas, engrosamiento asimétrico, cambios en la piel (eczemas, piel de naranja, eritema, escoriación del pezón y úlceras), cambios en la forma del pezón y masa axilar
Además, se debe brindar información sobre los síntomas del cáncer de mama y sus factores de riesgo, así como promover comportamientos preventivos, incluyendo la actividad física y el consumo de frutas y verduras.
2. Examen clínico de mama en asintomáticas
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
El examen clínico de mamas realizado de manera rutinaria y periódica en mujeres asintomáticas, presenta un alto porcentaje de falsos positivos y biopsias innecesarias, y sus beneficios son desconocidos, por ende, sugerimos no realizar el examen clínico de mama de manera regular como herramienta de tamizaje de cáncer de mamas.
Esto no impide el uso de examen clínico como parte de la evaluación general de las pacientes que acuden a la consulta. (Recomendación condicional en contra, certeza muy baja de la evidencia)
3. Mamografía con resonancia magnética
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres asintomáticas con alto riesgo de desarrollar cáncer de mama, sugerimos realizar resonancia magnética con contraste anualmente, como parte de la estrategia de tamizaje. (Recomendación condicional a favor, certeza moderada de la evidencia)
Recomendación 2:
En mujeres asintomáticas con riesgo medio de desarrollar cáncer de mama, recomendamos realizar mamografía más ecografía anualmente como parte de la estrategia de tamizaje. (Recomendación fuerte a favor, certeza moderada de la evidencia)
BPC 1:
Se considera una mujer de alto riesgo para cáncer de mama si tiene una o más de las siguientes características:
- Portadora de mutación genética conocida (BRCA1, BRCA2, PTEN, síndrome de Li Fraumeni, etc).
- Antecedente familiar en primer grado (padres, hermanos o hijos) de mutación genética conocida (riesgo del 50% de ser portadoras de la mutación).
- Antecedente de radioterapia sobre la pared del tórax a una edad menor de 30 años (> 20 Gy).
- Riesgo en el transcurso de la vida mayor al 30%, estimado por alguno de los modelos existentes (GPCl, BRCAPRO, BOADICEA, Tyrer-Cuzicky u otros).
Se considera una mujer de riesgo medio para cáncer de mama si tiene uno o más de los siguientes antecedentes:
- Antecedente familiar de cáncer de mama en primer grado (padres, hermanos o hijos) sin mutación genética conocida.
- Biopsias mamarias previas cuyo resultado muestre atipias
- Densidad mamaria mayor al 75% o categoría “d” en aquellas mujeres en las que se les indicó mamografía.
- Diagnostico histológico de neoplasia lobulillar in situ
- Antecedente personal de cáncer de mama, incluyendo carcinoma ductal in situ.
BPC 2:
En mujeres asintomáticas con alto riesgo de desarrollar cáncer de mama, cuando la resonancia magnética no se encuentre disponible o cuando haya contraindicación para realizarla (falla renal crónica severa o claustrofobia), realizar mamografía más ecografía anualmente.
4. Mamografía en mujeres asintomáticas
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres asintomáticas con bajo riesgo de desarrollar cáncer de mama entre 40 a 49 años de edad, sugerimos no realizar tamizaje de cáncer de mama de manera rutinaria con mamografía. (Recomendación condicional en contra, certeza muy baja de la evidencia)
Recomendación 2:
En mujeres asintomáticas con bajo riesgo de desarrollar cáncer de mama entre 50 a 69 años de edad, sugerimos realizar tamizaje de cáncer de mama de manera rutinaria con mamografía cada dos años. (Recomendación condicional a favor, certeza muy baja de la evidencia)
Recomendación 3:
En mujeres asintomáticas con bajo riesgo de desarrollar cáncer de mama de 70 a 74 años de edad, sugerimos realizar tamizaje de cáncer de mama con mamografía cada dos años solo después de una evaluación individualizada de los posibles beneficios y daños del tamizaje. (Recomendación condicional a favor, certeza muy baja de la evidencia)
BPC 1:
Se considera mujer con bajo riesgo de desarrollar cáncer de mama a aquella que no cumpla ningún criterio de riesgo medio o alto de desarrollar cáncer de mama.
BPC 2:
En mujeres asintomáticas de 50 a 74 años de edad, con bajo riesgo de desarrollar cáncer de mama y con resultado mamográfico de “estudio incompleto” (BI-RADS 0), realizar otros estudios imagenológicos o histológicos según examen clínico. El hallazgo mamográfico de densidad mamaria incrementada no será calificado como estudio incompleto (BI-RADS 0).
En mujeres con resultado mamográfico de “hallazgo probablemente benigno” (BI-RADS 3), monitorizar con otra mamografía al cabo de seis meses de la primera mamografía de tamizaje. Si la lesión no presenta cambios, monitorizar con mamografía al cabo de seis meses más. Si al cabo de un año de la primera mamografía se vuelve a asignar BI-RADS 3, el monitoreo puede ser cada año hasta que se cumplan 2 años de estabilidad. En cualquiera de estos seguimientos, la lesión podría ser degradada (BI-RADS 2) si se declara claramente benigna, o aumentada (BI-RADS 4 o 5) si hay un cambio con suficiente preocupación por malignidad.
En mujeres con resultado mamográfico de “hallazgo sospechoso” o “muy sugerente de malignidad” (BI-RADS 4 o 5), realizar una biopsia.
BPC 3:
Si existe sospecha clínica de alguna malignidad (masa palpable, anormalidades en la piel, anormalidades en el pezón, etc), una mamografía negativa (BI-RADS 1 o 2) no debe impedir la realización de exámenes adicionales.
BPC 4:
En mujeres asintomáticas entre 40 a 49 años con bajo riesgo de desarrollar cáncer de mama, el médico debe valorar de manera individual a las pacientes para decidir si ameritaría la indicación de tamizaje de cáncer de mama con mamografía, considerando su historia clínica y los potenciales beneficios y daños.
5. Ultrasonografia mamaria adicional
Descargar PDF con el desarrollo de la pregunta.
Recomendación 1:
En mujeres con bajo riesgo de desarrollar cáncer de mama, a quienes se les indicó mamografía de tamizaje, obtuvieron resultado negativo (BI-RADS 1 o 2) y hallazgo de densidad mamaria incrementada (BI-RADS c), sugerimos no realizar ultrasonografía mamaria adicional. (Recomendación condicional en contra, certeza muy baja de la evidencia)
Referencias bibliográficas
-
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: a cancer journal for clinicians. 2021;71(3):209-49.
- Łukasiewicz S, Czeczelewski M, Forma A, Baj J, Sitarz R, Stanisławek A. Breast Cancer-Epidemiology, Risk Factors, Classification, Prognostic Markers, and Current Treatment Strategies-An Updated Review. Cancers. 2021;13(17).
- Sanitaria OdIeI. Situación de morbilidad y mortalidad en Cáncer de Mama EsSalud 2008 – 2021. Lima: EsSalud; 2022.
- Migowski A, Silva GAE, Dias MBK, Diz M, Sant’Ana DR, Nadanovsky P. Guidelines for early detection of breast cancer in Brazil. II – New national recommendations, main evidence, and controversies. Cadernos de saude publica. 2018;34(6):e00074817.
- Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal. 2010;182(18):E839-E42.
- Ministerio de Salud. Documento técnico: Metodología para la de documento técnico elaboración guías de practica clínica. Lima, Perú: MINSA; 2015.
- Saz-Parkinson Z, Monteagudo-Piqueras O, Granados Ortega J, Martínez Mondéjar E, Labrador Cañadas MV. [«European Commission Initiative on Breast Cancer»: Selected Breast Cancer Screening Recommendations from the European Guidelines.]. Revista espanola de salud publica. 2020;94.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008.
- Higgins JP, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. Bmj. 2011;343:d5928.
- Wells G, Shea B, O’connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa (ON): Ottawa Hospital Research Institute; 2009. Available in March. 2016.
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155(8):529-36.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation—determinants of a recommendation’s direction and strength. Journal of clinical epidemiology. 2013;66(7):726-35.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj. 2016;353:i2016.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj. 2016;353:i2089.
- Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. Journal of clinical epidemiology. 2013;66(7):719-25.
- Kösters JP, Gøtzsche PC. Regular self‐examination or clinical examination for early detection of breast cancer. Cochrane Database of Systematic Reviews. 2003(2).
- Thomas DB, Gao DL, Ray RM, Wang WW, Allison CJ, Chen FL, et al. Randomized trial of breast self-examination in Shanghai: final results. Journal of the National Cancer Institute. 2002;94(19):1445-57.
- Moher D LJ. Breast cancer screening: Part A. An evidence report to inform an update of the Canadian Task Force on Preventive Health Care 2011 Guideline: Public Health Agency of Canada; 2017.
- Nelson HD, Tyne K, Naik A, Bougatsos C, Chan BK, Humphrey L. Screening for breast cancer: an update for the US Preventive Services Task Force. Annals of internal medicine. 2009;151(10):727-37.
- European Commission. European Commission Initiative on Breast Cancer (ECIBC): European guidelines on breast cancer screening and diagnosis Varese, Italia: European Union; 2017 [cited 2022 marzo]. Available from: https://healthcare-quality.jrc.ec.europa.eu/sites/default/files/Guidelines/EtDs/ECIBC_GLs_EtD_screening_50-69.pdf.
- Bevers TB, Helvie M, Bonaccio E, Calhoun KE, Daly MB, Farrar WB, et al. Breast cancer screening and diagnosis, version 3.2018, NCCN clinical practice guidelines in oncology. Journal of the National Comprehensive Cancer Network. 2018;16(11):1362-89.
- Migowski A, Silva GA, Dias MBK, Diz MDPE, Sant’Ana DR, Nadanovsky P. Guidelines for early detection of breast cancer in Brazil. II-New national recommendations, main evidence, and controversies. Cadernos de saude publica. 2018;34.
- O’Mahony M, Comber H, Fitzgerald T, Corrigan MA, Fitzgerald E, Grunfeld EA, et al. Interventions for raising breast cancer awareness in women. Cochrane Database of Systematic Reviews. 2017(2).
- Elghazaly H, Aref AT, Anderson BO, Arun B, Yip CH, Abdelaziz H, et al. The first BGICC consensus and recommendations for breast cancer awareness, early detection and risk reduction in low‐and middle‐income countries and the MENA region. International journal of cancer. 2021;149(3):505-13.
- Parikh JR. ACR Appropriateness Criteria on palpable breast masses. J Am Coll Radiol. 2007;4(5):285-8.
- Humphrey LL, Helfand M, Chan BK, Woolf SH. Breast cancer screening: a summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med. 2002;137(5 Part 1):347-60.
- Barton MB, Harris R, Fletcher SW. The rational clinical examination. Does this patient have breast cancer? The screening clinical breast examination: should it be done? How? Jama. 1999;282(13):1270-80.
- Nelson HD, Tyne K, Naik A, Bougatsos C, Chan BK, Humphrey L. Screening for breast cancer: an update for the U.S. Preventive Services Task Force. Ann Intern Med. 2009;151(10):727-37, w237-42.
- Saslow D, Boetes C, Burke W, Harms S, Leach MO, Lehman CD, et al. American Cancer Society guidelines for breast screening with MRI as an adjunct to mammography. CA Cancer J Clin. 2007;57(2):75-89.
- Sippo DA, Burk KS, Mercaldo SF, Rutledge GM, Edmonds C, Guan Z, et al. Performance of Screening Breast MRI across Women with Different Elevated Breast Cancer Risk Indications. Radiology. 2019;292(1):51-9.
- Saadatmand S, Geuzinge HA, Rutgers EJT, Mann RM, de Roy van Zuidewijn DBW, Zonderland HM, et al. MRI versus mammography for breast cancer screening in women with familial risk (FaMRIsc): a multicentre, randomised, controlled trial. Lancet Oncol. 2019;20(8):1136-47.
- Gobierno de Colombia. Guía de Práctica Clínica para la detección temprana, tratamiento integral, seguimiento y rehabilitación del cáncer de mama. In: Sistema General de Seguridad Social en Salud, editor. Colombia: Instituto de Evaluación Tecnológica en Salud; 2017.
- Venkataraman S SP, Lee C. Breast imaging for cancer screening: Mammography and ultrasonography: Uptodate; 2021 [cited 2022 June 3]. Available from: https://bibvirtual.upch.edu.pe:2050/contents/breast-imaging-for-cancer-screening-mammography-and-ultrasonography/abstract/2.
- Farber R, Houssami N, Wortley S, Jacklyn G, Marinovich ML, McGeechan K, et al. Impact of Full-Field Digital Mammography Versus Film-Screen Mammography in Population Screening: A Meta-Analysis. Journal of the National Cancer Institute. 2021;113(1):16-26.
- Barazi H, Gunduru M. Mammography BI RADS Grading. StatPearls. Treasure Island (FL): StatPearls Publishing
Copyright © 2022, StatPearls Publishing LLC.; 2022.
- Løberg M, Lousdal ML, Bretthauer M, Kalager M. Benefits and harms of mammography screening. Breast cancer research : BCR. 2015;17(1):63.
- Canelo-Aybar C, Ferreira DS, Ballesteros M, Posso M, Montero N, Solà I, et al. Benefits and harms of breast cancer mammography screening for women at average risk of breast cancer: A systematic review for the European Commission Initiative on Breast Cancer. Journal of medical screening. 2021;28(4):389-404.
- Nelson HD, Cantor A, Humphrey L, Fu R, Pappas M, Daeges M, et al. U.S. Preventive Services Task Force Evidence Syntheses, formerly Systematic Evidence Reviews. Screening for Breast Cancer: A Systematic Review to Update the 2009 US Preventive Services Task Force Recommendation. Rockville (MD): Agency for Healthcare Research and Quality (US); 2016.
- Gøtzsche PC, Jørgensen KJ. Screening for breast cancer with mammography. The Cochrane database of systematic reviews. 2013;2013(6):Cd001877.
- Bond M, Pavey T, Welch K, Cooper C, Garside R, Dean S, et al. Systematic review of the psychological consequences of false-positive screening mammograms. Health technology assessment (Winchester, England). 2013;17(13):1-170, v-vi.
- Salz T, Richman AR, Brewer NT. Meta-analyses of the effect of false-positive mammograms on generic and specific psychosocial outcomes. Psycho-oncology. 2010;19(10):1026-34.
- Hofvind S, Ponti A, Patnick J, Ascunce N, Njor S, Broeders M, et al. False-positive results in mammographic screening for breast cancer in Europe: a literature review and survey of service screening programmes. Journal of medical screening. 2012;19 Suppl 1:57-66.
- Mathioudakis AG, Salakari M, Pylkkanen L, Saz-Parkinson Z, Bramesfeld A, Deandrea S, et al. Systematic review on women’s values and preferences concerning breast cancer screening and diagnostic services. Psycho-oncology. 2019;28(5):939-47.
- Klarenbach S, Sims-Jones N, Lewin G, Singh H, Thériault G, Tonelli M, et al. Recommendations on screening for breast cancer in women aged 40-74 years who are not at increased risk for breast cancer. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne. 2018;190(49):E1441-e51.
- American College of Radiology. BI-RADS sistema de informes y registros de datos de estudios por imágenes de la mama. 5º ed. Buenos Aires: Ediciones Journal; 2016.
- Venkataraman S SP, Lee C,. Breast imaging for cancer screening: Mammography and ultrasonography: UpToDate; 2021 [updated 2021; cited 2022 July 1th]. Available from: https://bibvirtual.upch.edu.pe:2050/contents/breast-imaging-for-cancer-screening-mammography-and-ultrasonography?source=history_widget#H18.
- Luehmann N, Ascha M, Chwa E, Hackenberger P, Termanini K, Benning C, et al. A Single-Center Study of Adherence to Breast Cancer Screening Mammography Guidelines by Transgender and Non-Binary Patients. Annals of surgical oncology. 2022;29(3):1707-17.
- Boyd NF, Guo H, Martin LJ, Sun L, Stone J, Fishell E, et al. Mammographic density and the risk and detection of breast cancer. New England journal of medicine. 2007;356(3):227-36.
- Kim S, Tran TXM, Song H, Ryu S, Chang Y, Park B. Mammographic Breast Density, Benign Breast Disease, and Subsequent Breast Cancer Risk in 3.9 Million Korean Women. Radiology. 2022:212727.
- European Commission. European Commission Initiative on Breast Cancer (ECIBC): European guidelines on breast cancer screening and diagnosis. Tailored screening in women with high breast density: Hand-held ultrasound. Varese, Italia: European Union; 2019 [cited 2022 June]. Available from: https://healthcare-quality.jrc.ec.europa.eu/european-breast-cancer-guidelines/dense-breast/HHUS.
- Hadadi I, Rae W, Clarke J, McEntee M, Ekpo E. Diagnostic Performance of Adjunctive Imaging Modalities Compared to Mammography Alone in Women with Non-Dense and Dense Breasts: A Systematic Review and Meta-Analysis. Clinical breast cancer. 2021;21(4):278-91.
- Yuan WH, Hsu HC, Chen YY, Wu CH. Supplemental breast cancer-screening ultrasonography in women with dense breasts: a systematic review and meta-analysis. British journal of cancer. 2020;123(4):673-88.
- Rebolj M, Assi V, Brentnall A, Parmar D, Duffy SW. Addition of ultrasound to mammography in the case of dense breast tissue: systematic review and meta-analysis. British journal of cancer. 2018;118(12):1559-70.
- Melnikow J, Fenton JJ, Whitlock EP, Miglioretti DL, Weyrich MS, Thompson JH, et al. Supplemental Screening for Breast Cancer in Women With Dense Breasts: A Systematic Review for the U.S. Preventive Services Task Force. Ann Intern Med. 2016;164(4):268-78.
- Nothacker M, Duda V, Hahn M, Warm M, Degenhardt F, Madjar H, et al. Early detection of breast cancer: benefits and risks of supplemental breast ultrasound in asymptomatic women with mammographically dense breast tissue. A systematic review. BMC cancer. 2009;9(1):1-9.
Si tienes comentarios sobre el contenido de las guías de práctica clínica, puedes comunicarte con IETSI-EsSalud enviando un correo: gpcdireccion.ietsi@essalud.gob.pe

SUGERENCIAS
Si has encontrado un error en esta página web o tienes alguna sugerencia para su mejora, puedes comunicarte con EviSalud enviando un correo a evisalud@gmail.com


